聚对苯二甲酸乙二醇酯(PET)水解酶的高通量筛选:进展与挑战
韦 韧
(格莱夫斯瓦尔德大学 生物化学研究所,格莱夫斯瓦尔德 17489,德国)
石油基塑料在其不到百年的历史中给人类社会带来了翻天覆地的变化。在过去的几十年中,塑料在许多应用场景下逐渐取代了天然材料。塑料制品的大规模生产和使用不仅推动了众多产业的快速发展,同时也给人们的日常生活提供了许多便利。但是,另一方面,对塑料制品的依赖,特别是一次性塑料制品的广泛应用,给固体废弃物处理和环境污染防治造成了严峻的挑战[1-3]。根据Geyer 等[4]在2017年的一篇报道,截至2015年,全球大部分使用后的塑料并未被回收利用,而是通过填埋、丢弃的方式释放到了自然环境中。在20世纪70年代,科学界首次量化分析了塑料垃圾在太平洋的分布情况[5]。近年来,塑料污染已经成为人类社会最大的环境危机之一,对陆地和水生生态系统以及人类健康构成了严重威胁[6-7]。2018年,欧盟委员会正式发布了“基于循环经济理念的塑料战略”(A European strategy for plastics in a circular economy),为可持续性资源利用、塑料生产和废弃物处理制定了政策框架。在这个背景下,生产和使用非石油基或者可降解塑料制品替代石油基塑料成为了近期的研发热点[8]。此外,塑料循环经济政策框架也鼓励开发新型回收技术,使得现存的石油基塑料产品和废弃物能最大限度地控制在材料循环圈内,既可以避免它们被释放到环境中去,又可以减少原始塑料材料的生产,从而达到节省燃料、能源和减少CO2排放的目的[9-11]。近年来,在许多国家和地区的共同努力下,不同程度的限塑令使得全球塑料(原始材料)生产趋于平稳。2020年,全球塑料产量(原始材料,不包括合成纤维和再生塑料)达到3.67亿吨/年,与上一年基本持平[12]。与此同时,人类社会对塑料制品的需求却并未降低。特别是这两年来,由于新冠病毒大流行引起的全球生活和出行方式的改变,人们对一次性塑料包装和医疗材料的依赖呈现显著的上升趋势,进一步加重了塑料引起的环境危机[13-16]。
近年来,生物技术辅助的塑料降解和回收已成为一个蓬勃发展的研究领域[17-21]。其实,早在20世纪70年代,科学家们就开始研究塑料垃圾生物降解的可能性[22-23]。由于塑料高分子材料的物理(例如高结晶度结构和强疏水性表面)、化学(例如聚烯烃类的碳-碳主链缺乏容易裂解的官能团)特性和环境抗性,寻找和优化微生物来源的高效塑料解聚酶被认为是限制生物降解技术应用的瓶颈[24-25]。尽管近年来的研究取得了一定的成就,有确凿科学证据和工业化前景的生物催化或微生物塑料降解技术依然局限于几种有限的聚酯类塑料。聚对苯二甲酸乙二醇酯(PET)是应用范围最广泛的聚酯类材料,可以被加工成聚酯纤维应用在纺织业的各个领域,也可以被制作成不同类型的食品饮料包装材料。自2005年Müller等[26]从Thermobifidafusca中分离表征了一种高效的PET水解酶以来,发掘和改造新型PET水解酶已成为一个重要的研究领域[27-29](图1)。到目前为止,人们从许多真核和原核生物微生物中发现了至少几十种具有PET聚酯水解能力的酶。早期的报道集中在来源于嗜热性放线菌的角质酶和其他同源性水解酶,主要来源微生物包括Thermobifida属和其他近缘微生物的不同菌株[30-31]。真菌类PET水解酶主要来自Fusarium属和已经商业化的嗜热性Thermomycesinsolens(原种名Humicolainsolens)分泌的角质酶[32-33]。2016年,Yoshida等[34]报道了一种从日本大阪府堺市一家塑料瓶回收厂的沉淀物样本中分离出来的大阪伊德氏杆菌Ideonellasakaiensis,它能够在实验室低温(30 ℃)条件下利用PET作为主要碳源生长并同化PET降解产物。此后,改造和优化I.sakaiensis分泌的IsPETase水解酶成为了世界范围内的研究热点[35-37]。此外,宏基因组技术的应用也推动了许多新型PET水解酶的发现。Sulaiman等[38]在2012年报道了从植物枝叶堆肥中分离出来的PET水解酶LCC,由于其较高的热稳定性和高温活性[39-41],LCC近年来成为最受关注的PET水解酶之一。2020年,法国Carbios生物技术公司和图卢兹大学在《Nature》上合作发表了通过蛋白工程技术优化LCC酶的文章[42],通过基于结构的突变并结合前期其他同源角质酶改造的成功案例,Tournier等[42]获得了一个LCC-ICCG突变体,该突变体可以在高质量浓度底物(200 g/L)的先导工业水平下,72 ℃反应10 h,实现对预处理过的废弃PET瓶超过90%的解聚,被公认为是实现未来生物技术塑料回收应用的一个突破。Danso等[43]开发了一种搜索算法,从各种海洋和陆地来源的宏基因组数据库中发现了数百个PET水解酶候选基因,最新研究成果表明,在人类的唾液宏基因组中也有高效PET水解酶基因存在[44]。因此,世界各地开展的塑料生物降解的科研项目中(比如中欧政府间合作旗舰项目MIX-UP[45]),无一例外地包括了寻找和优化PET水解酶的科研内容。几乎可以肯定的是,我们目前还没有找到自然界中最有效的PET水解酶。为了实现这个目标,我们需要更有效的超高通量筛选方法去检索自然界的微生物资源和大规模突变体文库[29]。

TPA—对苯二甲酸根离子(terephthalate);MHET—单(2-羟基乙基)对苯二甲酸酯(mono(2-hydroxyethyl)terephthalate);BHET—双(2-羟基乙基)对苯二甲酸酯(bis(2-hydroxyethyl)terephthalate)
本文根据近年来的研究进展,简要回顾目前用于表征酶水解PET的分析方法,重点介绍几种可能用于高通量筛选的方法并讨论它们在不同应用场景下的可行性。关于PET水解酶发掘、改造的最新进展以及众多表征方法的详尽描述,读者可以参考几篇最新的综述[27-29,46-47],本文不做一一赘述。
1 PET纳米颗粒的制备和在酶筛选中的应用
酶水解PET是典型的界面催化反应(interfacial biocatalysis),固态表面可以接触酶水溶液的酯键,被水解后产生可溶性的小分子产物,所以也被称为“表面侵蚀”(surface erosion)反应[48]。因此,提高聚合物底物的比表面积是提高酶水解反应速度的一个有效策略[49-51],例如使用直径在纳米(100 nm以下)到亚微米范围(100~1 000 nm)的PET颗粒(本文统一称为PET纳米颗粒)作为底物[43,52-61]。目前市场上暂时没有商用的PET纳米颗粒,但它们可以通过简单的溶剂蒸发法来制备[55-56,60,62-63](图2(a))。可以溶解PET的溶剂只有六氟异丙醇(HFIP)、三氟乙酸(TFA)等少数有机溶剂。相较于后者,HFIP可以在常温下迅速溶解各种PET材料(例如商用无定形PET薄膜、高结晶度的PET颗粒和聚酯纤维以及废旧PET包装材料等),因此是制备纳米颗粒的首选溶剂。缺点是HFIP相对比较昂贵,所以如果能循环使用溶剂是一个比较经济的方案。如图2(a)所示,一般的制备方法是将10 g/L的PET六氟异丙醇溶液逐滴加入10倍体积的蒸馏水中,蒸馏水要持续保持剧烈的搅拌(比如使用均质器或磁力搅拌器等),PET溶液在水(作为反溶剂antisolvent)中的稀释导致了PET纳米颗粒的形成。较大的颗粒或者絮状沉淀物可以通过过滤去除,从而得到乳白色均匀的悬浊液。由于HFIP的沸点(58.2 ℃)低于水的沸点,所以可以用旋转蒸发器分离得到纯水PET纳米颗粒悬浊液。纳米颗粒的浓度可以通过干燥后称质量来确定,颗粒大小可以通过动态光散射(dynamic light scattering,DLS)或者扫描电镜(scanning electron microscopy,SEM)来确定[56]。一般情况下,按照这个方法制备的纳米颗粒的粒径均值在(100±50)nm[55-56,60],因此可以作为悬浊液在室温下储存很久,方便随时使用。根据Pfaff等[52]最新的报道,这种方法制备的纳米颗粒的分子量也远小于制备前PET原材料的分子量,因此可以更容易被酶水解。另一个制备PET纳米颗粒的类似方案采取三氟乙酸(TFA)作为溶剂[63]。这个方法相对比较复杂,需要在50 ℃下溶解PET,并且在制备其水相悬浊液时要加入低浓度的十二烷基硫酸钠(SDS)。由于这个方法会产生大量粒径在300 nm以上的颗粒,需要使用量筒进行沉淀分离。另外,由于SDS可能会影响酶活性和微生物生长,这种方案制备的纳米颗粒不可以作为悬浊液直接使用。
由于PET纳米颗粒的粒径均值小于可见光波长,丁达尔效应会使入射光透过纳米颗粒悬浊液从而产生明显的散射作用(图2(b))。因此,由水解反应引起的纳米颗粒粒径和浓度的变化可以通过跟踪浊度(600 nm处的光密度)的变化来测量[60,64]。由于许多PET水解酶需要较高浓度的缓冲液来维持其活性[52,65],PET纳米颗粒可能在高温降解反应中形成沉淀并造成比浊度测量的误差。通过使用琼脂糖[60]或者聚丙烯酰胺凝胶[52]来固定纳米颗粒以及反应体系可以解决这一问题,提高测量的可重复性。通过缩小反应体系的体积,酶水解凝胶固定化的PET纳米颗粒可以在96孔板中进行,从而提升表征的通量,用于酶的筛选和动力学分析[52]。类似的方法可以用来表征和筛选其他小分子底物(例如 BHET)水解的酶活性[66],以及酶解聚聚丁二酸己二酸丁二醇酯(PBSA)[67]、聚己内酯(PCL)[59]、商用聚酯型聚氨酯分散体(Impranil®DLN-SD,Covestro AG,Germany)[68]等聚合物的活性。在使用后几种底物时,由于酶水解反应较快,纳米颗粒悬浊液在反应过程中比较稳定,不需要额外加入凝胶固定就可以测得重复性较高的比浊度变化。这样相对简单的反应体系有利于对解聚机制的解析。
在实践中,基于微孔板的检测方法通量有限,很难适用于筛选非常大的文库。相比之下,琼脂平板测定法的通量要高得多。在琼脂平板的制备中加入4~5 g/L的聚酯纳米颗粒,就可以通过比浊法检测筛选具有较高聚酯水解活性的菌落。活性水解酶的分泌会导致菌落周围形成清晰的透明圈[43],采用此方法可以每周筛选数百万个克隆[29](图2(b))。由于PET纳米颗粒制备中采用的溶剂价格高昂,PCL和Impranil®DLN-SD分散体经常被用作其廉价易得的替代品[43,69-70]。需要注意的是,用这两种替代底物筛选出来的酶和菌株通常具有较强的脂肪类聚酯水解活性,但未必都有足够的PET水解活性,因此还需要在PET底物上进行进一步的活性验证。为了解决这个问题,Charnock[71]最近开发了一种用二甲基亚砜(DMSO)在180 ℃高温下溶解PET并迅速加入预热的低浓度顶层琼脂(top agar)的方法来制备琼脂平板,可在保证直接筛选PET水解活性的基础上有效地控制成本。基于聚酯纳米颗粒筛选水解酶和活性菌株的方法也有其局限性,原因在于高效PET水解酶大部分为最适反应温度在50 ℃以上的耐高温酶,并且PET的物理性质决定其在常温条件下的可降解性有限[29,72-73],如何在酶水解反应的最佳温度和底盘微生物的最佳生长温度(一般为常温到不超过40 ℃)之间进行权衡是目前限制这个方法应用的瓶颈。
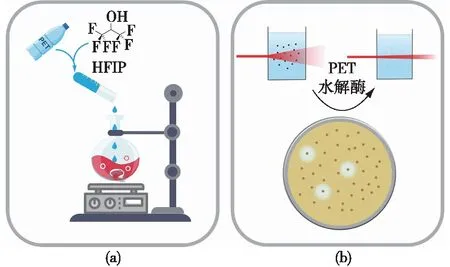
图2 PET纳米颗粒的制备(a)以及其在比浊法表征或筛选PET水解酶(b)中的应用示意
2 紫外/可见光分光光度法在表征和筛选PET水解酶中的应用
PET水解产生的降解产物包括TPA、MHET(酸根离子)、BHET和一些水溶性更低的短酯寡聚物[25,50,74]。虽然全面监测PET水解产物的构成和浓度有助于解析PET解聚机制,但由于其解聚产物成分复杂且溶解度不同,常见的检测手段仅针对几种可溶于水的小分子。因为所有3种化合物含有相同数量的羰基[46,50],并具有相同的消光系数,因此在波长240~244 nm附近有一个相同的强吸收峰[75]。高效液相色谱法(HPLC)检测PET水解产物一般也在这个紫外波长范围内进行,并已经逐渐成为定量分析PET酶降解效率最常用的检测方法[46,50]。根据朗伯-比尔定律,测量在该波长范围内的吸光值可用于计算这些小分子PET水解产物的总和,从而换算成产生TPA的总当量来表征水解酶活性[30,37,42,57,76]。在最早对T.fusca角质酶表征的研究中,在波长242 nm处的紫外分光光度法已经被用来鉴定该酶在降解含TPA单元的脂肪类和芳香类共聚多酯方面的活性[77]。采用不受紫外线影响的96孔板,这个方法可以用来快速检测和筛选大量样品中的酶促PET水解产物,达到较高的筛选通量[74]。这种方法的主要优点是不需要对可溶性水解产物样品进行处理(如衍生化),只需要将它们从PET底物和其他非水溶性降解产物中分离出来,减少这些杂质对紫外吸光度产生的影响。但是如果产物中存在其他可溶性紫外吸收化合物时,例如二甲基亚砜(DMSO)或者大量蛋白质(酶)[75,78],这种方法的准确性会大打折扣。最近,Zhong-Johnson等[75]采用在波长260 nm处测量的方法有助于减少其他非特异性产物对测量结果的影响。基于这个思路,建议在以后的应用中扫描完整的反应混合物吸光光谱(220~300 nm),而不是记录单一波长的吸光强度[50]。
作为水解产物的MHET和TPA都有自由的羧基(图1),因此在低浓度缓冲溶液中进行PET酶解时,反应体系的pH会持续下降[50]。这个现象也是酸碱滴定法来表征PET水解的理论基础[32]。类似地,如果在进行降解实验时加入酸碱指示剂(比如酚红(phenol red)或溴麝香草酚蓝(bromothymol blue)),在远高于这些产物pKa值的低浓度缓冲溶液中,由PET水解引起的pH变化可通过紫外/可见光吸收光谱的数值变化来量化表征[79]。分光光度计比色皿中的颜色变化可用于监测反应的进行程度[80],也可以用来比较不同PET水解酶降解小分子模式底物的活性差异[79]。在固定化PET或者其他聚酯纳米颗粒的琼脂中添加酸碱指示剂可以快速固相筛选表达水解酶的微生物[81]。酸性反应产物的扩散降低了菌落周围的pH,改变了染料的颜色,从而将彩色光环的半径和酶的表达水平和活性统一起来,有助于提升普通透明圈检测的灵敏度。
3 荧光分光光度法在表征和筛选PET水解酶中的应用
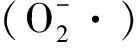
除了TPA之外,Gimeno-Pérez等[86]首次开发了基于乙二醇(EG)的PET水解产物荧光检测法(图3(b))。该方法采用酮还原酶(KRED)在烟酰胺腺嘌呤二核苷酸磷酸(NADP+)辅酶Ⅱ辅助下将EG、MHET或BHET氧化成相应的醛,然后,来自Clostridiumkluyveri克鲁氏梭菌的黄递酶(diaphorase)将NADPH重新氧化成NADP+,同时催化刃天青(resazurin)还原成在可见光范围内(550 nm)被激发可产生强荧光(580 nm)的试卤灵(resorufin)。通过对不同商业化KRED的比较,筛选出了最有效的酮还原酶完成这个耦合反应,定量检测聚酯水解酶降解PET的产物。虽然这个荧光法测量出的降解产物与传统HPLC法测出的量有较好的契合性,但是几个显著的缺陷限制了这个方法的进一步应用。由于在低浓度范围内该方法对MHET和BHET检测的灵敏度过高而且线性相关性较差,此方法很难用于准确定量分析PET水解产物。另外,复杂的反应步骤和相对较长的总体最佳反应时间(超过1 h)使得这个方法相比基于TPA的荧光检测法毫无优势。另外,由于KRED针对EG的特异性较低,在MHET和BHET大量存在的条件下,该方法对特异性检测EG有很大局限性。不过采用特异性氧化EG的酶[87]可能对进一步优化该方法有很大帮助。
2022年,Qiao等[88]研究了一种基于荧光检测的微流控液滴分选方法,用于分离分泌PET水解酶的微生物(图3(c))。这个方法首先将单个细胞包裹在液滴中,并培养数天以表达足够量的PET水解酶,然后将荧光素二苯甲酸酯(fluorescein dibenzoate)作为底物注入液滴,可表达活性水解酯酶的细胞能将模式底物转化成荧光素(fluorescein),从而实现荧光液滴分选。尽管作者认为,这个基于苯甲酰酯的底物与PET有一定结构相似性,使其只能被PET水解酶水解而无法被典型脂肪酶水解。事实上,荧光素二苯甲酸酯很早就被合成并应用为一种典型的脂肪酶底物[89]。鉴于大部分典型脂肪酶都没有水解PET聚酯的活性,这个底物对于特异性鉴定PET水解酶的贡献可能非常有限。甚至在高通量的筛选中,使用这个底物会更倾向于分离出只有典型脂肪酶活性的“假阳性”菌株。

图3 荧光分光光度法在检测和筛选PET水解酶中的应用(水溶性降解产物对苯二甲酸根离子(a)或者乙二醇(b)可以被转化成荧光信号,PET水解酶可以水解荧光素的衍生物实现高通量活性筛选(c))
4 通过生物传感器建立超高通量的酶筛选平台
最新研究结果表明,建立针对PET水解产物TPA的生物传感器可能成为一种实现超高通量筛选的方式[29]。通过生物工程技术改造的生物传感器系统已被广泛用于检测小分子,包括转录因子(transcription factors,TFs)、核糖体开关或酶偶联传感器装置[90-92]。近两年来,针对TPA的特异性生物传感器的研究成果不断出现[93-95]。
Pardo等[93]为了评估TPA在基因改造后的AcinetobacterbaylyiADP1菌株中的转运,特别设计了一个由转录因子TphR和一个荧光报告系统组成的生物传感器,如图4(a)所示,这个生物传感器包括来自Comamonastestosteroni的转录因子 TphR及其相关的核苷酸调节序列和超级折叠(superfolder)绿色荧光蛋白(sfGFP)。在Comamonastestosteroni中,TphR在与TPA结合后可以诱导菌株转录一个与TPA代谢相关的基因簇,从而可以将TPA转化为原儿茶酸酯(protocatechuate)[96]。基于这个生物传感器系统,通过流式细胞荧光分选技术(fluorescence activated cell sorting,FACS)筛选出了可以高效摄取环境中TPA的Acinetobacterbaylyi突变菌株。Pardo等[93]还提出这个基于TphR的生物传感器可以应用于筛选产生TPA作为降解产物的酶,如PET水解酶。迄今为止,对PET酶和MHET酶的筛选方法大多使用模式底物来代替PET,而直接应用聚酯底物或者针对其降解产物的评估都仅限于低通量和耗时的分选方法。因此,Pardo等[93]认为这个生物传感器可以结合优化TPA摄入的ADP1突变体,从而建立一个针对大型突变体或者宏基因组文库中PET酶和MHET酶基因的快捷高通量筛选方案。
第2个针对TPA的生物传感器的研究成果由Li等[94]在2022年发表。他们通过对一个有混杂结合能力的转录因子——来自Pseudomonasputida的XylS的定向进化,构建分别可以特异性结合邻苯二甲酸酯(PA)和TPA的突变体。通过激活一个荧光报告蛋白(stGFP)的下游表达,构建的大肠杆菌全细胞生物传感器能够对低至10 μmol/L的PA或TPA进行荧光检测(图4(b))。为了验证这个生物传感器的功效,他们将它应用于对一个邻苯二甲酸酯酶GoEst15突变体文库的筛选中,最终发现了相对于野生型提升了2倍以上特异性活性的突变体。基于这个结果,他们进一步推断基于XylS的全细胞生物传感器应用于PET水解酶筛选的可能性,尽管文章中并没有直接提供类似生物传感器对于PET水解酶筛选的验证和数据。
目前唯一一个直接检测TPA作为酶水解PET产物的生物传感器由Bayer等[95]在2022年发表。这个生物传感器结合了来自海洋分枝杆菌Mycobacteriummarinum的羧酸还原酶(carboxylic acid reductase,CAR)和荧光素酶(luciferase,LuxAB),提供快速表征PET水解酶和检测降解产物TPA的工具(图4(c))。来自Photorhabdusluminescens的荧光素酶LuxAB被引入大肠杆菌后可以利用该重组菌株检测结构多样的醛类[92]。在本项工作中,CAR在大肠杆菌中把TPA转化为相应的醛类结合LuxAB发光,不仅可以半定量地检测水解样品中的TPA,而且适合作为评估PET水解酶活性的高通量筛选方法。此外,CAR催化的对苯二甲醛合成可以结合还原性级联胺化反应实现二胺的单锅法合成,从而为TPA作为PET生物降解产物的升值转化提供一种新的策略。
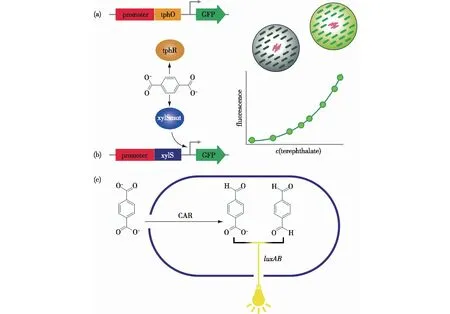
图4 不同构造的生物传感器可以通过检测TPA来筛选PET水解酶
生物传感器的建立对于高通量筛选大型基因文库中可产生TPA的酶(例如PET酶和MHET酶)具有重要价值。以上3种方案都没有直接以实际筛选真实文库作为验证,所以它们在未来的实际应用中都需要针对不同的实验目的进一步优化。对于不同的应用场景,类似的生物传感器要具有不同的敏感度。比如,筛选环境宏基因组需要高敏感度的生物传感器,而用于筛选建立已知PET水解酶的定向进化文库,使用低敏感度的生物传感器可能会更快找到高活性的酶突变体。
Yoshida等[34]发现的I.sakaiensis是可以利用PET为碳源生长的菌株。它的存在表明,应该有开发基于生长选择模式的超高通量筛选PET酶的可能性。Pardo等[93]改造的ADP1菌株中通过引入Comamonassp.E6中的tph操纵子,使得ADP1菌株能够利用TPA为唯一碳源生长。这表明,其他模式生物应该可以通过类似的改造获得利用TPA为唯一碳源生长的能力。例如,Clarkson等[97]通过对大肠杆菌的改造,使得菌株获得了代谢原儿茶酸酯的能力,而后者是tph操纵子代谢TPA的产物。由于目前发现的高效PET水解酶都是来自于嗜热性菌株或者高温环境,而以生物传感器为基础的筛选方案一般都要使用温和条件下生长的底盘细胞,因此如何针对高温酶检测将成为未来生物传感器筛选方案研发的挑战。
5 结论和展望
从2005年Müller等报道第一个PET水解酶到2016年Yoshida等在《Science》上报道了可以利用PET作为主要碳源的新型微生物大阪伊德氏杆菌,这11年间,酶水解PET聚酯一直是一个相对小众的研究领域。在此之后,由于全球社会日益关注塑料废弃物处理和污染物造成的环境危机,人们对微生物在塑料废弃物降解回收方面的潜力和对解析相关酶解聚机制的兴趣与日俱增。因此,发掘新型天然PET水解酶、用定向进化或理性设计等蛋白质工程的手段优化已知水解酶的解聚活性成为近年来的研究热点。相比于人们对新型塑料水解酶的热忱,在建立高效、快捷表征和筛选PET水解酶的方法学研究领域进展乏善可陈。为了达到工业化应用水平,PET的酶促降解和回收需要高活性、稳定性和对产物抑制效应不敏感的酶,从而缩短降解时间并节约反应成本。
目前报道的PET水解酶高通量筛选方案多是基于模式底物的形变(例如比浊法检测纳米颗粒降解)或者水解产物的生成(例如紫外/荧光分光光度法),它们的可行性大部分只是在小规模筛选和特殊应用场景下被验证,并未被用于实际的高通量筛选。如果可以将目前这些方法的优势进行重新整合,有望在短期内建立可以有效实施的筛选方法。例如,优化基于PET纳米颗粒的琼脂平板检测结合酸碱指示剂的使用,可以实现短时间内筛选数以百万计克隆的目标,从而有助于从环境宏基因组中发现新的PET水解酶骨架。另外,通过改良基于TPA检测的生物传感器,使大肠杆菌或其他模式生物的工程菌株细胞可以获得以TPA为唯一碳源生长的能力,有助于建立基于生长选择的超高通量检测方法,这些将大大推动高效PET水解酶领域的研发进展。

