术中超声辅助显微切除术治疗脑胶质瘤的临床效果分析
韦继明,仇洪,张传东,冯磊,李伦走
脑胶质瘤属于神经系统常见的原发性肿瘤,缘于神经胶质细胞病变,具有复发率高、致死率高和致残率高的特点[1]。据统计,中国脑胶质瘤年发病率在5~8/10 万,占所有颅内原发性肿瘤的50%左右,其5 年病死率在全身肿瘤中位居第3 位[2]。脑胶质瘤恶性程度高,病灶呈侵袭性、浸润性增长,通常会压迫局部脑组织,导致颅内压升高,进而影响中枢神经功能,严重威胁患者的生命安全[3]。脑胶质瘤由于病灶位置特殊,且具有浸润性,肉眼很难精确判断肿瘤边界,手术难度相对较大[4]。术中超声是外科临床常用的实时影像工具,能够更为精确地检测到肉眼分辨不清的残余肿瘤,从而有助于提升脑胶质瘤的切除效果[5]。本研究分析2015 年1 月至2018 年1 月河池市人民医院收治的113 例脑胶质瘤患者的临床资料,探讨术中超声辅助显微镜下肿瘤切除术治疗脑胶质瘤的临床疗效,以期为脑胶质瘤的治疗提供依据。
1 对象与方法
1.1 研究对象 选取2015 年1 月至2018 年1 月河池市人民医院收治的113 例脑胶质瘤患者作为研究对象,其中男63 例,女50 例;年龄34~66 岁[(51.09±9.88)岁];肿瘤直径1~6 cm[(3.20±0.73)cm];病理分级:Ⅱ级73 例,Ⅲ级26 例,Ⅳ级14 例。根据患者术中是否接受超声辅助手术分为常规组(55 例)和超声组(58 例),2 组患者的性别、年龄、肿瘤直径等资料比较,差异无统计学意义(P>0.05)。
1.2 纳入及排除标准 纳入标准:(1)符合脑胶质瘤诊疗规范[6];(2)存在明确的手术指征,接受显微切除术治疗;(3)预计生存时间超过3 个月;(4)依从性良好,随访资料完整。排除标准:(1)脑外伤或颅脑手术患者;(2)心肝肾肺等功能不全者;(3)精神疾病、认知障碍或其他神经疾病患者;(4)感染性疾病、血液疾病、免疫功能异常及其他恶性肿瘤患者;(5)手术禁忌证者;(6)中途失访或资料不全者。
1.3 手术方法 超声组使用超声辅助手术,手术前对超声探头进行消毒,并准备大量生理盐水作为耦合剂。首先,在开颅去除骨瓣后进行初始扫描,获得病变位置、深度、大小、解剖结构以及肿瘤边缘回声等信息;其次,在硬脑膜切开后再次进行定位探查,识别重要血管结构,依据超声图像调整手术入路方式,减少血管损伤;最后,在显微镜下实施显微肿瘤切除术,肿瘤边缘区域可在超声辅助下切除,保护脑部功能区域,术中反复利用超声探查肿瘤切除程度,在保护功能区域前提下尽量切除肿瘤病灶,当残留病灶与功能区域接近时,手术医师根据临床经验和手术情况决定继续切除或停止手术。待彻底止血后,缝合硬脑膜及头皮各层。
常规组由同一组手术医师团队进行手术,术中不使用超声辅助,仅依据术腔MRI 检查定位肿瘤,在显微镜下实施肿瘤切除术,尽量彻底切除全部肿瘤病灶,同时避免正常脑组织及神经损伤,在显微镜下未发现肿瘤残留时停止手术。待彻底止血后,缝合硬脑膜及头皮各层。
1.4 术后处置 所有患者术后均严密监测血压、血氧饱和度、心率以及瞳孔变化等生命指征,给予抗感染、止血等常规治疗。术后72 h 行头颅MRI检查,依据容积法判断肿瘤切除程度,即肿瘤全切:100% 切除,次全切:切除程度90%~99%,部分切除:切除程度50%~89%。术后5 d 行头颅CT 检查,依据水肿带与肿瘤切缘的距离(D)判断脑水肿程度,分别为Ⅰ级(D≤2 cm)、Ⅱ级(D>2 cm 但小于大脑半径一半)、Ⅲ级(D超过大脑半径一半)。叮嘱患者定期复查,实施康复训练,记录并保存复查结果。
1.5 观察指标(1)基础资料。统计患者性别、年龄、肿瘤直径、肿瘤部位、病理分级等基础资料。(2)手术资料。对比2 组患者手术耗时、术中出血量、肿瘤暴露用时(打开脑膜至暴露肿瘤边界所用时间)、肿瘤切除程度、脑水肿程度等资料。(3)术后恢复情况。术后6 个月,以卡氏功能状态(Karnofsky performance status,KPS)评分标准判定恢复情况,该标准将患者生活体力状况分为10 个等级,0 级(0 分)为死亡,10 级(100 分)为正常、无症状体征,每增加1 级,评分增加10 分,满分100 分,分值越高提示患者恢复越好;(4)术后日常生活活动能力。采用改良的Barthel 指数评分评价日常生活活动能力,包括修饰、洗澡、进食、用厕、穿衣、大便控制、小便控制、上下楼梯、床椅转移、平地行走等10 个项目,每个项目分5 级,所有项目得分相加为最终评分,满分100 分,分值越高提示日常生活活动能力越好。(5)复发情况和3 年生存率。所有患者术后每6 个月随访1 次,共随访3 年,统计患者3 年内肿瘤复发情况及3 年生存率。
1.6 统计学处理 采用SPSS 19.0 统计软件分析所得数据,计量资料以±s表示,采用独立样本t检验;计数资料以百分比(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 超声组和常规组患者基础资料比较 2 组患者性别、年龄、肿瘤直径、肿瘤部位以及病理分级比较差异无统计学意义(P>0.05)。见表1。
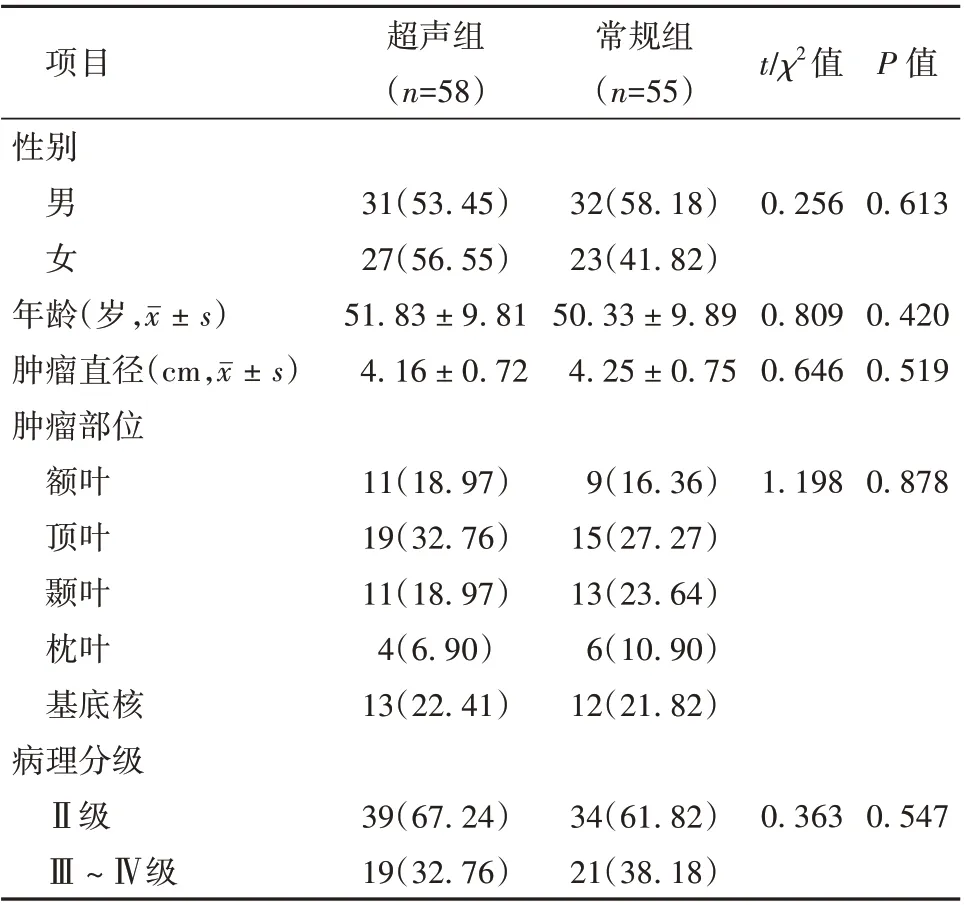
表1 超声组和常规组患者基础资料比较[例(%)]
2.2 超声组和常规组患者手术资料比较 2 组患者手术耗时、术中出血量比较,差异无统计学意义(P>0.05);与常规组比较,超声组患者肿瘤暴露用时明显缩短,差异有统计学意义(P<0.05)。见表2。
表2 超声组和常规组患者手术资料比较(± s)
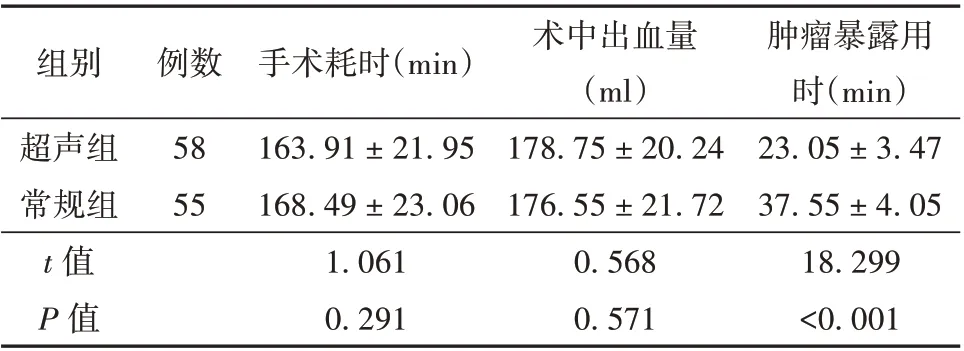
表2 超声组和常规组患者手术资料比较(± s)
组别超声组常规组t 值P 值例数58 55手术耗时(min)163.91±21.95 168.49±23.06 1.061 0.291术中出血量(ml)178.75±20.24 176.55±21.72 0.568 0.571肿瘤暴露用时(min)23.05±3.47 37.55±4.05 18.299<0.001
2.3 超声组和常规组患者肿瘤切除程度及脑水肿程度比较 超声组患者肿瘤切除程度明显高于常规组,术后脑水肿程度则低于常规组(P<0.05)。见表3。
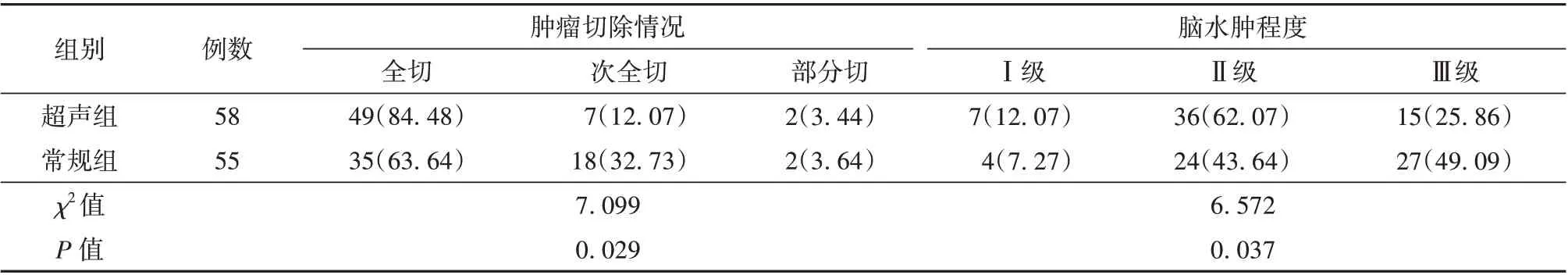
表3 超声组和常规组患者肿瘤切除程度及脑水肿程度比较[例(%)]
2.4 超声组和常规组患者治疗前后KPS 评分及改良Barthel 指数评分比较 与术前比较,2 组患者术后6 个月的KPS 评分及改良的Barthel 指数评分均明显升高(P<0.05),且超声组患者术后KPS 评分及改良的Barthel 指数评分均高于常规组(P<0.05)。见表4。2.5 超声组和常规组患者远期疗效比较 超声组患者术后3 年内复发率明显低于常规组,生存率则显著高于常规组(P<0.05)。见表5 和图1。
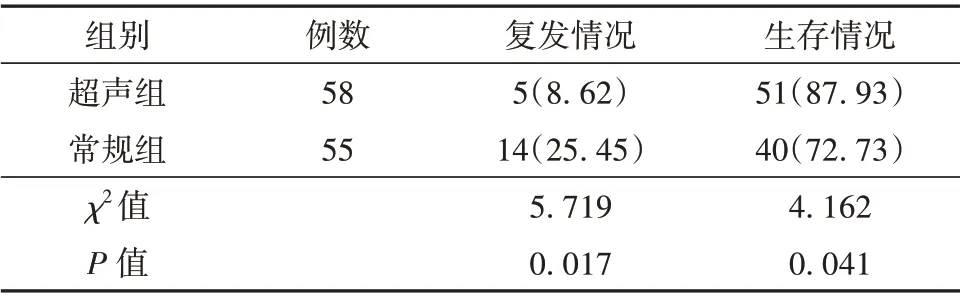
表5 超声组和常规组患者远期疗效比较[例(%)]

图1 生存曲线图
表4 超声组和常规组患者治疗前后KPS 评分及改良的Barthel 指数评分比较(分,± s)
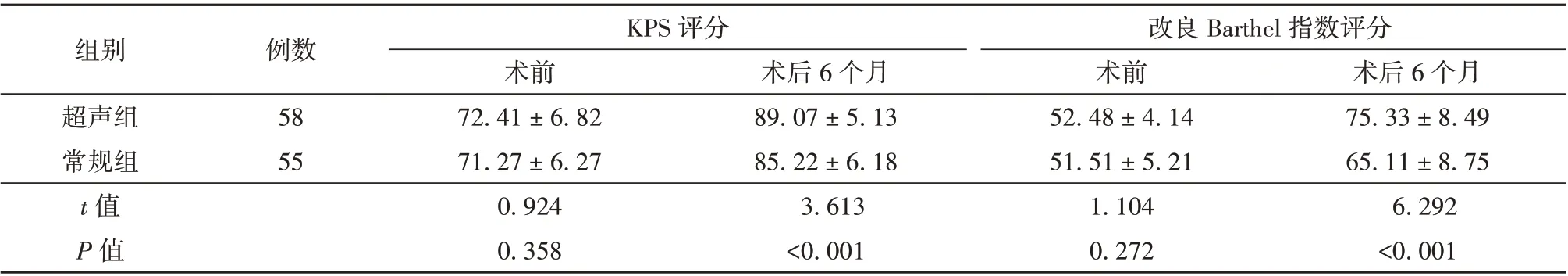
表4 超声组和常规组患者治疗前后KPS 评分及改良的Barthel 指数评分比较(分,± s)
注:KPS 为卡氏功能状态,改良Barthel 指数为对患者日常生活活动的功能状态进行测量
组别超声组常规组t 值P 值例数58 55 KPS 评分术后6 个月75.33±8.49 65.11±8.75 6.292<0.001术前72.41±6.82 71.27±6.27 0.924 0.358术后6 个月89.07±5.13 85.22±6.18 3.613<0.001改良Barthel 指数评分术前52.48±4.14 51.51±5.21 1.104 0.272
3 讨论
脑胶质瘤是由颅内胶质细胞病变导致的原发性肿瘤,其发病原因复杂,受遗传和环境等因素共同影响所致[7]。脑胶质瘤的恶性程度高,病灶在颅内浸润性增生,压迫脑神经,从而表现出头痛、恶心、神经功能障碍及癫痫等症状,严重影响患者的生活质量和健康安全[8]。
手术切除是治疗脑胶质瘤的主要措施。随着显微技术的发展,显微切除术被广泛应用于脑胶质瘤的临床治疗,受到广大医患的高度认可[9]。脑胶质瘤呈浸润性进展时,其肿瘤病灶与正常脑组织边界辨识不清晰,显微镜下观察脑胶质瘤可见其色泽暗,与周围正常脑组织外观存在一定的差异。然而,在手术切除大部分瘤体后,残留的肿瘤失去本身组织学结构,仅凭肉眼无法识别残留瘤体与周围正常脑组织的界限。术中超声是一种广泛应用的影像学方法,能为术者提供实时监控,准确定位肿瘤区域和明确肿瘤边界,协助评估肿瘤切除范围[10]。本研究显示,超声组患者手术耗时和出血量与常规组无明显差异,但超声组患者肿瘤暴露用时较常规组明显缩短,说明术中超声不会因手术时间延长而增加手术风险,且术中超声辅助能够准确定位,协助术者识别正常脑组织与肿瘤的边界。本研究中,超声组患者肿瘤切除程度明显高于常规组,超声组患者术后3 年内复发率明显低于常规组,生存率则显著高于常规组,提示术中超声能够帮助术者辨识脑胶质瘤与正常脑组织,提高肿瘤切除效率,减少肿瘤残留,从而降低复发率和提高患者生存率。术中超声能够通过实时成像,对瘤腔边缘、残余肿瘤及周围脑脊膜等进行鉴别,精确跟踪肿瘤切除进程,评估残余肿瘤程度,为判定继续切除或结束手术提供指导。
脑胶质瘤呈恶性浸润性生长,可侵袭邻近脑组织,造成脑神经损伤,继而出现颅内压升高、认知障碍以及癫痫发作等神经症状[11]。因此,脑胶质瘤的治疗需在最大限度地安全切除肿瘤病灶基础上,尽量保护正常脑组织和血管,避免术后出现神经功能障碍,促进神经功能恢复和改善患者生活质量[12]。本研究结果显示,超声组患者术后5 d 脑水肿程度低于常规组,且超声组患者术后6 个月KPS 评分和改良Barthel 指数评分显著高于常规组,提示术中超声辅助显微切除术能够减轻神经损伤,促进术后神经功能恢复,对改善患者与后续治疗具有重要意义。原因在于,术中超声有助于辨识残余肿瘤,在切除过程中最大限度地保护正常脑组织;另外,术中超声能够监视颅内血流变化,帮助术者判断血管与肿瘤的结构关系,从而有助于保护神经功能。
综上所述,术中超声辅助显微切除术能够提高脑胶质瘤切除率,保护患者神经功能,改善患者术后生活质量,提高患者生存预后状况,具有良好的临床应用价值。然而,本研究样本量有限,研究结果的准确性需进一步扩大样本量进行探讨。

