瞬时纳米沉淀法制备pH变色微胶囊及其性能
唐月婷,孟 凯,2,张克勤,2,赵荟菁,2
[1.苏州大学纺织与服装工程学院,江苏苏州 215123;2.现代丝绸国家工程实验室(苏州),江苏苏州 215123]
花青素(anthocyanins)是一种天然水溶性色素,存在于许多植物的果实和有色花瓣中,属于黄酮类多酚化合物,同时也是植物花瓣上主要的呈色物质。除了具有抗氧化、抗衰老等活性外[1],花青素还可以在不同pH 的溶液中呈现不同的颜色[2],在酸性条件下,水溶液呈红色,溶液的主要成分为黄烊盐离子;随着pH 的增加,在中性条件下,花色苷在溶液中以无色的甲醇假碱存在;在碱性条件下,花色苷主要表现为蓝色的醌式碱,溶液颜色变深。相比其他酸碱指示剂,花青素具有天然无毒、变色范围广的优点,特别适合用于与人体相接触的变色材料。王芳[3]和Roy等[4]将花青素与食品包装材料结合制备智能指示膜,利用花青素的颜色变化指示食品新鲜度,但其显色和稳定性需要进一步提高,特别是热稳定性。
因为花青素活性很高,在加工、使用过程中,许多外界因素(如光、热、氧气等)都会影响花青素的稳定性,从而限制了它的应用范围[5-8]。为提高花青素的稳定性,有些学者用合适的材料包埋花青素制成微胶囊[9-12],将花青素与外界环境隔离,能更有效地提高花青素的稳定性。如陈程莉[9]以黑枸杞花青素为芯材,以糯米淀粉、改性糯米淀粉等5 种材料为壁材,采用喷雾干燥法制得微胶囊,考察了壁材对微胶囊稳定性和缓释性能的影响,并将其应用于食品工业;单冠程等[12]用海藻酸钠作壁材、黑米花青素为芯材,经离子凝胶化,采用微胶囊包埋机通过双喷头包埋法制备黑米花青素微胶囊,并将其应用于食品科技领域;李星宇[2]用海藻酸钠、壳聚糖包埋花青素制备微胶囊,可以提高花青素的稳定性,从而延长易氧化食品的保质期。
微胶囊技术是提高生物活性化合物在温度、光和氧气等环境中稳定性的有效手段。微胶囊具有核壳结构,通常包括壁材和芯材两部分[13-14]。微胶囊技术能隔离芯材与外部环境,有效地降低与外界环境因素的反应,使芯材在稳定的环境中存在,避免外界环境变化引起芯材损耗和反应等诸多问题[15]。瞬时纳米沉淀(FNP)法[16-17]是一种根据动力学控制原理,利用化学工程中的流体湍流混合制备微/纳米材料的新型技术,可在极短的时间内制备含有机活性物质的聚合物纳米粒子。FNP 法的技术特点是通过溶剂与非溶剂的快速混合,使溶解状态的聚合物溶解度下降,从溶液中析出,并将芯材包覆形成微胶囊[18]。这种方法不仅具有粒径易于调控、尺寸分布窄、制备时间短(毫秒级)、易于放大与连续化等特点,还可以系统地调控纳米微观结构,如形貌、内部结构、表面结构等,为微/纳米材料在纺织材料上的高效、低毒利用提供帮助[19]。
聚己内酯(PCL)是一种生物可降解聚合物,对小分子有较高的渗透性,具有良好的生物相容性和无毒性,特别适用于制药领域纳米颗粒的生产和生物应用[20]。因此,本研究以PCL 为壁材,将其溶于四氢呋喃(THF)中,以紫甘蓝花青素(RCA)为芯材,将其溶于水中,采用FNP 法在密闭撞击射流混合器(confined impingingjet mixers,CIJM)中制备微胶囊,将RCA 包埋在聚合物基质中,减少与外界环境的接触,以提高RCA 作为pH 变色指示剂的稳定性。
1 实验
1.1 材料和仪器
试剂:聚己内酯[PCL,Mn=60 000~65 000 Da,阿拉丁试剂(上海)有限公司],四氢呋喃(THF,纯度大于等于99.5%,江苏强盛功能化学股份有限公司),紫甘蓝花青素(RCA,纯度大于等于25%,西安雅图生物科技有限公司),盐酸、磷酸二氢钾、氯化钾(色谱纯,国药集团化学试剂苏州有限公司),邻苯二甲酸氢钾(分析纯,天津市致远化学试剂有限公司),氢氧化钠(分析纯,天津市大茂化学试剂厂),硼酸(99.8%,商丘市亮峰卫生用品有限公司),去离子水。
仪器:LSP01-1B 型LSP 实验室注射泵(保定迪创电子科技有限公司),HJ-4A 型多头磁力搅拌器(江苏科析仪器有限公司),AR224CN 型电子天平[奥豪斯仪器(常州)有限公司],密闭撞击射流混合器(自制),PS-20A 型超声波清洗器(深圳市臻洁康科技实业有限公司),H3-18KR 型台式高速冷冻离心机(湖南可成仪器设备有限公司),LGJ-10 型真空冷冻干燥机(宁波新艺超声设备有限公司),PH818 型笔式pH检测计(希玛科技有限公司),S-4800 型扫描电子显微镜(日本Hitachi公司),Nicolet 5700 iS5型傅里叶变换红外光谱仪(美国热电公司),Nano ZS90 型纳米粒径/电位分析仪(马尔文仪器有限公司),Specord S600型紫外-可见分光光度计(德国耶拿分析仪器股份公司),SDT2960 型热重/差热联用仪、DSC250 差示扫描量热仪(美国TA 公司)。
1.2 制备方法
RCA溶液的配制:分别称取0.25、0.50、0.75 g RCA加入到50 mL 去离子水中,搅拌至完全溶解,制得质量浓度分别为5、10、15 mg/mL 的RCA 溶液。
PCL 溶液的配制:分别称取0.25、0.50、0.75 g PCL加入到50 mL THF 中,搅拌至完全溶解,制得质量浓度分别为5、10、15 mg/mL 的PCL 溶液。
FNP 法制备微胶囊的过程如图1 所示。使用两台注射泵分别将RCA 溶液和PCL 溶液以相同的流速注入CIJM 的两个入口(内径=1 mm),在注射泵的推动作用下,两股流体以一定的流速在混合器中发生碰撞混合,溶有PCL 的有机溶剂在毫秒级的时间内和水在CIJM 中快速混合,在极短的时间内产生足够高的过饱和度,产生固液相分离,使PCL 形成疏水的纳米核心,新形成的成核种子捕获溶解的分子(RCA)并生长形成微胶囊[21]。碰撞混合后的溶液从混合器的出口(内径=2 mm)流到装有去离子水的烧杯中,形成微胶囊悬浮液,轻轻搅拌2 min以避免颗粒聚集。
将微胶囊悬浮液用孔径为0.1 μm 的滤膜过滤,并加去离子水清洗,重复3 次,然后在-50 ℃下冷冻过夜,在温度低于-50 ℃和真空度低于20 Pa 的条件下冷冻干燥48 h(确保完全去除水分),得到微胶囊粉末。制备样品及工艺参数如表1所示。
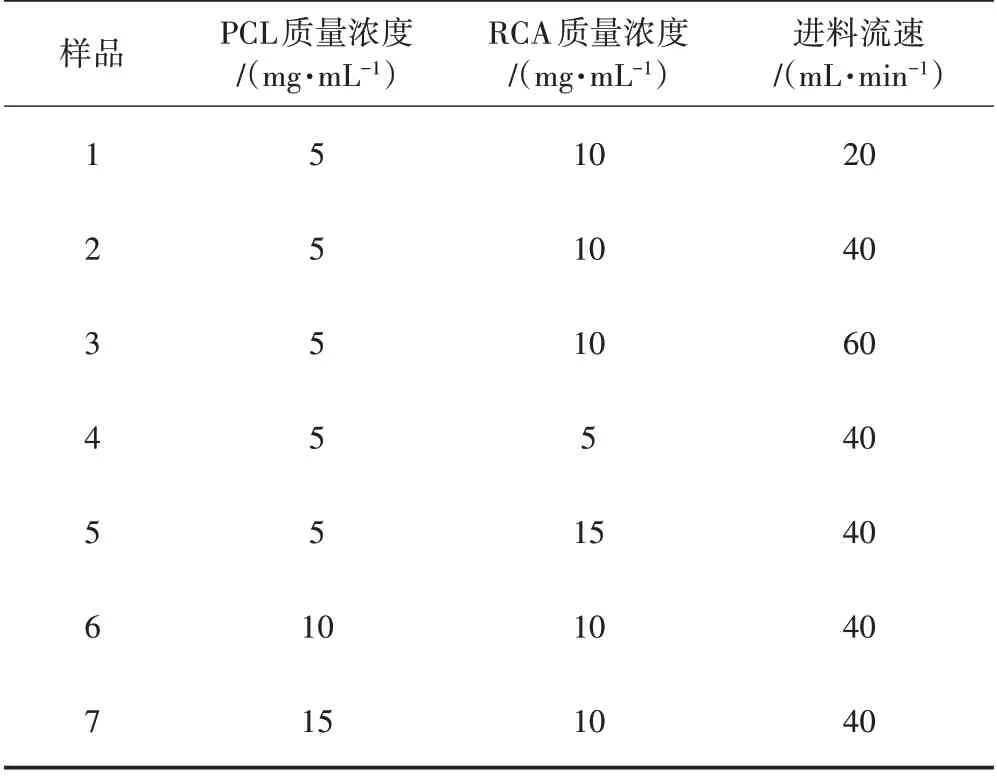
表1 样品及工艺参数
1.3 测试
1.3.1 微观形貌与结构
微观形貌:采用扫描电镜(SEM)和透射电镜(TEM)观察PCL/RCA 微胶囊的形貌。
扫描电镜:将微胶囊溶液过滤清洗后超声处理5 min,滴在载玻片上,在室温下干燥,喷金90 s 后,在5 kV 能量下采用扫描电子显微镜观察微胶囊的微观结构形貌。
透射电镜:将微胶囊溶液过滤清洗后超声处理5 min,转移到300 目碳支持膜铜网上,红外干燥后,在120 kV 能量下对微胶囊进行透射电镜观察。
1.3.2 傅里叶变换红外光谱(FTIR)
为分析微胶囊中的成分,用傅里叶变换红外光谱仪对纯RCA、纯PCL 和PCL/RCA 微胶囊粉末分别进行测试。以溴化钾压片法制备试样,扫描范围为400~3 500 cm-1,分辨率为0.5 cm-1。
1.3.3 包封率及加载率
标准曲线绘制:配制不同质量浓度的RCA 溶液进行紫外全谱扫描,已知花青素的两个最大吸收波长,一个位于465~550 nm 的可见光范围内,另一个位于270~280 nm 的紫外光范围内[22],设置扫描波长在400~600 nm,找到其可见光范围内的最大吸收波长,并在最大吸收波长下测定不同质量浓度RCA 溶液的吸光度,绘制吸光度对质量浓度的标准曲线,计算线性相关系数。
测量微胶囊悬浮液超速离心后上清液中的游离RCA质量浓度,间接估算微胶囊的包封率(encapsulation efficiency,EE)。通常认为包封率越高越好,包封率越高证明壁材能更多更好地包埋住花青素,阻隔了外界环境因素对花青素的影响[9]。将微胶囊溶液在室温下离心,以9 000 r/min 离心1 h,用紫外-可见分光光度计在最大吸收波长处测定上清液中RCA 的质量浓度,计算出包封率。
微胶囊的包封率与加载率(loading capacity,LC)计算公式如下所示:
1.3.4 粒径及其分布
微胶囊粒径一般难以用肉眼观察。用马尔文粒度仪测定PCL/RCA 微胶囊原液的平均粒径及粒径分布,重复测量3次取平均值。
1.3.5 pH 变色响应性实验
1.3.5.1 配制pH 缓冲溶液
根据GB/T 4015—2008《化学试剂 酸碱指示剂pH 变色域测定通用方法》配制得到pH 为3~10 的缓冲溶液,然后观察PCL/RCA 微胶囊在缓冲溶液中的pH 变色响应性。pH 为3~10 缓冲溶液的具体配制方法见表2。
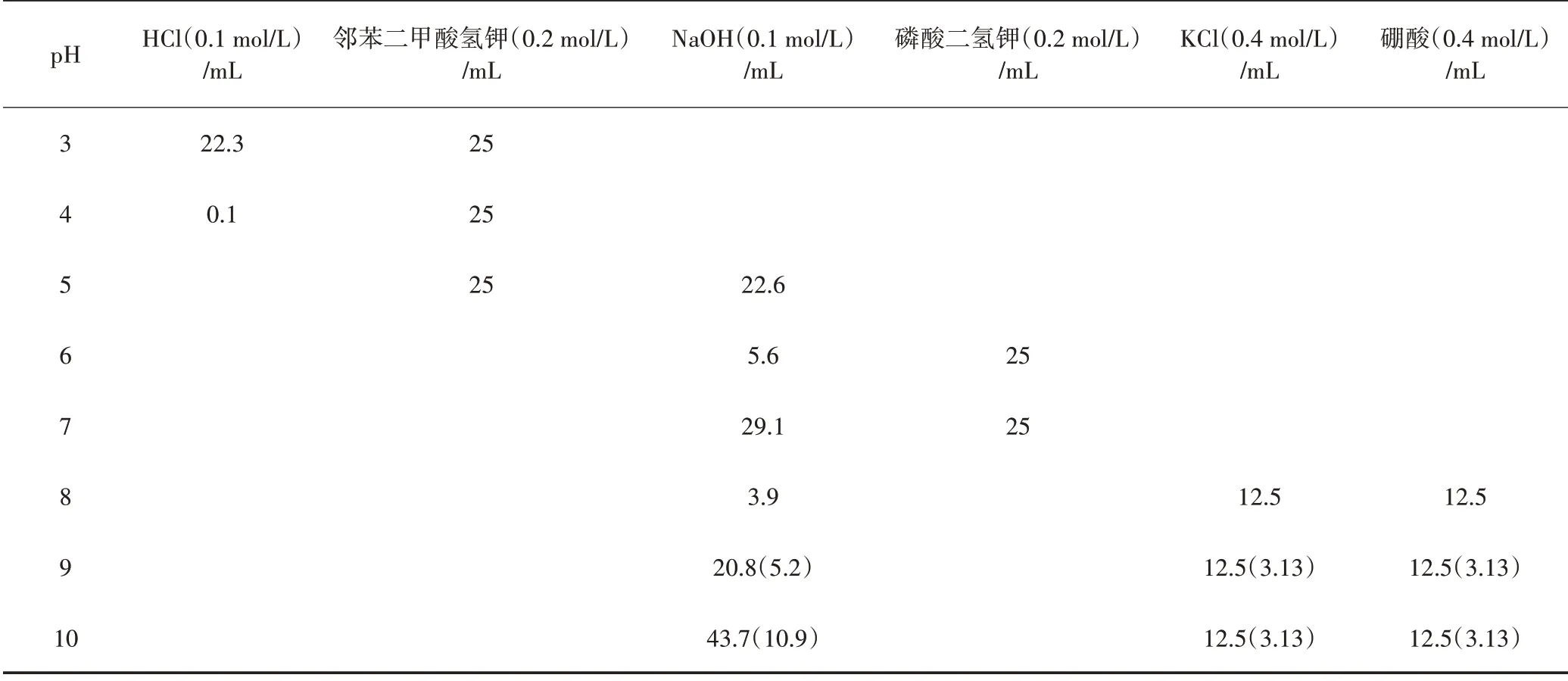
表2 pH 为3~10缓冲溶液的配制方法
1.3.5.2 颜色量化方法
HSV(hue,saturation,value)颜色空间基于颜色的直观特性,H表示色相,S表示饱和度,V表示明度[23]。色相环如图2 所示,色相H值中,0°或360°为红色,60°为黄色,120°为绿色,180°为青色,240°为蓝色,300°为品红色。HSV 对于用户来说是一种很直观的颜色模型,在计算机视觉、遥感图像处理识别等领域相对RGB 颜色模型具有独特优势[24]。但人眼的色彩感知和RGB 颜色空间之间有很大差别,与HSV 颜色空间比较接近,HSV 模式在视觉上能更好地体现色彩与亮度的差异。该方法在图像处理中具有独特优势:(1)亮度与色度是区分开来的,亮度分量和图像色彩信息不相关;(2)色调和饱和度相互独立,并且与人类感知密切相关[25]。根据人眼视觉特性,在图像分析中优先选择HSV 颜色空间进行色彩分析。
通过ON COLOR 颜色探测器对图像的颜色信息进行数字化处理,对图像进行颜色信息量化。拍照环境为室内自然光源,拍摄镜头垂直于地面,使用智能手机(分辨率16 MP)采集图像,每组溶液连续拍摄3张相片,计算3张相片的H分量平均值。
与传统的目视比色法相比,数字图像比色法不仅可以利用图像分析方法识别和提取pH 指示材料的色彩信息,还能识别出小的颜色变化,避免了视觉观测方法主观性因素的影响,实现了色彩信息量化,提高了检测准确度,实现了快速检测且可对颜色变化进行定量分析,大大提高了颜色变化识别的准确性。
1.3.6 统计学方法
每组数据均重复3 次并计算平均值,使用Origin对数据进行绘图处理,运用SPSS 17.0 对数据进行正交实验分析和ANOVA 差异显著性分析。
2 结果与讨论
2.1 微观形貌与结构
以5 mg/mL PCL 溶液和10 mg/mL RCA 溶液制得的微胶囊为例,微胶囊表观形貌如图3 所示。由图3a、3b 可知,PCL/RCA 微胶囊是较规整的球形结构,表面无孔洞和裂纹,部分微胶囊的表面有不规则的凹陷和褶皱,这是干燥过程中微胶囊表面水分蒸发造成的,或在喷金过程中高真空所导致。
为了分析花青素在微胶囊中的分布情况,通过透射电镜对微胶囊进行了观察,结果如图3c 所示。由图3c 可以看出,透射电镜显示得到的微胶囊内部有大块黑色被包裹物质;通过电子穿透样品成像,红色箭头指向处可明显看到其外层包覆有一层壁材。这证明PCL 与RCA 形成了微胶囊核壳结构。
2.2 FTIR
傅里叶变换红外光谱图中同时出现囊芯和囊壁的特征吸收峰,可以用来确定芯材和壁材的存在[26]。用红外光谱仪对纯PCL、纯RCA 和包裹花青素的微胶囊粉末进行扫描测试,结果如图4所示。
由图4a、4b 可以看出,在1 730 cm-1处的羰基(C—O)伸缩振动、2 950 和2 870 cm-1处饱和碳(—CH2—)上的C—H 伸缩振动、1 470~1 350 cm-1处的C—H面内弯曲振动、1 250~1 140 cm-1处的C—O—C 伸缩振动、3 340 cm-1处的O—H 伸缩振动、800 cm-1处的O—H 弯曲振动吸收峰非常吻合。PCL/RCA 微胶囊的红外光谱图与纯PCL 的图谱一致,说明微胶囊中存在聚己内酯,证实了外壳材料是聚己内酯。
花青素主要由苯环、含氧杂环、羟基等部分组成[27]。由图4a、4c 可以看出,在3 280 cm-1处的酚羟基O—H 振动、2 930 cm-1处的C—H 伸缩振动、1 650 cm-1处的苯环(C— C)伸缩振动、1 025 cm-1处的C—H面内弯曲振动非常吻合,说明微胶囊中存在花青素。PCL 包埋RCA 后,没有出现明显的谱峰位移,说明两种物质没有发生基团反应。结合电镜分析可确定,芯材RCA 被成功包覆在PCL 壳中。
2.3 包封率及加载率
2.3.1 标准曲线绘制
由图5 可以看出,紫甘蓝花青素最大吸收波长为535 nm。
根据不同质量浓度紫甘蓝花青素水溶液的紫外吸光度数据进行绘图和线性拟合,结果如图6所示。应用数学拟合方法,得到花青素的标准曲线关系式为:
式中,x为RCA 的质量浓度(mg/mL),y为RCA 的吸光度。在所选质量浓度范围内,RCA 质量浓度与紫外吸光度线性关系良好。
2.3.2 包封率及加载率测试结果
由表3 可以看出,微胶囊的包封率和加载率受注射泵进料流速和进料质量浓度的影响,注射泵进料流速和RCA 质量浓度越大,包封率和加载率越大;聚己内酯质量浓度越大,加载率越小,对包封率无明显影响。
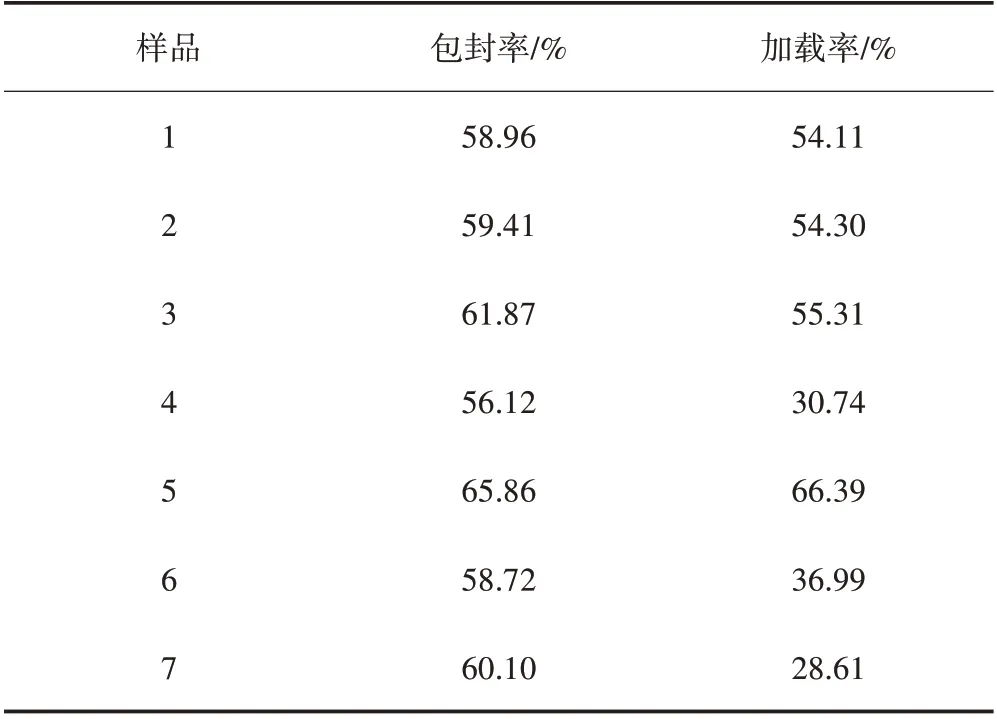
表3 微胶囊包封率及加载率测试结果
2.4 粒径及其分布的影响因素
2.4.1 进料流速
图7 显示了微胶囊平均粒径随注射泵进料流速的变化趋势。
由图7 可看出,随着进料流速从20 mL/min 增大到60 mL/min,微胶囊平均粒径逐渐减小,粒径分布更加集中。这可以用沉淀特征时间尺度来解释:当进料流速增加时,特征混合时间减少,成核优于生长,粒子越来越小。在较高的注射泵进料流速下,聚己内酯的过饱和度较大,会形成更多的疏水核心,导致得到的微胶囊粒径更小;并且在更高的流速下,液体混合得更加均匀,较高流速下混合液体在混合腔中停留的时间较短,微胶囊的生长时间也相应减小[28]。
2.4.2 花青素质量浓度
图8 给出了不同质量浓度花青素溶液制备的微胶囊平均粒径及其分布图。由图8 可以看出,微胶囊的粒径都呈单峰正态分布,随着花青素质量浓度的降低,微胶囊平均粒径逐渐减小,且粒径分布更集中。这是RCA 有效掺入聚合物体系的结果。在微胶囊生产过程中,始终可以获得较高的包封率,使得活性物质的损耗少。初始RCA 质量浓度较低的样本,包封率最低。原因是随着花青素质量浓度的降低,RCA 能被聚合物有效包裹的量减少,从而粒径更小。
2.4.3 聚己内酯质量浓度
图9 给出了不同质量浓度PCL 溶液制备的微胶囊平均粒径及其分布图。由图9 可以看出,随着PCL质量浓度的增大,微胶囊的平均粒径增大,粒径分布范围变大,而包封率无明显变化。原因可能是随着PCL 质量浓度的增大,微胶囊在生长阶段能获得更多的聚合物,粒径更大,最终得到微米大小的颗粒。
2.5 pH 变色响应性
2.5.1 纯花青素显色
取少量RCA 粉末,滴加pH 为3~10 的缓冲溶液,RCA在不同pH下的颜色如表4所示,并用ON COLOR软件识别H值。
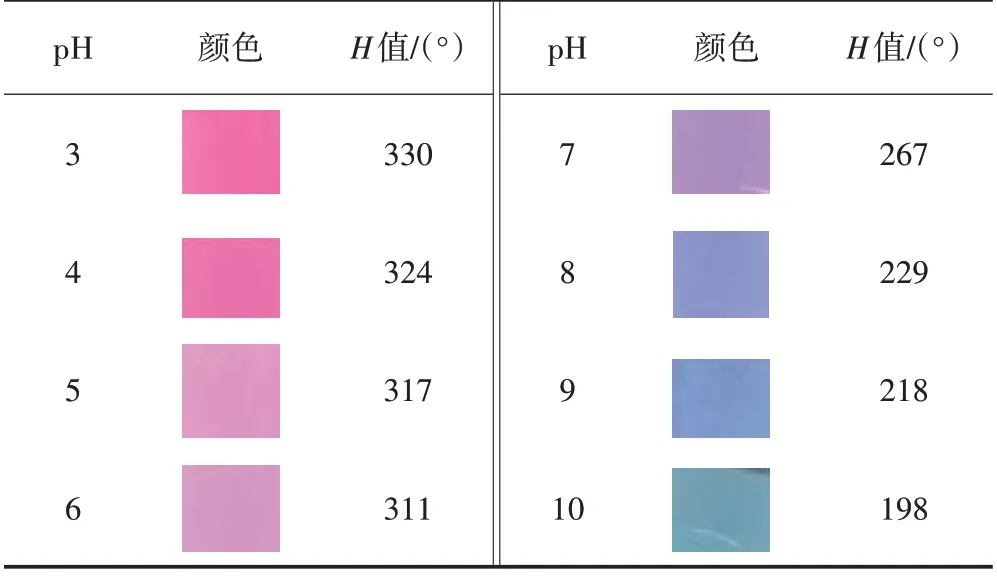
表4 紫甘蓝花青素颜色与H 值随pH 的变化
由表4 可以看出,随着酸碱度从酸性变为碱性,RCA 颜色变化显著,pH 为3~4 时,RCA 显红色;pH 为5~6 时为紫红色;pH 为7 时显示紫色;pH 为8~9 时显示蓝色;pH 为10 时呈现绿色。采集得到的原始影像数据经预处理后得到每组相片的H值,结果见表4。
2.5.2 微胶囊显色
取少量微胶囊粉末(样品5)置于滤纸上,分别滴加pH 为3~10 的缓冲溶液,PCL/RCA 微胶囊在不同pH 下的颜色如图10 所示。由图10 可以看出,PCL/RCA 微胶囊在不同pH 下具有明显不同的颜色,随着pH 的增加,微胶囊相应产生3 个不同的颜色。其中,当pH 小于5 时,微胶囊呈红色;当pH 为5~9 时,微胶囊由红色向紫色转变;当pH 大于9 时,微胶囊颜色转变为蓝色,显色结果与花青素趋势一致。
由表5 可以看出,在pH 为3~10 时,微胶囊色相H值随着缓冲溶液pH 的增加,从340°(红色)左右逐渐降低到225°(蓝色)左右,颜色由红色逐渐变为蓝色。根据H值数值的变化可以判断,虽然微胶囊显色后H值与花青素不完全一致,但数值接近且变色趋势相同,H值都随pH 的增大而减小,颜色由红色向蓝色转变,可以作为酸碱指示微胶囊应用。

表5 pH 变色微胶囊在pH 为3~10时的H 值分量
3 结论
采用瞬时纳米沉淀法制备了一种聚己内酯(PCL)/花青素(RCA)微胶囊。所制备的微胶囊形态为球形,表面光滑完整,没有裂缝和孔隙,能对芯材RCA 起到有效的包埋。微胶囊粒径大小与RCA、PCL质量浓度成正相关,与注射泵进料流速成负相关。微胶囊的包封率与注射泵进料流速和RCA 质量浓度成正相关,PCL 质量浓度对花青素包封率影响较小。微胶囊样品在pH 为3~10 时可从红到紫到蓝连续变色,显示其在伤口酸碱度监测医用敷料领域的潜在应用价值。

