肾透明细胞癌细胞焦亡相关基因预后模型的建立与应用
毛 伟,张 琳,刘清钊
(1.重庆市南岸区人民医院药剂科,重庆 400060;2.陆军军医大学第一附属医院药剂科,重庆 400038;3.重庆市南岸区人民医院肾内科,重庆 400060)
肾细胞癌(renal cell carcinoma,RCC)是最常见的恶性肿瘤之一,在男性恶性肿瘤中排名第6,在女性恶性肿瘤中排名第9[1]。肾透明细胞癌(clear cell renal cell carcinoma,ccRCC)是肾癌中最常见的亚型,其发病率占肾癌的70%~80%[2]。ccRCC 的病理生理学很复杂,除了肥胖、吸烟、高血压和糖尿病等因素外,还有多种基因突变[3]。因此,建立可以准确预测ccRCC 患者预后的工具用于指导临床诊治至关重要。细胞焦亡(pyroptosis)又称细胞炎性坏死,是一种程序性细胞死亡[4]。焦亡细胞以细胞肿胀和许多泡状突起为特征,在电子显微镜下,可以看到其首先形成大量的囊泡,当这些囊泡形成后,细胞膜上就会形成孔洞,孔洞破裂,内容物流出[5]。细胞焦亡主要依靠caspase 家族的部分蛋白,活化caspase 后裂解gasdermin 蛋白,促进炎症小体的转录和表达以及IL-1β、IL-18 等炎症因子的分泌,最终导致细胞死亡[6]。细胞焦亡最初被发现是抵抗感染的关键机制,越来越多的研究表明,它在肿瘤的发展中也起着重要作用。有研究报道[7],炎性小体、gasdermin 蛋白和炎症因子与肿瘤的发生、侵袭和转移有关。细胞焦亡在肿瘤的发生和抗肿瘤过程中起着重要的作用,但其在ccRCC 中的具体作用研究较少。因此,本研究拟建立焦亡相关评分模型,探讨ccRCC 中细胞焦亡、预后、免疫微环境以及免疫治疗之间潜在的相关性。
1 材料与方法
1.1 数据来源 从TCGA 数据库下载509 例ccRCC及71 例癌旁正常组织的转录组数据和临床数据,剔除年龄、性别、生存状态、病理分期缺失以及生存时间小于30 d 的样本,从ICGC 数据库中下载转录组数据及临床数据进行验证。
1.2 细胞焦亡相关基因的鉴定 利用“edgeR”包筛选ccRCC 与癌旁组织之间的差异表达基因(DEGs),筛选条件:|Log2FC|>1,FDR<0.05。从GO、MSigDB 数据库及先前的研究[8-13]中共获取到58 个焦亡基因,差异焦亡基因为58 个焦亡基因与DEGs 的交集。
1.3 一致性聚类 利用“ConsensusClusterPlus”包对差异焦亡基因矩阵进行一致性聚类,聚类值k 取2~6,根据聚类效果选择具有较高聚类稳定性的k 值。
1.4 富集分析 以“c2.cp.kegg.v7.4.symbols.gmt”为参考基因集进行基因集变异分析(GSVA)、基因集富集分析(GSEA)。FDR<0.01 表示差异有统计学意义。
1.5 肿瘤微环境(TME)细胞浸润 采用“CIBERSORT”“quanTIseq”算法来定量免疫细胞的比例,应用“ESTIMATE”包评估肿瘤纯度。
1.6 焦亡相关评分模型的建立与评估 利用“edgeR”包筛选ccRCC 聚类簇间的DEGs,筛选条件:|Log2FC|>1,FDR<0.05。然后对DEGs 进行单因素Cox 回归、多因素Cox 回归和LASSO 回归分析筛选焦亡相关基因并构建风险评分模型:
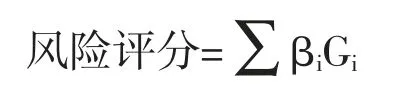
其中Gi、βi分别代表模型中基因表达水平及系数。
根据公式计算出每个ccRCC 患者的风险评分,利用“survminer”包确认最佳截止点将患者分为高、低风险两组并进行Kaplan-Meier 生存曲线分析,应用“timeROC 包”进行ROC 曲线分析,评估模型的稳定性。结合临床数据和风险评分,利用“regplot”包绘制列线图、校准曲线评估模型的预测能力。
2 结果
2.1 差异焦亡基因的鉴定 共发现4179 个DEGs,见图1A。DEGs 与58 个细胞焦亡基因取交集筛选出了23 个上调和1 个下调的差异焦亡基因,见图1B、图1C;KEGG 分析结果显示,差异焦亡基因主要富集在NOD 样受体信号通路、TNF 信号通路等炎症通路以及沙门氏菌感染、军团菌病等感染性疾病相关通路,见图1D。
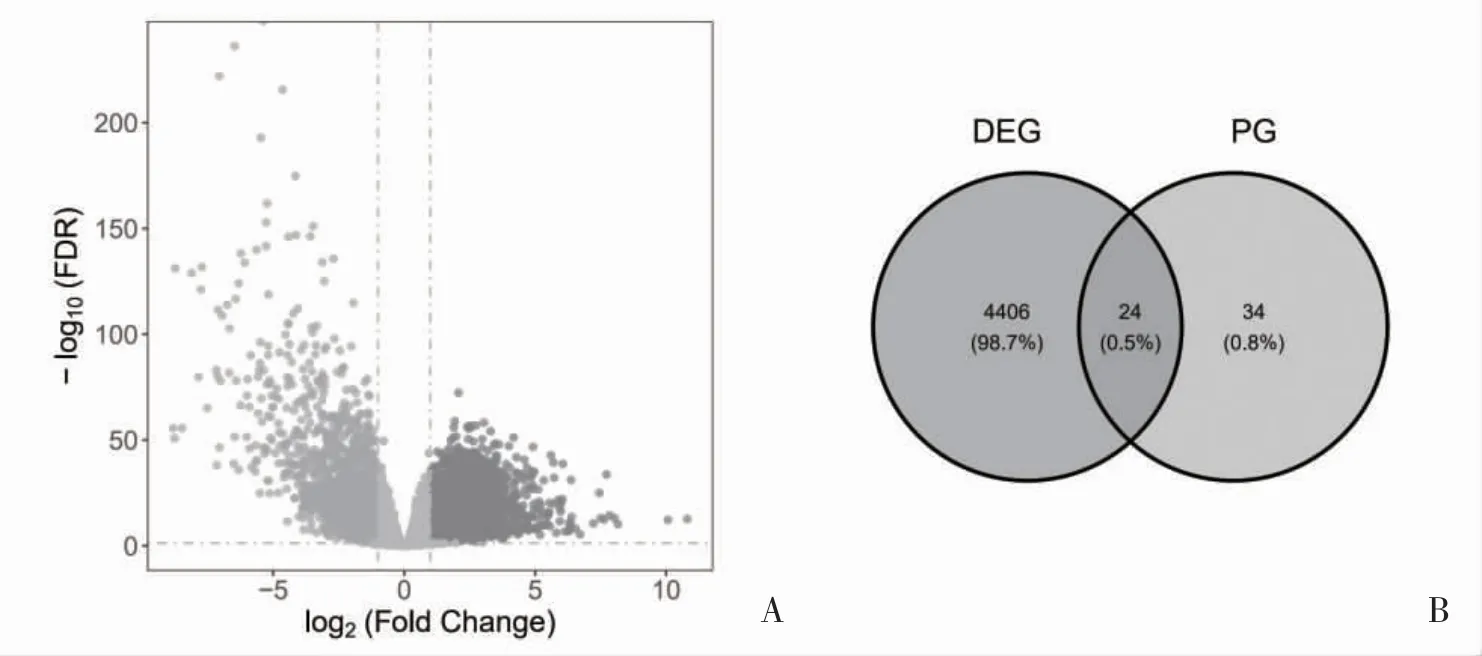
图1 差异焦亡基因的筛选

图1 差异焦亡基因的筛选(续)
2.2 基于差异焦亡基因的肿瘤分型 为研究24 个差异焦亡基因表达水平与ccRCC 亚型之间的关系,对ccRCC 患者进行一致性聚类分析,当k=2 时,组内相关性最高而组间相关性最低,确定了两种不同的ccRCC 亚型,其中聚类簇1 包含252 例患者,聚类簇2 包含257 例患者,见图2A;Kaplan-Meier 生存分析显示,聚类簇1 生存优势显著高于聚类簇2,见图2B。为了探索2 种亚型间的信号通路差异,进行GSVA 分析,结果显示:聚类簇1 在代谢相关通路中富集,主要包括丁酸代谢、丙酸代谢、氧化磷酸化、三羧酸循环;聚类簇2 在免疫相关通路中富集,主要包括NOD 样受体信号通路、Toll 样受体信号通路、B细胞受体信号通路、T 细胞受体信号通路,见图2C。

图2 细胞焦亡基因相关的肿瘤亚型
2.3 两种ccRCC 亚型在TME 细胞浸润上的差异 通过分析两种ccRCC 亚型在TME 细胞浸润情况,发现M2 巨噬细胞、单核细胞、NK 细胞、幼稚B 细胞、静息肥大细胞、静息CD4+记忆T 细胞、激活的树突状细胞主要富集在聚类簇1 中,而聚类簇2 富含调节性T 细胞、B 细胞、浆细胞、激活的CD4+记忆T细胞、γδT 细胞、CD8+T 细胞,见图3A、图3B;基质评分、免疫评分、ESTIMATE 评分结果显示,聚类簇1评分均低于聚类簇2,见图3C。

图3 两种ccRCC 亚型在TME 上的差异
2.4 焦亡相关评分模型的建立与验证 对两种ccRCC 亚型的差异进行分析,确认了1096 个DEGs,通过单因素和多因素Cox 回归,筛选出248 个可作为独立预后特征的基因;进行LASSO 回归,确认了10个焦亡相关基因用于构建风险评分模型,见图4A、图4B;预后风险评分=1.0518×C10orf90+0.0845×HS3ST3A1 +0.0407 ×SAA1 -0.324 ×MPP7 +0.2061 ×IGF2BP3 +0.0566 ×ADAMTS14 +0.2176 ×CILP -0.0119×SHOX2-0.1069×TRIM2+0.3367×HHIPL2。根据上述公式,计算每个患者的风险评分,并将患者分为高风险组和低风险组,最佳截止值为0.9562,结果显示,低风险组较高风险组有生存优势,见图4C、图4D,其中1、3、5 年生存率的AUC 预测值分别为0.77、0.727、0.764,见图4E。为了验证预后模型的预测能力,从ICGC 数据库下载ccRCC 的转录组数据和临床数据,根据风险评分公式,将患者分为高低风险两组,最佳截止值为1.9869,见图4F、图4H;患者1、3、5 年生存率的 AUC 预测值分别为0.774、0.747、0.762,见图4G。

图4 构建风险评分模型
2.5 风险评分与患者临床病理因素的关系 结果显示,风险评分在肿瘤负担较重、肿瘤体积较大、淋巴结受累较重、远端转移、病理分期较晚、组织学分级较晚的男性患者中显著增高,见图5。

图5 风险评分与临床病理关系
2.6 风险评分与ccRCC 患者预后的关系 单因素Cox 回归分析显示,高龄、进展期病理分期、较大的肿瘤体积、较重淋巴结受累、远处转移、高风险评分是影响患者总生存期的不利因素;多因素Cox 回归分析显示,年龄、病理分期、风险评分是患者预后的独立影响因素,见表1。进一步验证风险评分对ccRCC 患者的预后价值,以年龄、病理分期、风险评分构建列线图,见图6A;结果显示,预测与实际的生存概率有较好的一致性,见图6B;预测总生存期的C 指数为0.7714(95%CI:0.7534~0.7894);患者1、3、5 年生存率的AUC 预测值分别为0.872、0.803、0.752,见图6C。
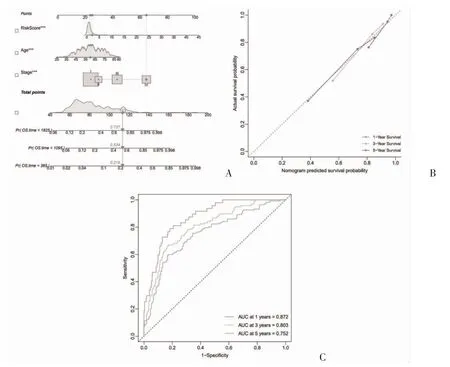
图6 风险评分对ccRCC 患者的预后价值
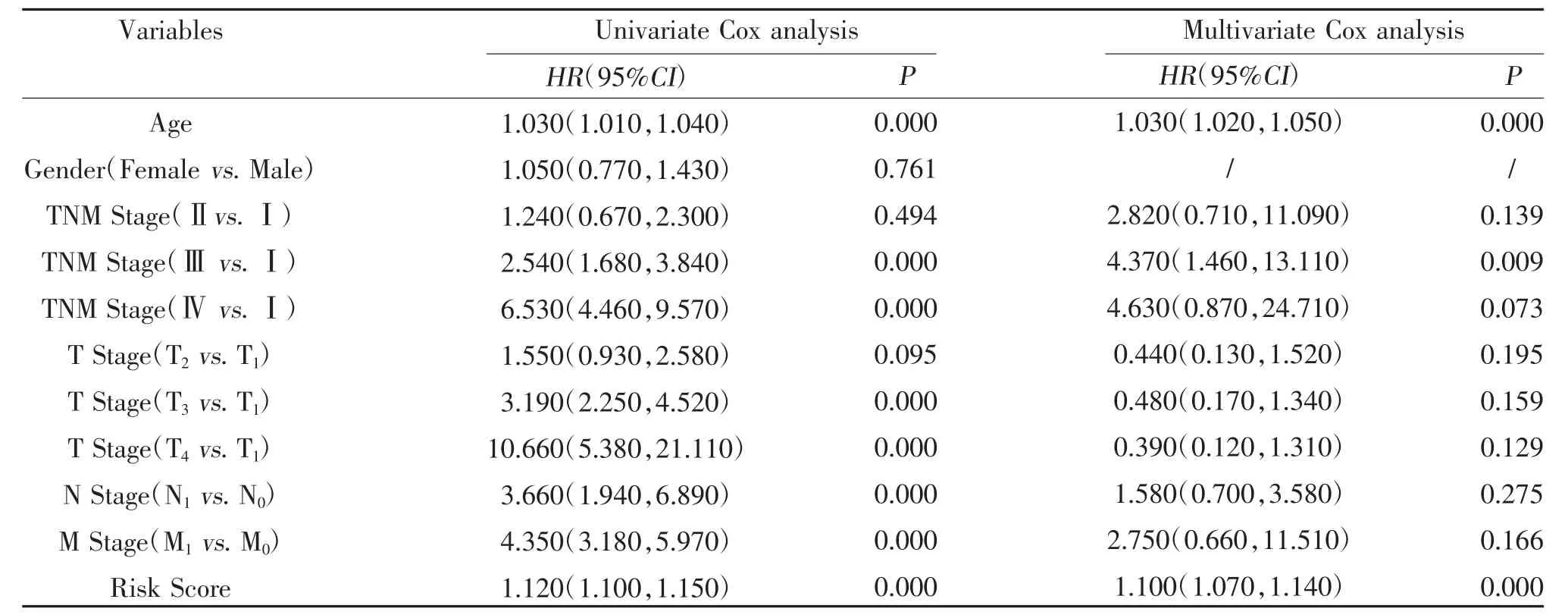
表1 单因素和多因素Cox 回归分析
2.7 GSEA、GSVA 富集分析 GSEA、GSVA 富集分析显示,高风险组主要富集在趋化因子信号通路、产生IGA 的肠道免疫网络、细胞因子受体相互作用等免疫相关通路,低风险组主要富集在三羧酸循环、丙酸代谢、脂肪酸代谢、缬氨酸亮氨酸异亮氨酸降解等代谢相关通路,见图7。

图7 GSEA、GSVA 富集分析
2.8 高风险组与低风险组在TME 细胞浸润上的差异 ESTIMATE、CIBERSORT 和quanTIseq 算法显示,高风险组的基质评分、免疫评分较高,见图8A,但高风险组含有更高水平的免疫抑制细胞如巨噬细胞、调节性T 细胞,见图8B。

图8 高风险组与低风险组免疫细胞浸润差异
2.9 风险评分预测免疫治疗效果的价值 高风险组体细胞突变高于低风险组,见图9A、图9B,通过比较高风险组与低风险组免疫检查点(PD-1、PD-L1、CTLA4、LMTK3、LAG3、TIGIT、CD27、OX40、GITR、ICOS)的基因表达水平发现,高风险组基因表达水平普遍高于低风险组,见图9C;通过ImmuCellAI 数据库预测高低风险组对免疫治疗的反应,结果显示,低风险组的反应率更高,见图9D。

图9 风险评分预测免疫治疗效果的价值
3 讨论
细胞焦亡是机体重要的免疫反应,在拮抗感染和内源性危险信号中发挥重要作用。研究表明[14],细胞焦亡在肿瘤的生长中起着双向作用,一方面炎性体可以诱导肿瘤细胞发生焦亡,抑制肿瘤细胞的增殖;另一方面,炎性体的累积效应也可以形成适宜肿瘤细胞生长的微环境,起着促瘤生长的作用。然而,有关细胞焦亡与ccRCC 的预后、免疫微环境的研究较为有限,需要进一步深入研究。
本研究对TCGA 数据库中ccRCC 的焦亡基因进行差异表达分析,获取到24 个差异焦亡基因。基于上述差异焦亡基因进行一致性聚类分析得到2 个亚型,聚类簇1 生存优势显著高于聚类簇2。GSVA分析表明,聚类簇1 主要富集在代谢相关通路,聚类簇2 主要富集在免疫相关通路。为了进一步评估焦亡相关基因与ccRCC 的关系,本研究基于两个亚型的差异基因进行单因素、多因素Cox 回归及LASSO回归分析构建1 个风险评分模型,发现低风险组生存优势高于高风险组(P<0.001),并在ICGC 数据库中进行了验证,说明风险评分是ccRCC 预后的独立危险因素。包含风险评分、年龄及病理分期的列线图显示,在预测ccRCC 生存概率方面,AUC 较高(1、3、5 年分别为0.872、0.803、0.752)。风险评分与肿瘤大小、淋巴结转移、远端转移、病理分期、组织学分级呈正相关,基于这一特征,高风险组表现出更具侵袭性的生物学行为。此外,高风险组肿瘤细胞存在免疫抑制表型,巨噬细胞和调节性T 细胞浸润较多。最后,还对免疫治疗反应进行了预测,发现低风险组的反应率更高。以上结果表明,风险评分可用于ccRCC 患者预测预后。
本研究筛选出10 个焦亡相关基因(C10orf90、HS3ST3A1、SAA1、MPP7、IGF2BP3、ADAMTS14、CILP、SHOX2、TRIM2、HHIPL2),这10 个基因表达情况与ccRCC 预后相关。研究发现,TRIM2、MPP7表达越高ccRCC 患者预后越好(P<0.001),C10orf90、HS3ST3A1、SAA1、IGF2BP3、ADAMTS14、CILP、SHOX2、HHIPL2 表达越高ccRCC 患者预后越差(P<0.001)。TRIM2 作为一种抗肿瘤基因,其过度表达显著抑制了RCC 迁移和侵袭能力,在ccRCC中起负调控作用[15]。New M 等[16]研究表明,MPP7 是一种参与细胞接触的脚手架蛋白,其高表达引起胰腺导管腺癌细胞自噬,导致癌细胞死亡。目前在CILP 癌症中的作用尚不清楚。SHOX2 异常表达导致上皮间质转化(EMT),SHOX2 可能通过TGF-β信号通路调节EMT 来促进人膀胱癌细胞的迁移、侵袭[17]。TRIM 家族蛋白在发育、凋亡、自噬、炎症、先天免疫及癌变等多种生物过程中具有广泛的作用[18]。C10orf90 是位于DNA 损伤高敏位点的抑癌基因,可激活p53-p21 通路抑制肿瘤发生[19]。HS3ST3A1 是一种新的肿瘤调节因子,因肿瘤表型的不同可发挥抑癌或促癌作用[20]。SAA1 可能参与肿瘤的发生发展,促进胰腺癌的进展和远处转移[21]。Lin YM 等[22]研究结果表明,ADAMTS14 在口腔鳞状细胞癌中低表达,并调节口腔鳞状细胞癌中的细胞存活,且其表达是口腔鳞状细胞癌患者的独立预后标志物。HHIPL2是一种跨膜蛋白,HHIPL2 的表达水平与胃癌显著相关。微阵列分析和qRT-PCR 验证发现胃癌样本中HHIPL2 的表达水平高出正常组织7.4 倍[23]。研究表明[24],IGF2BP3 不仅在多种肿瘤组织中表达上调,还在一些癌前病变如巴雷特食管、非典型子宫内膜异位症中表达上调。
本研究仍然存在一些不足:首先,预后模型与ccRCC 的发生、发展的关系仍需体外和体内实验进一步验证,以更好地评估预后模型和ccRCC 之间的关系;其次,本研究数据来自TCGA 数据库,对其他人群的适用性尚不明确。但建立的预后模型可有效预测ccRCC 患者的预后,可能对指导临床治疗、制定精准治疗方案具有重要价值。
综上所述,ccRCC 焦亡相关基因预后模型可用于预测ccRCC 患者的预后,可以作为免疫治疗反应的预测指标,有利于进一步指导临床治疗。

