LIMD2基因表达对食管癌细胞增殖、凋亡及ERK/MAPK信号通路的影响
李险波,张志强,韩小勇,甄志鹏,李焕芬,赵 钦 (.保定市第一中心医院胸外科,河北 保定 07000;.河北省人民医院胸外科,河北 石家庄 05005)
食管癌是消化道系统最常见的肿瘤之一[1],其病死率居世界第6位,是世界第八大癌症[2]。食管癌的发生发展涉及遗传、表观遗传、基因及蛋白异常表达等多种途径的改变[3],阐明食管癌的致癌分子机制对食管癌的靶向治疗具有重要意义。LIM结构域(LIM domain,LIMD)可广泛存在于真核生物中,能调控细胞黏附、运动和信号转导等相关基因表达,从而参与调节细胞生长发育进程[4]。LIMD家族中的LIMD2目前已被证实与人类癌症的发生和进展相关[5],且LIMD2已被确定为甲状腺乳头状癌淋巴结转移的生物标志物,成为了肿瘤进展的新效应器[6]。但LIMD2在食管癌中的作用尚未明确。细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)磷酸化活化后,可从细胞质转移到细胞核,并激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号转导通路,调控细胞增殖、生长、分化、凋亡等生命活动过程[7]。且ERK/MAPK信号通路活化已被证实参与食管癌、结肠癌、甲状腺癌等多种癌症的发展过程[8]。有研究显示,LIMD2能够通过调控ERK/MAPK信号通路而影响甲状腺癌进展[9]。本研究就LIMD2对食管癌细胞增殖、凋亡的影响及分子机制展开分析,以期为食管癌的靶向治疗提供参考。
1 材料与方法
1.1 标本来源及细胞来源
选择2019年3月至2020年6月于保定市第一中心医院进行手术切除治疗的食管癌患者10例,留取新鲜的癌组织及对应的癌旁组织标本。患者术前均未接受化疗或放疗,10例患者中,男6例,女4例;年龄42~70岁;肿瘤最大径3~8 cm;高分化2例,中分化6例,低分化2例;TNM分期:Ⅰ期1例,Ⅱ期5例,Ⅲ期4例;淋巴结转移7例,无淋巴结转移3例。本研究经保定市第一中心医院伦理委员会批准执行(2018-B-566),患者均知情同意。
人食管癌细胞KYSE30、EC9706和人正常食管上皮细胞(HEEC)均购自宁波明舟生物科技有限公司,批号分别为18210615、18251481、18053217。
1.2 主要试剂与仪器
CCK-8试剂盒(批号8127165)购自福州飞净生物科技有限公司;RNA提取试剂盒(批号15181036)购自北京博迈斯科技发展有限公司;逆转录试剂盒(批号0621181809)购自美国GeneCopoeia公司;一抗ERK1/2、p-ERK1/2、p38MAPK、p-p38MAPK、细胞周期相关蛋白cyclin D1和CDK2、凋亡相关蛋白caspase-3、整合素β1、黏着斑激酶(focal adhesion kinase,FAK)、整合素连接激酶(integrin-linked kinase,ILK)均购自Abcam公司,批号分别为1513812、0627143、0825641、1315703、2164215、5108514、1003052、02190418、1652025、0583521;Q1600型qRT-PCR仪购自厦门和谱仪器有限公司;SpectraMax i3x酶标仪购自美谷分子仪器(上海)有限公司。
1.3 组织处理、细胞培养及分组处理
各新鲜食管癌组织及癌旁组织标本,剪取1 g置于-80 ℃冰箱保存,以备检测LIMD2 mRNA及ERK1/2、p-ERK1/2、p38MAPK、p-p38MAPK蛋白表达,剩余组织置于4%多聚甲醛中固定24 h,随后进行石蜡包埋、切片,以备免疫荧光染色检测LIMD2蛋白表达水平。
取人食管癌细胞(KYSE30、EC9706)和人正常食管上皮细胞(HEEC)常规复苏,随后用DMEM培养基(含10%胎牛血清及100 U/mL青霉素—链霉素)在恒温培养箱中常规培养及传代,待细胞达到90%融合度时收集,采用qRT-PCR及免疫荧光染色检测各细胞中LIMD2 mRNA及蛋白表达,选择LIMD2 mRNA及蛋白表达最高的EC9706细胞进行后续试验。
取EC9706细胞,按照1×105个/孔的密度接种于6孔板中,并设置为:对照组、Si-LIMD2组、Si-NC组、PD98059组、ISO组、Si-LIMD2+ISO组,每组6个复孔。对照组常规培养;Si-LIMD2组及Si-NC组分别转染含LIMD2干扰序列的腺病毒载体及不含LIMD2干扰序列的空腺病毒载体;PD98059组及ISO组参照文献[10-11]分别在培养基中加入终浓度为50 μmol/L的ERK/MAPK通路阻断剂(PD98059)及20 μmol/L的ERK/MAPK通路激活剂盐酸异丙肾上腺素(isoproterenol hydrochloride,ISO);Si-LIMD2+ISO组在Si-LIMD2组基础上加入ISO溶液(20 μmol/L)进行培养。各组培养24 h后进行后续试验。
1.4 qRT-PCR法检测细胞及组织LIMD2 mRNA表达
取1.3项下于-80 ℃保存的癌组织及癌旁组织,4 ℃解冻,冰上匀浆分离,随后用RNA提取试剂盒提取总RNA。取1.3项下的KYSE30细胞、EC9706细胞、HEEC细胞及各组EC9706细胞,加入细胞裂解液,用RNA提取试剂盒分别提取总RNA。将提取的总RNA用逆转录试剂盒反转录得到cDNA,以cDNA为模板,按照qRT-PCR试剂盒说明书进行PCR反应(反应体系:上下游引物各0.5 μL,2×SYBR mix 10 μL,10×cDNA模板1 μL,灭菌双蒸水8 μL。反应条件:94 ℃预变性14 min、94 ℃变性33 s、67 ℃退火57 s,55个循环,72 ℃延伸17 min),以GAPDH为内参,用2-ΔΔCt法计算LIMD2 mRNA表达水平。各引物序列由大连宝生物公司合成,见表1。

表1 引物序列表
1.5 免疫荧光染色检测细胞LIMD2蛋白表达
取1.3项下KYSE30细胞、EC9706细胞、HEEC细胞及各组EC9706细胞进行细胞爬片,将爬片经4%多聚甲醛固定,曲拉通透化、封闭,而后加入一抗(LIMD2,1∶200)4 ℃孵育过夜,避光加入荧光二抗(异硫氰酸荧光素,1∶200),DAPI染核、甘油封片后于荧光显微镜下观察拍照,用Image Pro Plus 5.0分析图像,测定阳性表达的平均光密度值。
1.6 Western blot法检测相关蛋白表达
取1.3项下-80 ℃保存的癌组织及癌旁组织,4 ℃解冻,冰上匀浆分离,用蛋白提取试剂盒提取总蛋白,并用BCA法检测蛋白浓度。取1.3项下KYSE30细胞、EC9706细胞、HEEC细胞及各组EC9706细胞,加入细胞裂解液,用蛋白提取试剂盒提取总蛋白,并用BCA法检测蛋白浓度。各取25 μg蛋白样品行电泳(浓缩胶80 V,分离胶120 V)及转膜反应200 mA,加入一抗(ERK1/2、p-ERK1/2、p38MAPK、p-p38MAPK、cyclin D1、CDK2、caspase-3、整合素β1、FAK、ILK抗体,1∶2 000;内参抗体β-actin,1∶2 000),4 ℃孵育过夜,加入辣根过氧化物酶二抗(1∶3 000),室温下孵育2 h。ECL显影曝光后用化学发光成像分析系统拍照并分析灰度值,每组试验重复3次。其中癌组织及癌旁组织只检测ERK/MAPK通路蛋白表达。
1.7 CCK-8法检测细胞增殖活性
取1.3项下培养24 h后的各组EC9706细胞,加入10 μL CCK-8溶液继续培养2 h,随后用比色法在450 nm波长下检测各组细胞OD值,以细胞培养液OD值为空白OD值,根据公式细胞生存率(%)=[(试验组OD值-空白OD值)/(对照组OD值-空白OD值)]×100%计算细胞生存率,以细胞生存率高低代表细胞增殖活性。
1.8 流式细胞仪检测细胞周期及凋亡率
收集1.3项下培养24 h后的各组EC9706细胞,加入100 μL结合缓冲液、10 μL FITC标记的Annexin-V溶液,室温避光孵育30 min,再加入5 μL碘化丙啶避光孵育5 min,随后加入400 μL结合缓冲液,在流式细胞仪下检测细胞周期和凋亡情况。
1.9 统计学分析

2 结果
2.1 食管癌组织中LIMD2 mRNA、蛋白及ERK/MAPK通路蛋白表达
qRT-PCR结果显示,癌组织中LIMD2 mRNA表达高于癌旁组织(P<0.05),见表2。免疫荧光染色显示,癌组织中LIMD2蛋白表达高于癌旁组织(P<0.05),见图1。Western blot结果显示,癌组织中p-ERK1/2、p-p38MAPK蛋白表达高于癌旁组织(P<0.05),见图2、表2。

a:癌旁组织;b:癌组织图1 食管癌组织中LIMD2免疫荧光图片(×400)
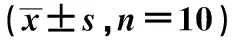
表2 食管癌组织中LIMD2 mRNA、蛋白及ERK/MAPK通路蛋白表达比较

图2 食管癌组织中ERK/MAPK通路蛋白表达免疫印迹图
2.2 细胞中LIMD2表达
qRT-PCR结果显示,KYSE30、EC9706细胞中LIMD2 mRNA表达高于HEEC细胞(P<0.05)。免疫荧光染色显示,KYSE30、EC9706细胞中LIMD2 蛋白表达高于HEEC细胞(P<0.05),且EC9706细胞中LIMD2 mRNA、LIMD2蛋白表达高于KYSE30细胞,见表3、图3。

表3 细胞中LIMD2 mRNA、LIMD2蛋白表达比较

a:HEEC细胞;b:KYSE30细胞;c:EC9706细胞图3 细胞中LIMD2免疫荧光图片(×400)
2.3 各组EC9706细胞LIMD2 mRNA、蛋白及ERK/MAPK通路蛋白表达
qRT-PCR及免疫荧光染色结果显示,与对照组相比,Si-LIMD2组LIMD2 mRNA、LIMD2蛋白表达较低(P<0.05),见图4、表4。Western blot结果显示,与对照组相比,Si-LIMD2组和PD98059组p-ERK1/2、p-p38MAPK蛋白表达较低(P<0.05),ISO组p-ERK1/2、p-p38MAPK蛋白表达较高(P<0.05);与Si-LIMD2组相比,Si-LIMD2+ISO组p-ERK1/2、p-p38MAPK蛋白表达较高(P<0.05),见表4、图5。

a:对照组;b:Si-LIMD2组;c:PD98059组;d:ISO组;e:Si-LIMD2+ISO组;f:Si-NC组图4 各组EC9706细胞LIMD2免疫荧光图片(×400)
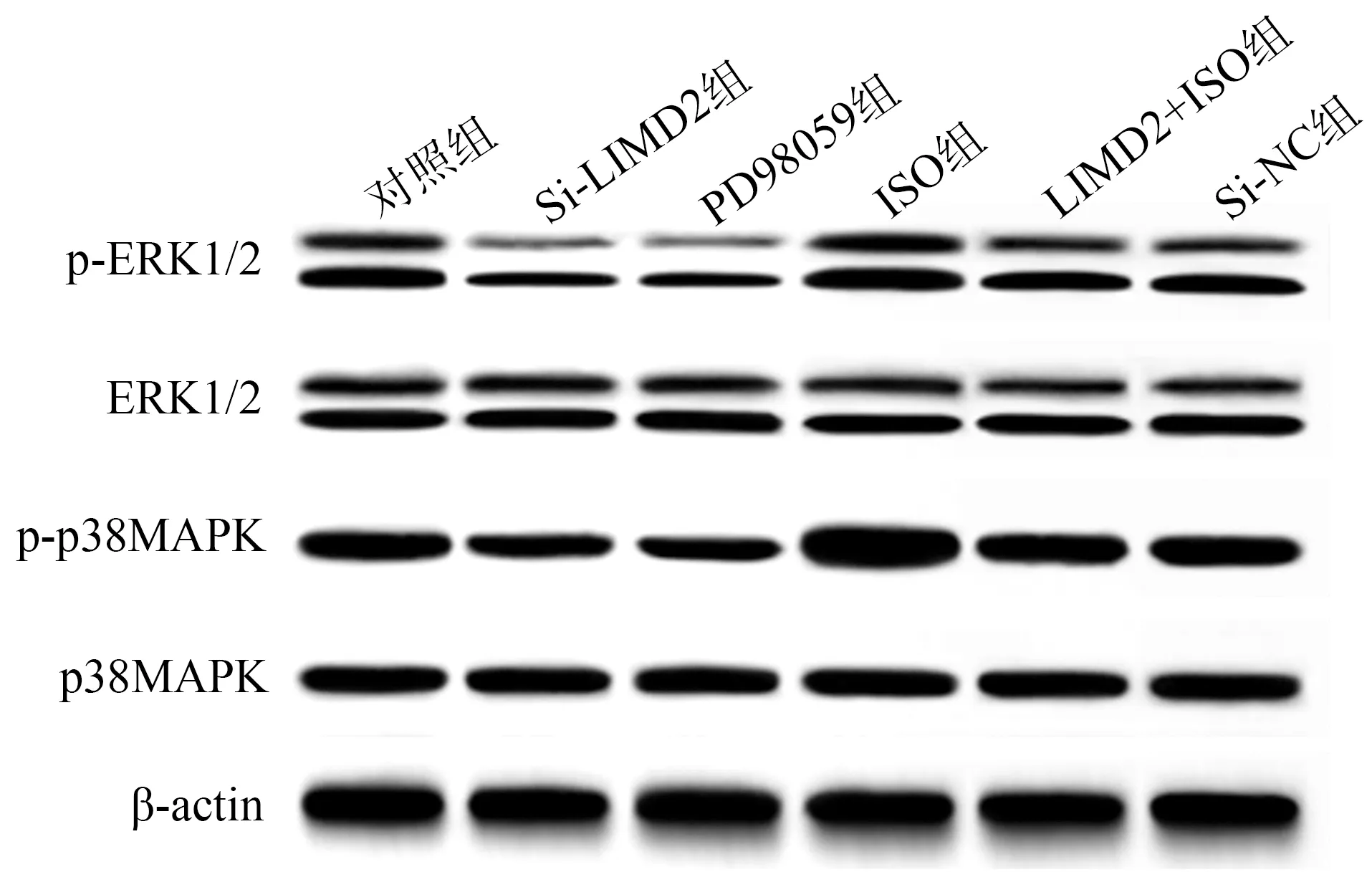
图5 各组EC9706细胞ERK/MAPK通路蛋白表达免疫印迹图
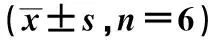
表4 各组EC9706细胞LIMD2 mRNA、蛋白及ERK/MAPK通路蛋白表达比较
2.4 各组EC9706细胞增殖活性
与对照组相比,Si-LIMD2组和PD98059组细胞增殖活性较低(P<0.05),ISO组细胞增殖活性较高(P<0.05)。与Si-LIMD2组比较,Si-LIMD2+ISO组细胞增殖活性较高(P<0.05),见表5。
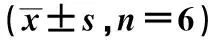
表5 各组EC9706细胞增殖活性比较
2.5 各组EC9706细胞周期及凋亡率
与对照组相比,Si-LIMD2组和PD98059组细胞G0/G1期比例较高,S期及G2/M期比例较低,凋亡率较高(P<0.05);ISO组细胞G0/G1期比例较低,S期及G2/M期比例较高,凋亡率较低(P<0.05);与Si-LIMD2组相比,Si-LIMD2+ISO组细胞G0/G1期比例较低,S期及G2/M期比例较高,凋亡率较低(P<0.05),见表6、图6。

表6 各组EC9706细胞周期及凋亡率比较
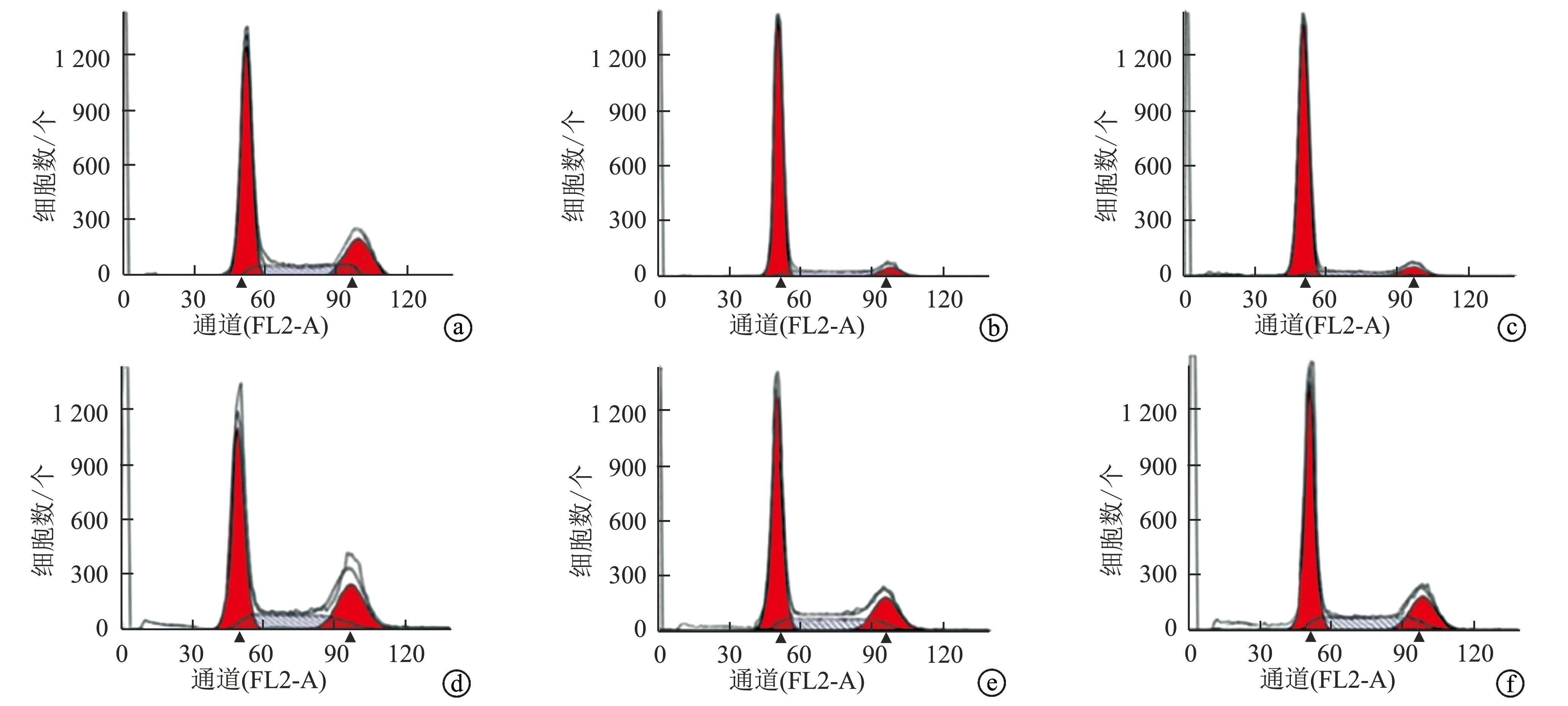
a:对照组;b:Si-LIMD2组;c:PD98059组;d:ISO组;e:Si-LIMD2+ISO组;f:Si-NC组图6 各组EC9706细胞流式周期图
2.6 各组EC9706细胞周期及凋亡相关蛋白表达
与对照组相比,Si-LIMD2组和PD98059组cyclin D1、CDK2蛋白表达较低,caspase-3蛋白表达较高(P<0.05),ISO组cyclin D1、CDK2蛋白表达较高,caspase-3蛋白表达较低(P<0.05);与Si-LIMD2组相比,Si-LIMD2+ISO组cyclin D1、CDK2蛋白表达较高,caspase-3蛋白表达较低(P<0.05),见表7、图7。
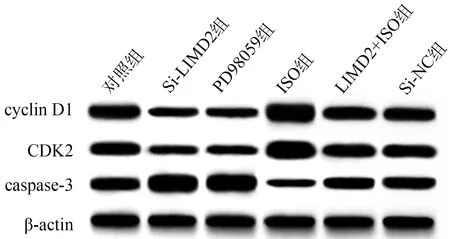
图7 各组EC9706细胞周期及凋亡相关蛋白表达免疫印迹图
表7 各组EC9706细胞周期及凋亡相关蛋白表达比较
2.7 各组EC9706细胞FAK、ILK、整合素β1蛋白表达
与对照组相比,Si-LIMD2组和PD98059组FAK、ILK、整合素β1蛋白表达较低(P<0.05),ISO组FAK、ILK、整合素β1蛋白表达较高(P<0.05);与Si-LIMD2组相比,Si-LIMD2+ISO组FAK、ILK、整合素β1蛋白表达较高(P<0.05),见图8、表8。
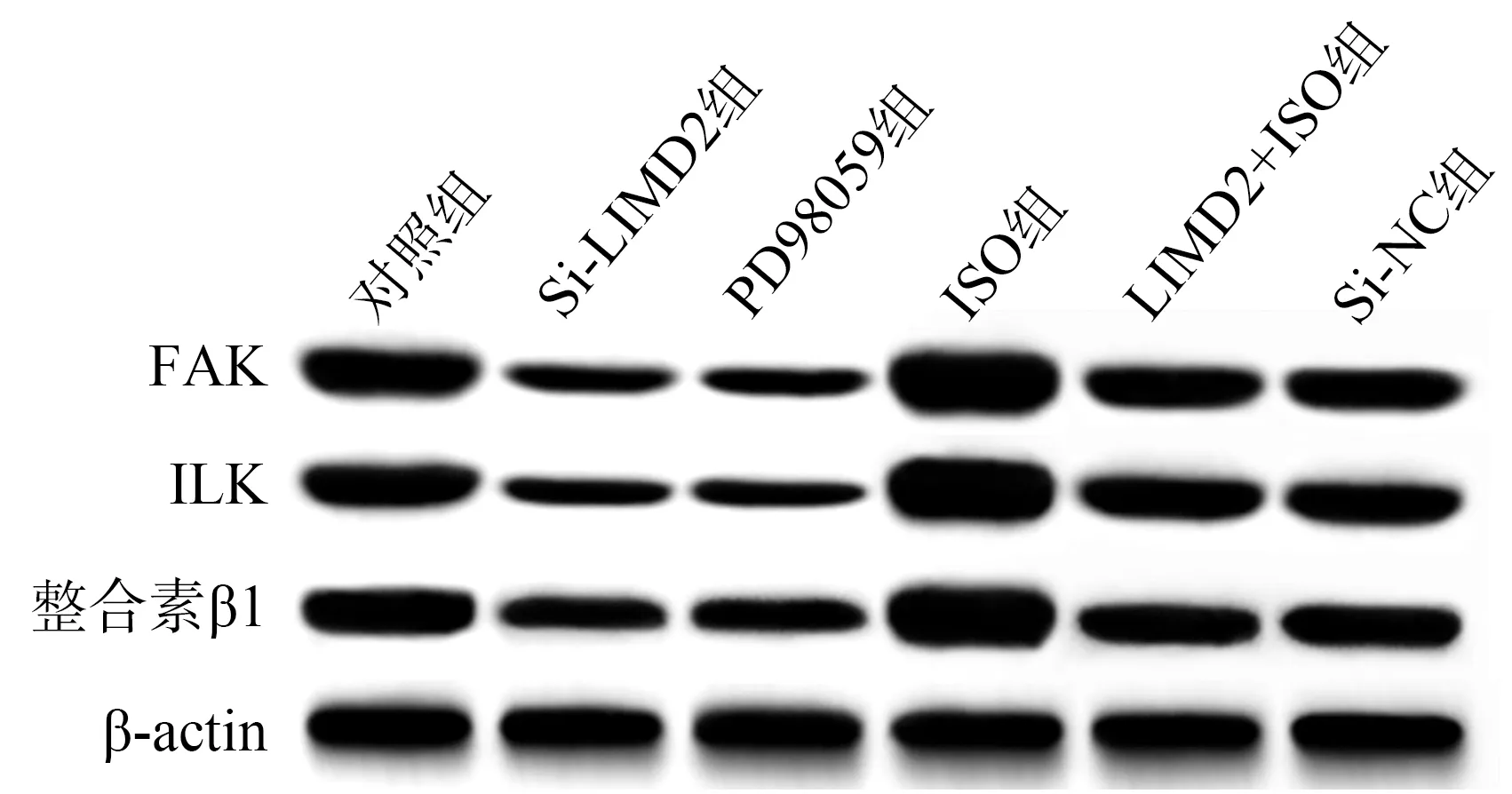
图8 各组EC9706细胞FAK、ILK、整合素β1蛋白表达免疫印迹图
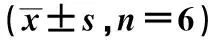
表8 各组EC9706细胞FAK、ILK、整合素β1蛋白表达比较
3 讨论
近年来研究发现,含LIMD的蛋白与人类多种肿瘤的生长及增殖密切相关,并逐渐受到肿瘤研究者的重视。Wang等[12]研究发现,LIMD家族的LIMD2可促进非小细胞肺癌细胞的增殖及侵袭进程。夏朝晖等[13]发现,LIMD2高表达与子宫内膜癌肿瘤分期及淋巴结转移浸润有关。LIMD2已在乳腺癌、膀胱癌、甲状腺癌、黑色素瘤等人类癌症中有较多研究,但LIMD2在食管癌中的作用尚未明确。本研究发现,LIMD2在食管癌组织及KYSE30、EC9706细胞中表达均较高,且在食管癌细胞中以EC9706细胞表达较高,提示LIMD2参与了食管癌的发生发展过程。本研究进一步沉默EC9706细胞中LIMD2表达后,发现细胞增殖活性降低,细胞周期阻滞于G0/G1期,细胞凋亡率增加,表明沉默LIMD2表达可显著抑制EC9706细胞增殖,并促进其凋亡,预示LIMD2可能成为治疗食管癌的潜在靶分子,但其具体调控机制还有待进一步探究。
据文献资料研究显示,LIMD2可在细胞质与细胞核之间穿梭,并组装蛋白,使原本无相互作用的蛋白产生级联作用,进而调控信号转导[14]。Pinheiro等[6]及Peng等[15]发现,LIMD2可直接与ILK结构域结合,促进ILK活化,引起细胞运动和侵袭性相关信号转导途径激活,参与癌细胞扩散过程。另外,ILK与整合素β1结合活化后,可促进整合素β1下游FAK/MAPK通路活化,从而调控细胞增殖、分化过程[16-17]。本研究发现,沉默EC9706细胞中LIMD2表达后,ILK、整合素β1、FAK蛋白及ERK/MAPK通路p-ERK1/2、p-p38MAPK蛋白表达亦减少,提示沉默LIMD2表达抑制EC9706细胞增殖,并促进其凋亡的作用可能与抑制ERK/MAPK通路有关。
MAPK与其通路中的重要分子ERK作用,将细胞外信号传递至细胞内,并调控细胞周期,将增殖信号传至细胞内,促进细胞周期相关蛋白cyclin D1及CDK2表达,进而增强癌细胞恶性增殖能力[18]。且ERK/MAPK通路已被证实是参与肿瘤细胞发生发展的重要通路[19]。本研究发现,ERK/MAPK通路p-ERK1/2、p-p38MAPK蛋白在食管癌组织中表达较高,用ISO激活EC9706细胞ERK/MAPK通路后,细胞增殖活性升高,G0/G1期比例较低,S期及G2/GM期比例较高,凋亡率较低,同时细胞周期蛋白cyclin D1及CDK2表达较高,凋亡相关蛋白caspase-3表达较低,反之用PD98059抑制EC9706细胞ERK/MAPK通路后,癌细胞显示出较低的增殖活性,且凋亡率升高,提示ERK/MAPK通路激活可能是促进食管癌恶性发展的诱因,这与以往文献研究结果一致[9-10]。本研究在沉默LIMD2表达的基础上用ISO激活ERK/MAPK通路,结果发现,沉默LIMD2表达抑制EC9706细胞增殖,并促进其凋亡的作用被逆转,证实LIMD2是通过调控ERK/MAPK通路参与食管癌的发生发展。
综上所述,沉默LIMD2表达可能通过抑制ERK/MAPK通路而抑制食管癌细胞增殖、促进其凋亡,这为阐明LIMD2参与食管癌发生发展的可能机制提供了一定理论依据。

