LINE-1甲基化水平与食管鳞状细胞癌免疫状态的关系
肖梅仙,赵金波,王 波,匡 黎 (.十堰市国药东风总医院肿瘤科,湖北 十堰 4400;.大连医科大学附属第二医院肿瘤科,辽宁 大连 6000;.十堰市郧阳区人民医院普外一科,湖北 十堰 44500)
食管癌是世界上最致命的恶性肿瘤之一[1],然而,与其他常见的肿瘤类型相比,近年来在食管癌治疗学方面的进展有限[2]。因此,迫切需要阐明食管癌的分子机制,以推动治疗策略的进一步发展,尤其是为分子靶向治疗和免疫治疗的进展提供理论支持。肿瘤微环境中的免疫细胞浸润、基因遗传学、表观遗传学等改变在调节肿瘤发生、进展和治疗中都起着关键作用[3]。有研究表明,肿瘤免疫逃逸与包括食管癌在内的各种癌症患者的临床预后较差有关[4]。因此,分析肿瘤特征与肿瘤微环境中免疫细胞浸润之间的关系有重要的临床意义。DNA低甲基化在基因组不稳定性中起着关键作用,而基因组不稳定性反过来又会导致肿瘤进展[5]。鉴于长散布核元件-1(long-interspersed nucleotide element-1,LINE-1)构成人类基因组的很大一部分(约17%)[6],其甲基化程度被认为是全基因组DNA甲基化的替代分子标志物。LINE-1低甲基化可导致食管癌进展或预后不佳,但其具体机制仍有待阐明。因此,我们推测LINE-1低甲基化可能与食管癌患者不良预后有关,本研究通过分析食管癌组织中LINE-1低甲基化水平与低免疫状态的关系,以阐述LINE-1甲基化作为评估食管癌患者预后分子标志物的潜力。
1 资料与方法
1.1 临床资料
十堰市国药东风总医院肿瘤科在2015~2020年共收集了107例经术后病理证实为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)的肿瘤组织样本,并进行存档、福尔马林固定及石蜡包埋,在获取样本前患者均未接受放射治疗、化学治疗、生物治疗、免疫治疗等抗肿瘤治疗。ESCC患者的临床病理参数从病历和病理报告中获得,其中男66例,女41例,中位年龄51.0岁。所有肿瘤分期均按美国联合癌症委员会/联合癌症中心(American Joint Cancer Committee/Union International Center Cancer,AJCC/UICC)分类指南[8]确定。ESCC标本分级和组织病理学分型按照世界卫生组织的相关标准进行。本研究获得了十堰市国药东风总医院医学伦理委员会的审查批准(2015022),并严格按照《赫尔辛基宣言》的道德原则进行。在将临床资料用作研究前,已取得患者或家属的知情同意。
1.2 亚硫酸氢盐焦磷酸测序法检测ESCC组织中LINE-1甲基化水平
从石蜡包埋组织蜡块中取100 mg肿瘤组织,放入含有1 mL二甲苯的微量离心管中洗涤,再用乙醇溶液洗涤2次。用QIAamp DNA Mini试剂盒(德国Qiagen)提取组织基因组DNA(genomic DNA,gDNA)。利用EpiTect Bisulfite试剂盒(德国Qiagen)对600 ng gDNA样本进行亚硫酸氢盐修饰,反应体积为40 μL。将样品管置于热循环仪(德国Eppendorf)中,95 ℃ 5 min,60 ℃ 25 min,95 ℃ 5 min,60 ℃ 85 min,95 ℃ 5 min,60 ℃ 175 min,20 ℃过夜,将修饰后的DNA样品于-20 ℃保存。使用焦磷酸测序法对LINE-1基因进行甲基化分析,反应体积为40 μL(20 ng gDNA,1 μL PCR预混合液,1 μL引物),进行聚合酶链式反应。反应条件:95 ℃预变性10 min,95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸5 min。用2%琼脂糖凝胶电泳分离PCR产物,并用溴化乙锭染色法进行可视化。取18 μL PCR产物,用链霉亲和素磁珠(瑞典Amersham)制备单链DNA模板。采用Pyro Gold试剂盒(德国Qiagen)和PyroMark ID DNA分析系统进行测序。根据测序结果在4个甲基化位点的甲基化水平平均值计算甲基化率(图1、表1)。进一步分析ESCC组织中LINE-1甲基化水平与患者临床病理特征的关系。
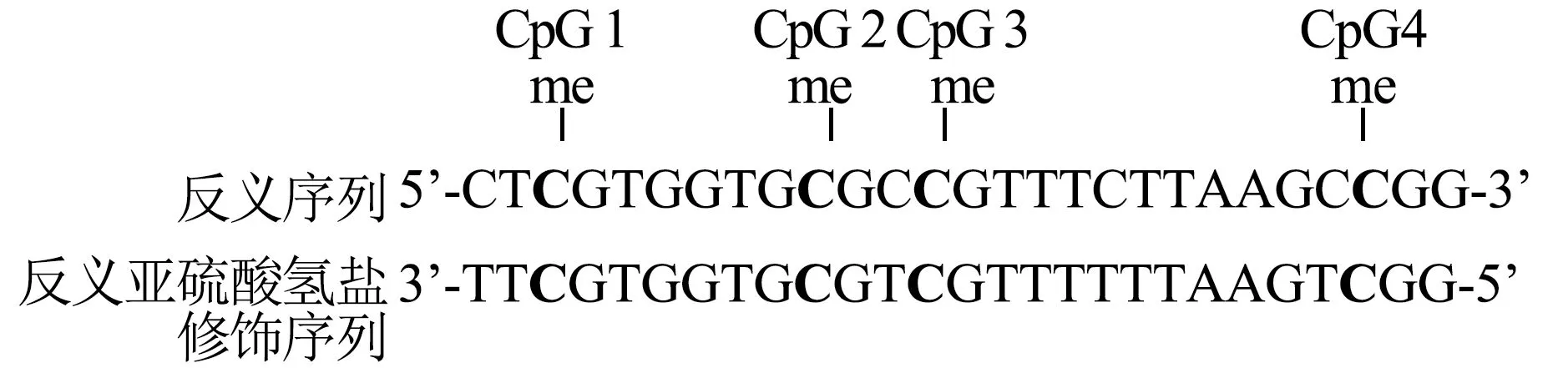
图1 亚硫酸氢盐修饰DNA中LINE-1基因的4个CpG位点

表1 LINE-1基因引物序列
1.3 HE染色法检测组织学淋巴细胞反应
取石蜡包埋组织蜡块,连续切片后进行HE染色,记录组织学淋巴细胞反应模式(缺失、低反应、中反应、高反应),包括克罗恩样淋巴反应、瘤周淋巴细胞反应、间质淋巴细胞反应、肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TILs)反应。
1.4 免疫组织化学染色法分析肿瘤细胞分子标志物
取切片脱蜡复水后,滴加pH 6.0抗原修复液(柠檬酸钠)121 ℃高压15 min进行抗原修复。分别滴加分化簇274(differentiation cluster,CD274)初级抗体(1∶200稀释)、吲哚胺-2,3-双加氧酶1(indoleamine-2,3-dioxygenase 1,IDO1)抗体(1∶50稀释)、CD8(1∶100稀释)、FOXP3抗体(1∶200稀释)4 ℃孵育过夜;洗去未结合抗体后,在室温条件下滴加抗Envison+/HRP结合的二级抗体静置30 min,苏木素反染。使用BZX700数字显微镜和Keyence细胞计数软件,在肿瘤侵袭边缘计数CD8+T细胞或FOXP3+T细胞。
1.5 统计学处理

2 结果
2.1 ESCC组织中LINE-1甲基化水平
ESCC组织中LINE-1基因4个甲基化位点的甲基化率分别为(61.76±18.70)%、(49.68±12.07)%、(67.22±14.63)%、(78.40±10.77)%,平均甲基化率为(64.27±9.72)%,中位值为63.51%(43.81%~85.10%)。
2.2 ESCC组织中LINE-1甲基化水平与患者临床病理特征的关系
ESCC组织中LINE-1甲基化水平与患者年龄、淋巴结转移、TNM分期有关:年龄≥50岁的患者ESCC组织中LINE-1基因甲基化率低于年龄<50岁的患者;淋巴结转移或TNM分期Ⅲ期的患者ESCC组织中LINE-1基因甲基化率低于无淋巴结转移或TNM分期Ⅰ~Ⅱ期的患者,差异均有统计学意义(P<0.05)。ESCC组织中LINE-1甲基化水平与患者性别、吸烟史、饮酒史、合并基础疾病、肿瘤位置、肿瘤直径、分化程度无关(P>0.05),见表2。
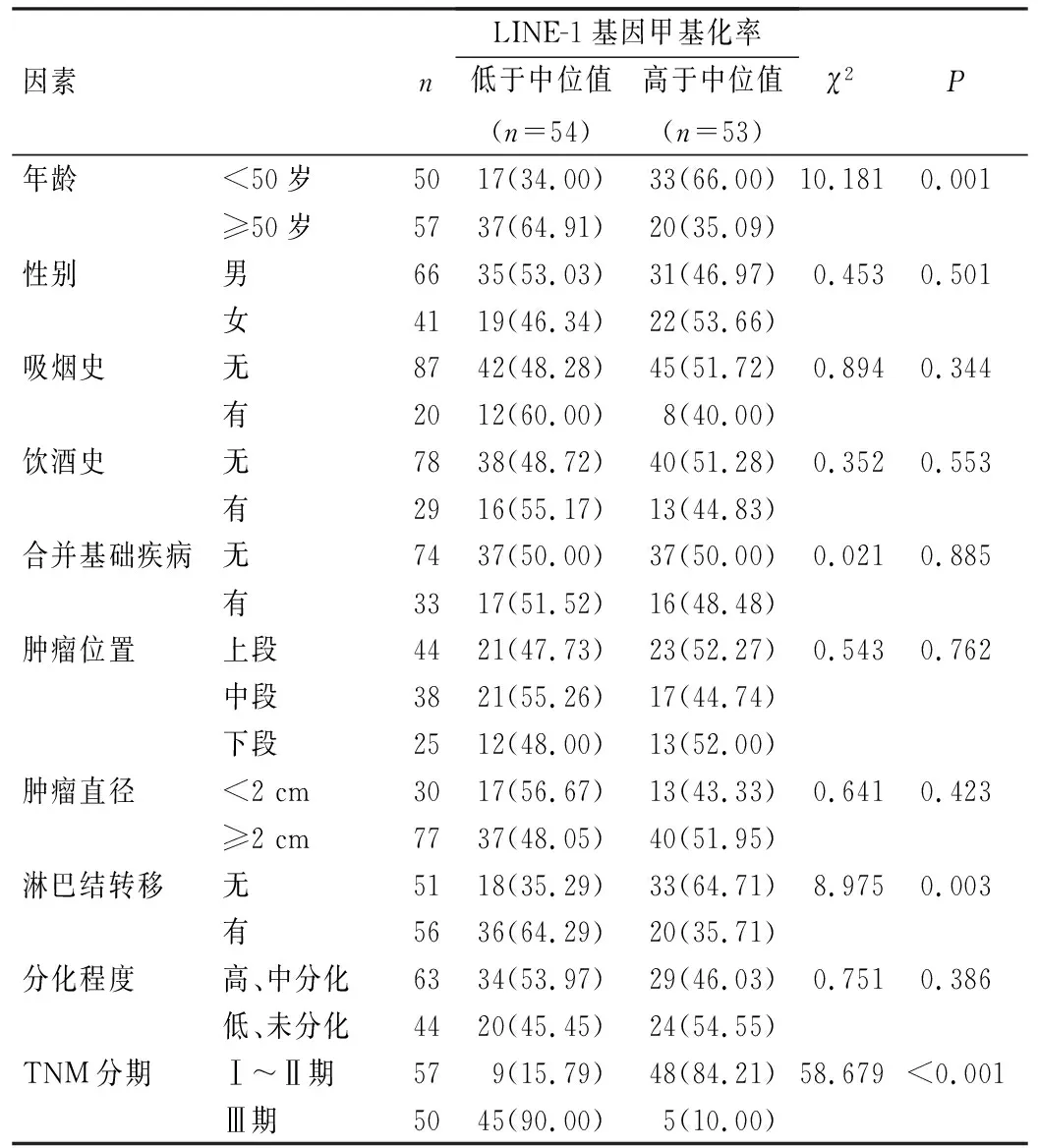
表2 ESCC组织中LINE-1甲基化水平与患者临床病理特征的关系[例(%)]
2.3 ESCC组织免疫状态
免疫组化结果显示,46例患者CD274表达阳性,41例IDO1表达阳性,CD8+T细胞浸润密度为218(45~576)个/视野,FOXP3+T细胞浸润密度为344(161~1025)个/视野(图2)。
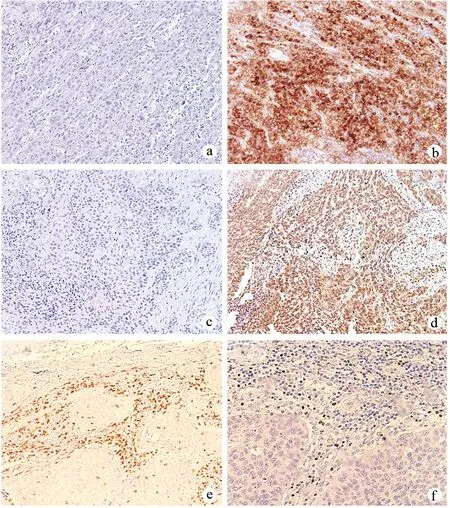
a:肿瘤组织CD274阴性表达;b:肿瘤组织CD274阳性表达;c:肿瘤组织IDO1阴性表达;d:肿瘤组织IDO1阳性表达;e:CD8+T细胞浸润;f:FOXP3+T细胞浸润图2 肿瘤细胞分子标志物和T细胞的免疫组织化学结果(×100)
2.4 ESCC组织中LINE-1甲基化水平与宿主免疫状态的关系
ESCC组织中LINE-1甲基化水平与瘤周淋巴细胞反应有关:缺失/低瘤周淋巴细胞反应的肿瘤组织中LINE-1基因甲基化率低于中、高瘤周淋巴细胞反应的肿瘤组织(P<0.05);但ESCC组织中LINE-1甲基化水平与CD274表达、IDO1表达、CD8+T细胞密度、FOXP3+T细胞密度、克罗恩样淋巴样反应、间质淋巴细胞反应、TILs反应无关(P>0.05),见表3。
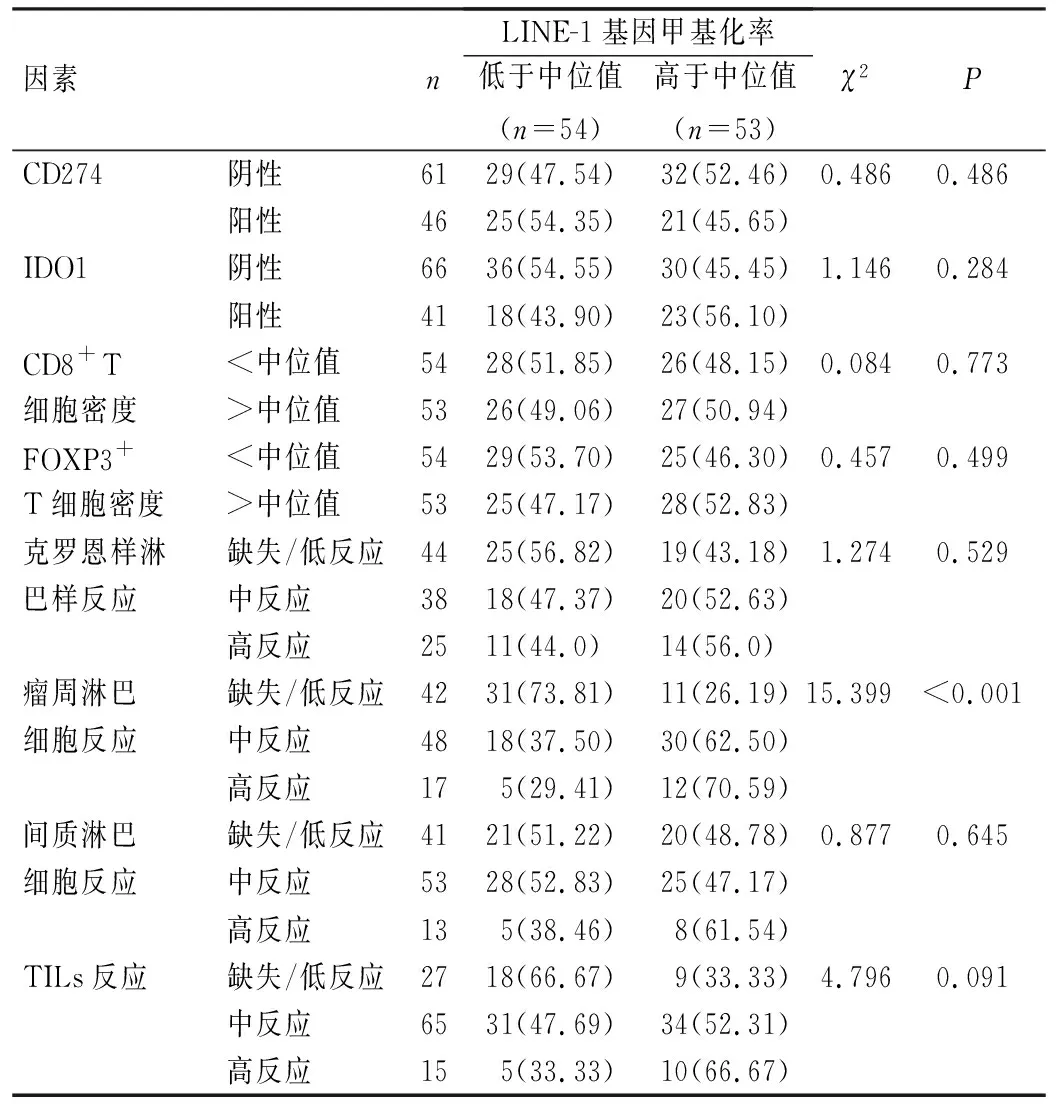
表3 ESCC组织中LINE-1甲基化水平与宿主免疫状态的关系[例(%)]
2.5 多因素Logistic回归分析ESCC组织中LINE-1甲基化水平与瘤周淋巴细胞反应的关系
根据ESCC组织LINE-1甲基化水平,将其由低到高分为Q1(<57.41%)、Q2(57.41%~63.51%)、Q3(>63.51%~71.83%)、Q4(>71.83%)。以是否发生瘤周淋巴细胞反应(赋值:缺失/低反应=0,中反应/高反应=1)作为因变量,经单因素和多因素Logistic回归模型分析,结果显示,ESCC组织中LINE-1低甲基化水平是缺失/低瘤周淋巴细胞反应的独立危险因素(Ptrend<0.001),见表4。
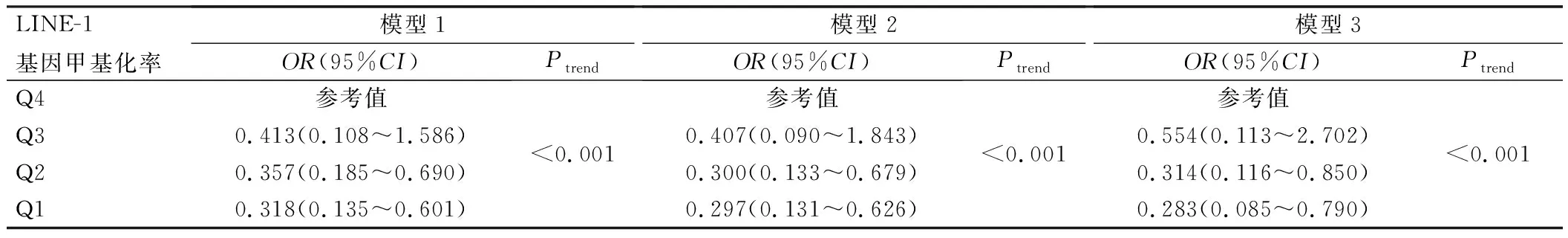
表4 单因素和多因素Logistic回归分析ESCC组织中LINE-1甲基化水平与瘤周淋巴细胞反应的关系
模型1:未校正其他临床因素;模型2:校正了性别(男vs.女)、年龄、吸烟史(无vs.有)、饮酒史(无vs.有)、合并基础疾病(无vs.有)、肿瘤位置(上段vs.中段vs.下段)、肿瘤直径(<2 cmvs.≥2 cm)、分化程度(高、中分化vs.低、未分化);模型3:在模型2的基础上进一步校正了淋巴结转移(无vs.有)和TNM分期(Ⅰ~Ⅱ期vs.Ⅲ期)
3 讨论
我国是食管癌的高发地区之一,90%以上的食管癌患者为ESCC[9]。最近,多种免疫检查点抑制剂,如细胞程序性死亡蛋白1(programmed cell death protein 1,PD-1)单抗等,已用于治疗一线化疗失败的晚期ESCC患者[10]。然而,与化疗相比,免疫检查点抑制剂在提高患者总生存率方面并不理想,这可能与患者免疫状态有关。食管癌是基因突变率最高的恶性肿瘤类型之一,具有遗传学和表观遗传学改变,这些改变可影响肿瘤微环境。鉴于肿瘤部位免疫细胞的浸润强度很可能是由肿瘤细胞复杂的网络和肿瘤微环境中宿主的免疫状态决定的,利用跨学科综合分析对肿瘤分子特征和免疫状态之间的关系进行更深入的了解,将有助于开发新的免疫调节治疗策略。本研究结果显示,ESCC组织中LINE-1低甲基化水平与瘤周淋巴细胞反应缺失或不足有关,这可能是影响ESCC抗肿瘤免疫状态的独立危险因素。
表观遗传学主要依赖于DNA甲基化和翻译后组蛋白修饰来调节基因功能。DNA启动子区CpG岛的甲基化状态等表观遗传学的改变被认为是癌症早期常见事件,在肿瘤进展中发挥重要作用[11]。LINE-1是进化上一个保守的超基因家族,在全基因组中占17%,LINE-1在其2个开放阅读框ORF1p和ORF2p上起反转录转座子的作用,并可引起体细胞逆转录转座、转录组效应和DNA损伤[12]。目前已发现多种癌症类型存在LINE-1基因表观遗传学改变,其低甲基化水平与肝癌[13]、胃癌[14]、结肠癌[15]等发生风险以及预后不良有关。LNE-1甲基化是全局DNA甲基化水平的有效指标[16]。本研究通过亚硫酸氢盐焦磷酸测序法对石蜡包埋的ESCC组织标本进行LINE-1甲基化检测,结果显示ESCC组织中LINE-1甲基化水平与患者年龄、淋巴结转移、TNM分期有关:年龄≥50岁、发生淋巴结转移、TNM分期Ⅲ期的患者ESCC组织中LINE-1基因甲基化率普遍较低,说明除了作为全局DNA甲基化的有效分子标志物之外,LINE-1甲基化状态本身可能也具有一定的生物学效应,因为逆转录转座子(如LINE-1元件)可以提供替代启动子,并促进非编码RNA的表达,进而调节下游基因的转录功能[17]。由LINE-1低甲基化激活的反转录转座子可能在整个基因组中转座,导致基因中断和染色体不稳定。除此以外,LINE-1也被广泛用作老化和年龄相关疾病中全局DNA甲基化的替代分子标志物,如与年龄相关的黄斑变性[18],这也解释了本研究中年龄≥50岁的患者ESCC组织中LINE-1基因甲基化率较年轻患者降低。
越来越多的证据表明,肿瘤组织中的免疫细胞水平与癌症患者的临床疗效存在显著相关性。例如Baba等[19]证实,肿瘤浸润边缘的淋巴细胞密度可以预测食管癌对免疫检查点抑制剂的反应。Haruki等[20]通过对1 465例结直肠癌患者的克罗恩样淋巴反应、瘤周淋巴细胞反应、间质淋巴细胞反应、TILs反应与患者预后的关系进行前瞻性研究,结果显示,与缺失/低瘤周淋巴细胞反应患者相比,中、高瘤周淋巴细胞反应患者预后不良的风险分别为0.55(95%CI:0.42~0.71)和0.20(95%CI:0.12~0.35),证实组织学淋巴细胞反应是一种独立的大肠癌预后分子标志物。然而食管癌的发生涉及多种致癌过程,受到不同遗传因素、表观遗传学改变、饮食、微生物群及宿主免疫等的综合影响。既往有研究证实,LINE-1低甲基化与染色体不稳定性以及CDK6、TP53等基因的大量突变有关[21-22]。CDK6基因扩增不仅可以促进细胞生长,还可以通过抑制细胞内双链RNA水平来抑制肿瘤抗原的递呈效应。此外,TP53基因突变作为实体肿瘤中代表免疫亚型的候选基因之一,早已引起了人们的广泛关注。鉴于这些肿瘤相关基因改变对宿主免疫的潜在修饰,可以合理地推断,肿瘤细胞的全局DNA低甲基化可通过这些改变影响宿主的免疫状态。本研究结果显示,ESCC组织中LINE-1甲基化水平与瘤周淋巴细胞反应有关,缺失/低瘤周淋巴细胞反应的肿瘤组织中LINE-1基因甲基化率低于中、高瘤周淋巴细胞反应的肿瘤组织,这也证实了上述推断的可靠性。
综上,ESCC组织中LINE-1甲基化水平与患者临床病理、分子特征有关,在控制多种潜在的混杂因素后,LINE-1低甲基化水平是ESCC组织缺失/低瘤周淋巴细胞反应的独立危险因素,这为进一步研究LINE-1低甲基化和宿主免疫在食管癌发生发展中的潜在相互作用提供了证据。

