镧系金属-苯甲羟肟酸有机配合物对萤石和方解石的捕收性能研究
李颖颖,张志祥,雷世梅,程雨荷,黄海威,徐诗佟,王柏清,张锋
江西理工大学 资源与环境工程学院,江西 赣州 341000
1 引言
萤石是工业氟的最主要来源,用于制备氟及其各种化合物。我国萤石矿床按矿石共生组合关系可分为“单一型”萤石矿床与“共伴生型”萤石矿床[1-2]。其中“单一型”萤石矿床储量要远低于“共伴生型”萤石矿床储量。但受选冶和加工技术条件及成本等因素的制约,“共伴生型”萤石资源利用率更低,“单一型”萤石矿床资源开发利用更多[1,3-5]。“单一型”矿床多分布在内蒙古、江西、福建、河北等地[1,3-4],“共伴生”型萤石主要分布于湖南、云南、江西等地[5]。这些地区存在大量的碳酸盐型萤石资源,但大部分矿石含氟化钙较低达不到冶金级的品位要求,需要经过选矿处理后才能进一步用于冶炼。这类萤石矿的选矿过程即是萤石与其他硅酸盐、铝硅酸盐、碳酸盐等脉石矿物的分离过程。由于萤石与白云石、方解石、长石、石英等矿物共生关系密切且密度接近,采用重选法难以实现萤石与它们的有效分离。磁选法通常在脱除萤石中的含铁石英时能够起到一定作用,但对于不含铁的石英或其他无磁性脉石矿物起不到分离作用。目前浮选法是萤石选矿中使用最为广泛的选别工艺。
脂肪酸及其衍生物作为萤石的常规捕收剂,主要通过其羧酸根与萤石表面的钙离子质点结合,从而起到吸附、捕收作用。由于萤石与方解石一样表面都存在钙质点,使用油酸作为萤石与方解石的捕收剂时,油酸与萤石及方解石表面的钙质点都反应生成油酸钙,导致捕收剂选择性差、分离效果不佳。杨开陆[6]使用一种含有羧酸根的捕收剂Y-2,配合KD抑制剂在酸性条件下成功实现了萤石与白云石的分离。由于Y-2 捕收剂分子结构中含有羧基基团(-COO-)等较多电负性基团,而萤石表面荷正电且零电点高于白云石,因此捕收剂分子在萤石表面的化学吸附作用要大于白云石。陶黎明等[7]利用月桂酰肌氨酸钠(SNLS)也能实现萤石与方解石的浮选分离,其中SNLS在Ca离子活性更强的萤石表面吸附作用更强,主要因为萤石常见暴露(111)面的Ca原子密度要高于方解石,而SNLS带负电荷。这是能够实现萤石与方解石分离的关键。
除了利用捕收剂自身对不同矿物表面吸附作用的差异选择性吸附矿物实现分离之外,浮选工艺的另一种经典处理手段是通过活化剂选择性吸附于矿物表面增大目的矿物与脉石矿物表面性质的差异。金属离子是浮选中广泛应用的活化剂,而铅离子则是氧化矿浮选中最常用到的活化剂。金属离子的活化作用通常被认为是在目的矿物表面选择性吸附,给捕收剂提供了吸附位点。但有研究发现[8],金属铅与苯甲羟肟酸(BHA) 形成的金属有机配合物在浮选过程中能够提高BHA在矿物表面的吸附效率,在捕收性能和选择性等方面体现出一定的优势。可见金属离子优先与捕收剂离子形成配合物同样能够提高捕收剂的选择性。这给寻找或设计在萤石表面选择性吸附的捕收剂提供了思路。
萤石与氟碳铈矿共伴生关系密切,例如我国白云鄂博稀土矿中部分稀土嵌布于萤石和铁矿物中,嵌布粒度细[9],铈离子常以类质同象的形式取代萤石中的钙质点,同时铈离子被证明对萤石的浮选起到活化作用[10],王鹏等人[11-12]用辛基羟肟酸和油酸分别浮选氟碳铈矿与萤石,证明了这两类捕收剂能够有效与铈离子及其衍生物发生吸附起到捕收作用。铈离子对萤石的活化作用主要是由于镧系金属离子与氟离子较强的亲和性,能够生成酸碱条件下均难溶的沉淀物;同时,镧系金属又可以与多种有机物反应生成配合物,这解释了油酸、羟肟酸等有机表面活性物能够作为氟碳铈矿及被铈离子活化后萤石捕收剂的原因。因此,将镧系金属离子与捕收剂配合生成镧系金属配合物则有可能成为高选择性的萤石捕收剂。
本研究以萤石、方解石与镧系金属离子为对象,采用量子化学计算模拟的方法,围绕筛选可作为萤石高效选择性捕收剂的镧配合物为目的开展工作,研究模拟镧系金属离子与矿物解理面吸附反应过程,通过纯矿物试验验证镧系金属离子配合物作为萤石浮选捕收剂的有效性。
2 试验材料与方法
2.1 试验材料
试验所用的萤石及方解石纯矿物均采购自宝石市场,结晶形态较好。经人工挑选、破碎、陶瓷球磨后,筛得0.020~0.074 mm粒级,再经超纯水清洗真空干燥后装袋保存备用。萤石、方解石的XRD衍射图分别见图1、图2。
由图1、图2可知,萤石和方解石的2θ角特征衍射峰显著,几乎不含有其他的杂质矿物,满足纯矿物的要求。经化学分析,萤石纯矿物CaF2的含量为99.02%;方解石纯矿物CaCO3的含量为98.98%。
试验中使用的捕收剂苯甲羟肟酸为阿拉丁公司生产,六水氯化铈、硝酸镧、六水氯化钇和六水氯化铕为麦克林公司生产,pH调节剂氢氧化钠为天津永大公司生产,以上药剂均为分析纯, 除此之外,试验中使用的水均为超纯水,由默克Milli-Q Reference超纯水机制得。
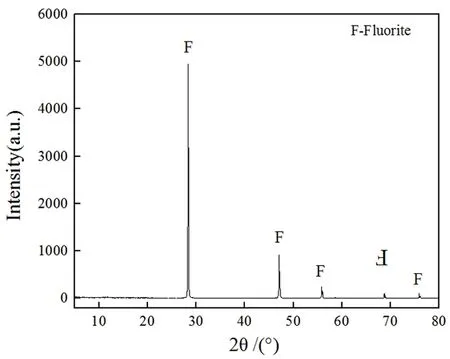
图1 萤石纯矿物XRD衍射分析结果
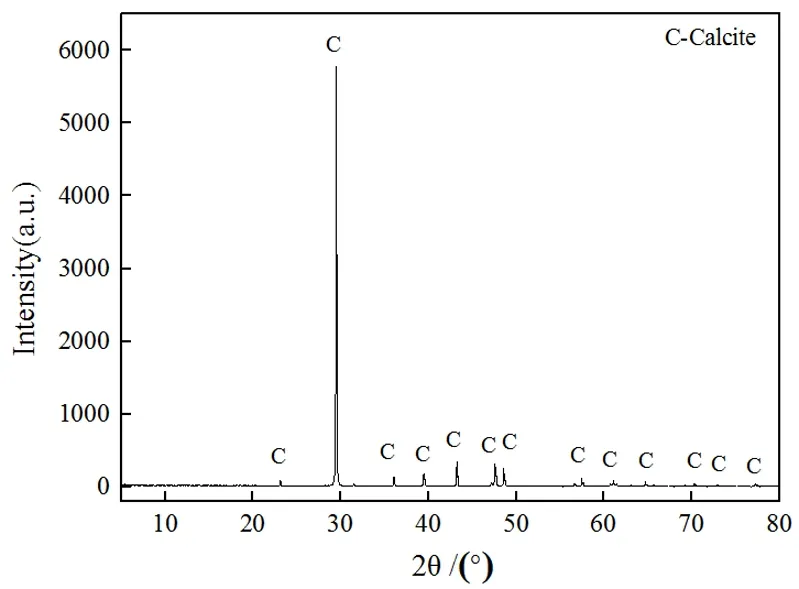
图2 方解石纯矿物XRD衍射分析结果
2.2 试验方法
2.2.1 浮选试验
纯矿物的浮选试验在XFGⅡ5实验室挂槽浮选机上进行。每次称取2 g纯矿物矿样放入小烧杯中,加入适量超纯水后经超声波震荡5 min清洗掉表面悬浮物,再倒入40 mL浮选挂槽内进行浮选。人工混合矿取萤石方解石质量配比为11,共2 g进行浮选。浮选过程采用手工刮泡,完成后产品经过滤、干燥、称重,计算回收率。浮选试验流程见图3。

图3 单矿物浮选试验流程
2.2.2 量子化学计算模拟
量子化学计算在Material Studios软件的Castep模块中完成。首先构建萤石、方解石和药剂BHA的分子模型,并切割出晶体表面;其次设置计算参数:采用泛函广义梯度近似GGA-PW91,赝势为超软赝势Ultrasoft,设置截断能为630 eV,优化算法选取BFGS,集合收敛条件确定为总能量1.0×10-5eV/atm;最后进行几何优化,再进一步完成量子化学计算。
3 结果与讨论
3.1 纯矿物浮选试验
3.1.1 金属离子用量对萤石和方解石浮选的影响
当金属离子作为活化剂使用时,通常在捕收剂之前加入。首先考察了四种金属离子用量对BHA浮选萤石及方解石的影响,试验流程见图3,试验结果分别见图4、图5。
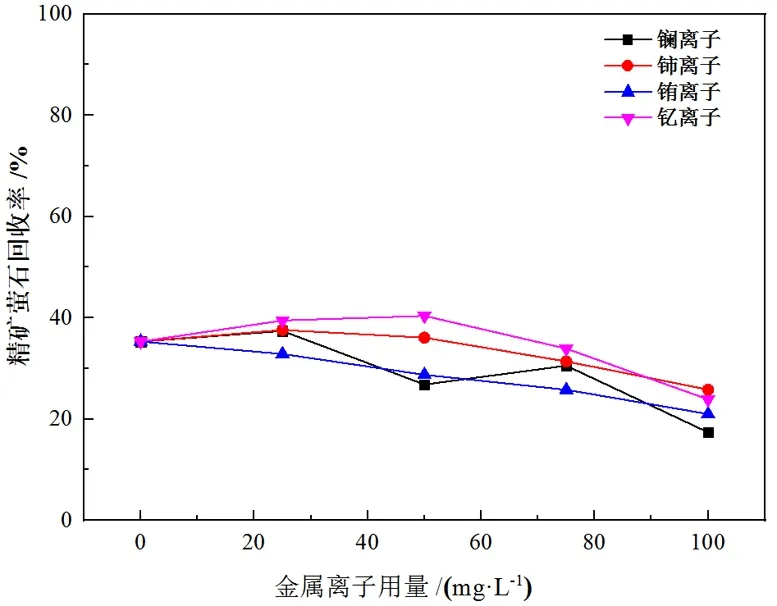
图4 金属离子用量对萤石浮选的影响
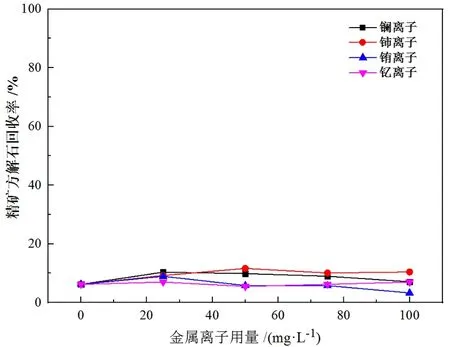
图5 金属离子用量对方解石浮选的影响
由图4的结果可知,镧、铈、钇离子在用量较低时(小于50 mg/L)能对萤石的上浮起到一定的促进作用,但是随着用量增大,反而会出现抑制作用,推测可能是由于过量的金属离子会消耗矿浆中的BHA,导致浮选效果反而恶化。图5的结果显示,低用量(小于50 mg/L)四种金属离子的加入对方解石的浮选起到略微的活化作用,但在各种用量条件下仍然无法显著提高方解石回收率。由此可以判断,低用量金属离子的加入可能有利于萤石的浮选。
3.1.2 不同配比金属离子配合物对萤石及方解石可浮性的影响
金属离子与BHA可生成配合物,且不同配比金属离子与BHA的配合物对萤石及方解石的可浮性也存在差异,因此金属离子与BHA分别按摩尔比14、12配比合成配合物再考察其对萤石及方解石可浮性的影响,试验流程见图6,试验结果见图7、图8。

图6 Flotation test flow of fluorite or calcite with metal ion complexes

图7 不同配比金属配合物对萤石可浮性影响
图7结果表明,将金属离子与BHA组成配合物后对萤石的可浮性有一定的促进作用。对比图4的结果可知,当金属离子与BHA摩尔为12时(此时相当于金属离子用量为50 mg/L),金属配合物浮选萤石的回收率得到了显著的提高,特别是将Ce、La离子与BHA配合后萤石回收率可达60%以上。图8的结果则显示,将金属离子与BHA组成配合物时即使在金属离子相对较高的12配比时也基本不浮方解石。特别是对比图5的结果可以看到,配合物相对于将金属离子作为活化剂使用对方解石的回收率更低。由此可知,配合物对萤石的选择性应该要高于将金属离子作为活化剂使用。

图8 不同配比金属配合物对方解石可浮性影响
3.1.3 金属离子配合物捕收剂的人工混合矿浮选
由前面试验结果可知,能够作为合成配合物的最佳金属离子为Ce及La离子。因此本节试验采用Ce或La离子与BHA摩尔为12的配合物来浮选萤石与方解石摩尔为11的人工混合矿,同时作为对比还进行了单独使用BHA浮选人工混合矿的试验,试验流程参照图6的流程,结果见表1。

表1 金属离子配合物/BHA浮选人工混合矿试验结果 /%
根据表5的结果可知,虽然前期单矿物的浮选试验显示单独使用BHA对萤石有一定的选择性,但人工混合矿的结果则与之相悖。当使用12摩尔的金属配合物时,铈配合物浮选精矿产品中萤石的回收率可达到74%以上,萤石品位接近80%,萤石的富集比非常高,这说明该配合物能够选择性地从方解石中分选出萤石。而镧配合物浮选精矿产品萤石品位更高,但回收率偏低,对萤石的富集效果略低于铈配合物。因此,两种配合物都显示出比单一使用BHA对萤石更高的选择性。
3.2 量子化学计算结果
为了解释BHA及其镧系金属离子配合物在萤石及方解石表面的吸附作用情况,对四种金属离子分别与萤石、方解石及BHA吸附情况进行了量子化学计算模拟。
3.2.1 萤石(111)面与方解石(104)面建模
萤石的(111)面[13-14]与方解石的(104)面[15]是它们的完全解理面,在晶面破碎解离过程中相对最容易形成,因此也是浮选过程的主要反应面。在Material Studios软件中通过Castep模块先建立萤石与方解石的原胞模型,再经优化切面后得到萤石的(111)slab模型以及方解石的(104)slab模型,再将模型弛豫后得到的最终表面slab模型见图9。

图9 萤石(111)面与方解石(104)面slab模型
3.2.2 萤石(111)面、方解石(104)面吸附镧系金属离子的情况
分别利用计算模拟了四种金属离子(镧La、铈Ce、铕Eu、钇Y)在萤石(111)面及方解石(104)吸附的情况,吸附前后变化见图10、图11。

图10 四种金属离子在萤石表面吸附情况模拟
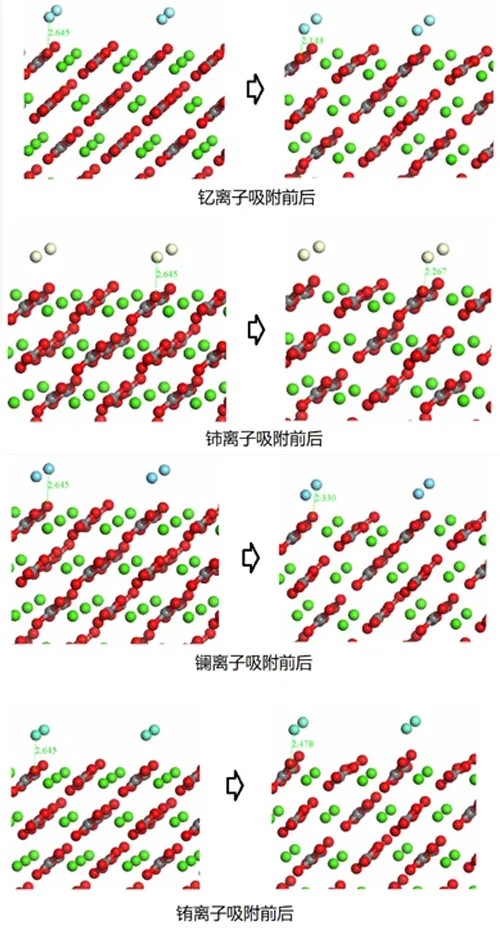
图11 四种金属离子在方解石表面吸附情况模拟
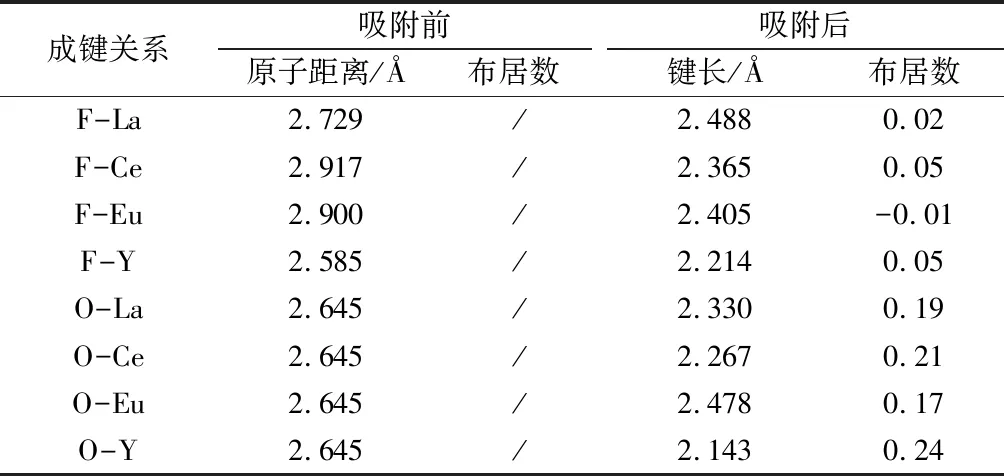
表2 吸附前后原子键长及布居数变化情况
由图10、图11结果可知,四种金属离子在萤石(111)面及方解石(104)面均有一定程度的吸附。结合表2数据可以看出,钇离子及铈离子在萤石表面的吸附效果更强,它们与F原子的成键键长最短,布居数最大,说明成键作用最强,铕离子的成键作用较弱,以反键形式成键。而四种离子在方解石表面均与氧原子发生吸附,成键作用较长,根据布居数来看成键方式均为较强的共价键,成键强度从大到小依次为Y>Ce>La>Eu。由此可知,四种金属离子在方解石表面的吸附作用要远大于在萤石表面的吸附作用。
3.2.3 镧系金属离子与BHA吸附作用情况
由于仅分析金属离子在萤石和方解石表面的吸附作用强弱并不能直接得出是否有利于BHA吸附的结论,因此需要进一步讨论金属离子与BHA的作用情况。分别利用计算模拟了四种金属离子分别与BHA作用的情况,计算使用的模型见图12,吸附前后的一些计算参考量变化结果见表3。
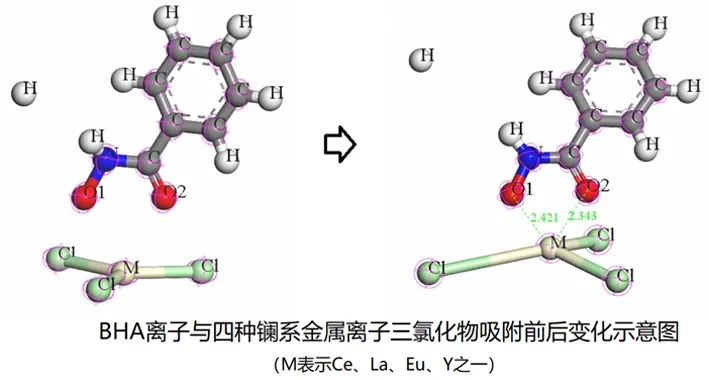
图12 四种金属离子分别与BHA作用的模型

表3 吸附前后原子键长、布居数及吸附能变化情况
表3结果表明,四种金属离子都能够与BHA离子形成较为稳定的化合物,在真空环境下由于缺少水分子的作用,它们都以共价键的形式成键。但值得注意的是,单分子的CeCl3与BHA成键后的吸附能(结合能)要显著小于其他三种(绝对值大小依次为Ce>La>Y>Eu),且Ce-O的键长反而要大于其他三种金属离子的键长。在溶液环境中,更强的结合能以及更远的成键距离意味着铈离子更容易与BHA形成配合物,同时它们形成的配合物在与目的矿物表面再吸附时,自身也更不易由于断键解离而失去捕收作用。结合3.2.2计算结果可知,四种金属离子与BHA、萤石、方解石之间吸附作用强弱关系依次为BHA>方解石>萤石。金属离子与BHA和方解石具有接近的吸附作用,这可能导致方解石表面与BHA竞争吸附金属离子,从而使得方解石在吸附金属离子后难以与捕收剂吸附而上浮,这也能够解释单矿物试验方解石在加入金属离子后回收率低的现象。而由于金属离子与萤石的作用强度要小于与BHA作用,因此BHA形成金属配合物后能够进一步与萤石发生吸附使其上浮,同时铈在四种稀土离子中显示出对萤石的亲和性最佳,从而有可能在浮选过程中体现出一定的选择性。
4 结论
(1)纯矿物浮选结果显示,铈、镧离子的使用能够对BHA浮选萤石起到促进作用;将铈、镧离子与BHA组合成配合物之后浮选萤石的回收率能进一步得到提高。人工混合矿浮选试验结果表明,单独使用BHA浮选无法实现萤石与方解石的有效分离,浮选精矿产品产率较低,精矿中萤石与方解石的回收率之比接近11;而使用金属离子与BHA摩尔为12的Ce-BHA配合物捕收剂对混合矿中萤石的选择性较好,获得精矿产品中CaF2品位78.92%、回收率74.77%,CaCO3品位11.08%、回收率24.23%。与单独使用BHA作捕收剂相比,浮选精矿CaF2品位提高约26百分点,回收率提高约50百分点。
(2)量子化学计算模拟结果显示,萤石(111)面对铈、钇、镧离子均有较好的吸附作用,吸附金属离子的位点是表面的氟原子,而对铕离子的吸附效果相对更低;方解石(104)面对四种金属离子均有较好的吸附作用,吸附位点是表面的氧原子。四种金属离子中,与BHA吸附作用从大到小依次为Ce>La>Y>Eu。
(3)本文以金属配合物方式设计捕收剂,试验证明了其对萤石的高效捕收性能,同时解释了其作用机理。以此类捕收剂与矿物之间的作用机理为理论基础改进捕收剂的设计思路,有望设计出能够实现工业应用的高效捕收剂。

