超滑聚酯纤维膜及其抗污染性能
尚琰龙,李日舜,姚安锋,赵莉芝,辛清萍,丁晓莉,李 泓,张玉忠
(天津工业大学 省部共建分离膜与膜过程国家重点实验室材料科学与工程学院,天津 300387)
表面污染是众多领域的共性科学问题,对材料性能造成严重影响。例如,海洋船只表面的生物污染可增加船体质量、增大航行阻力,造成的经济损失难以估算[1];污染物的吸附会改变生物医学植入材料的性能,造成感染,缩短使用寿命,并增加医疗成本[2]。目前设计抗污染表面主要有2 种策略,一种是构建亲水性表面,通过氢键或者离子键结合相当数量的水分子形成水化层,成为污染物在表面吸附的屏障[3]。然而在压力推动下,部分污染物会突破水化层向表面迁移而产生污染。另一种策略是构筑具有仿荷叶效应的超疏水表面,其低表面能的性质使污染物在较低表面剪切力的作用下即可从表面脱除[4],但是仍存在抗物理损伤性能差、易吸附细菌和蛋白质等问题[5]。相比之下,Aizenberg 等制备的仿猪笼草构造的润滑液体灌注多孔表面(Slippery liquid-infused porous surfaces, SLIPS)通过毛细作用将润滑油锁定在粗糙结构孔隙中,从而在基底形成一个光滑且化学均相的润滑层,能够防止污染物在基底表面的黏附,具有优异的抗污染能力和自修复能力,在防腐防菌、防雾、防覆冰等领域已被广泛研究[6]。
膜分离技术因其分离效率高且能耗低,被广泛用于食品、制药、废水处理等领域,然而也不可避免地面临膜污染的问题,降低分离效率。聚对苯二甲酸乙二醇酯(聚酯,PET)纤维膜是一种常用的膜分离材料,具有渗透性好、抗拉强度高、价格低廉等优点[7],由于其高分子材料固有的疏水性,聚酯纤维膜易吸附蛋白质及细菌等而导致污染[8]。将SLIPS 构筑于PET 纤维膜的表面,可有效提高其抗污染能力。
在前期工作中,笔者通过表面粗糙化、低表面能化、灌注润滑油等一系列操作,成功地在PET 纤维膜表面构筑了SLIPS,在油水分离中具有良好的防污性能[9]。然而,膜表面的粗糙结构通过吸附二氧化硅纳米粒子实现,其与基底的结合力较弱,故稳定性较差。本文利用聚多巴胺这种生物黏合剂,对PET 纤维膜表面进行活化,再通过溶胶凝胶法在膜表面制备稳定的二氧化硅纳米粒子涂层,进一步并灌注润滑油后,在膜表面得到SLIPS。所制备的超滑聚酯纤维膜具有良好的稳定性,表现出优异的疏液性能、油水分离性能及抗生物黏附性能。
1 实验部分
1.1 试剂与仪器
PET 纤维膜:购自Microfibres 公司;三羟甲基氨基甲烷盐酸盐(Tris):99.5%,购自北京百灵威科技有限公司;多巴胺盐酸盐(DA,98%)、磷酸二氢钠(NaH2PO4,97%)、磷酸氢二钠(Na2HPO4,99%)、四甲基硅氧烷(TMOS,99%)和全氟癸基三甲氧基硅烷(FOTS,97%):购于天津希恩思生物科技有限公司;聚乙烯亚胺(PEI,纯度99%)和二甲基硅油(PDMS,黏度100 mPa·s):购自上海阿拉丁生化科技股份有限公司;异硫氰酸荧光素标记牛血清蛋白(BSAFITC):购自北京柏赛科技有限公司;表面活性剂(Span 80):购自天津市光复科技发展有限公司;实验用水:均为18.2 MΩ纯水(Milli-Q 纯水系统,Thermo Fisher)。
场发射扫描电子显微镜(SEM):S-4800 型,日本日立公司;动态/静态接触角仪:SL200KB 型,美国科诺工业有限公司;真彩色共聚焦显微镜(CMS):ZEISS 公司;pH 计: EL20K 型,梅特勒-托利多仪器(上海)有限公司;K-alpha X 射线光电子能谱仪(XPS):美国Thermo Fisher 公司;Karl-Fisher 水分测定仪:瑞士梅特勒-托利多公司。
1.2 PET-SLIPS 纤维膜的制备
1.2.1 PET 纤维膜的预处理:将PET 纤维膜浸入乙醇中,在超声波振动下清洗10 min,然后将其放入40 ℃真空干燥箱中干燥待用。
1.2.2 聚多巴胺活化层制备:将0.2 g DA 和0.2 g PEI 超声溶解于200 mL Tris-HCl 缓冲液(0.05 mol/L,pH = 8.5)中,然后将预处理后的PET 纤维膜浸入上述溶液中,在25 ℃恒温振荡箱中以100 r/min 速度振荡沉积4 h。 最后取出样品,用纯水洗涤,得到聚多巴胺(PDA)活化的PET 纤维膜,记为PET-PDA。
1.2.3 SiO2纳米粗糙层制备:利用溶胶凝胶法制备SiO2纳米粗糙层。 将1.5 mL TMOS 溶液加入到100 mL HCl(1 mmol)中,充分搅拌15 min 使TOMS 完全水解形成原硅酸溶液,然后与等体积的磷酸盐缓冲液(0.2 mol/L,pH=6.0)混合均匀。 将PET-PDA 放入上述混合液中,在室温沉积4 h,然后取出样品并清洗后,置于温度为80 ℃的真空干燥箱中干燥,得到具有SiO2纳米粗糙层的PET 纤维膜,记为PET-SiO2。
1.2.4 氟 化 层 制 备:将PET-SiO2浸 入FOTS 和 乙 醇 体积比为1:99 的混合溶液中,反应1 h 后取出并用乙醇清洗,最后置于温度为120 ℃的真空干燥箱中处理10 min,得到具有氟化层的纤维膜,记为PET-fluorination。
1.2.5 灌注润滑油:将PET-fluorination 浸入润滑油中浸泡5 min,然后将样品垂直悬挂1 h,使多余的润滑油从表面流出,得到灌注润滑油的超滑纤维膜,记为PET-SLIPS。
1.3 稳定性测试
SiO2纳米粗糙层的稳定性通过测试处理前后样品表面水接触角及SEM 表面形貌来评价。 超声波处理:将表面沉积SiO2纳米粗糙层的纤维膜(PETSiO2,2 cm × 2 cm)浸入水中,置于超声波清洗仪(频率100 KHZ)中1 h,最后将样品烘干后进行接触角和SEM 测试;物理磨损处理:将PET-SiO2(4 cm ×2 cm)放在炭化硅砂纸上,用砝码(50 g)置于样品上提供压力,在恒定拉力下,匀速拉动样品分别移动不同距离(10~50 cm)后进行接触角和SEM 测试。
润滑油层在膜表面的稳定性通过测试处理前后样品表面接触角(CA)和滞后角(CAH)来评价。水流剪切处理时,将样品(4 cm × 1 cm)固定在烧杯内壁,然后加入纯水使样品浸没,在磁力搅拌(400 r/min)下产生水流剪切,600 min 内每隔一段时间取出样品并干燥,进行CA 和CAH 测试;物理磨损处理时,将样品(4 cm × 2 cm)放在炭化硅砂纸上,用砝码(50 g)置于样品上提供压力,在恒定拉力下,匀速拉动样品分别移动不同距离(10~50 cm),测试磨损前后样品表面CA 和CAH。
1.4 油水分离性能测试
将0.5 mg Span80(乳化剂)和2 mL 纯水分别加入到98 mL 油(二甲基硅油,全氟聚醚105 或泵油)中,剧烈搅拌2 h,得到油包水乳液;将2 mL 水加入到98 mL 油相中,搅拌2 h,得到油水混合物。
将纤维膜置于无砂芯的吸入式过滤器中间,在膜上方容器中加入待分离油包水乳液或油水混合物,重力驱动下进行分离。 通过Karl-Fisher 水分测定仪测试分离前后体系中的含水量,每个样品测试3 次,取其平均值作为测定值。 分离率可通过式(1)求得

式中:R——分离率;C0——进料液中水的含量;Cp——透过液中水的含量。
1.5 抗黏附性能测试
1.5.1 抗蛋白黏附性能测试:将2 cm × 2 cm 大小的PET 纤维膜、PET-SLIPS 样品分别放入10 mL 用PBS缓冲液(pH=7.4)稀释的FITC-BSA 溶液(0.2 g/L)中避光浸泡24 h,取出后用PBS 缓冲液冲洗样品正反面,避光自然干燥。 用LEICA SP8 型共聚焦激光扫描显微镜(德国LEICA 公司)观察样品表面蛋白黏附情况。
利用紫外分光光度法计算蛋白黏附量。使用TU-1901 型紫外分光光度计测试不同浓度BSA 在280 nm 的吸光度,绘制标准曲线。 将相同大小的PET 纤维膜和PET-SLIPS 分别放入10 mL BSA(1 g/L)溶液中浸泡24 h,测量溶液前后280 nm 处的吸光度值,基于朗伯比尔定律计算单位面积膜表面BSA黏附量(Q,单位g/cm2),见式(2)
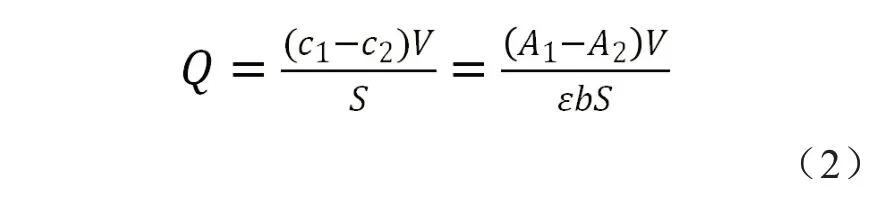
式中:A1和A2——分别是浸泡前后BSA 溶液吸光度;V——BSA 溶液的体积,L;S——膜的表面积,本实验中为9 cm2;ε——标准曲线得到的BSA 吸光系数,0.686 L/(g·cm);b——吸收层厚度,1 cm。
将上述浸泡前后的样品冲洗烘干后,使用XPS测试样品表面元素变化。
1.5.2 抗细菌黏附性能测试:选用大肠杆菌(E.coli)为污染源,在TSB 培养基中以1.4×108mL-1的密度制备大肠杆菌菌株[10]。将PET 和PET-SLIPS(2 cm×2 cm)浸入10 mL 菌液中,在37 ℃放置培养24 h。样品经无菌纯化水冲洗后置于10 mL 无菌PBS 溶液(pH 7.4)中超声处理5 min,去除样品表面的细菌。将含有被洗脱细菌的PBS 溶液稀释104倍,在TSB培养基上于37 ℃培养24 h,最后拍照并用于菌落形成单位(CFU)分析。另一方面,将暴露于细菌培养基中24 h 后的样品用无菌PBS 缓冲液和无菌水分别冲洗样品3 次,随即放置在质量分数2.5%的戊二醛中于4 ℃反应12 h,最后将样品进行冷冻干燥以进行SEM 观察。
2 结果与讨论
2.1 超滑聚酯纤维膜的制备
超滑聚酯纤维膜(PET-SLIPS)是以PET 纤维膜为基底,依次构筑聚多巴胺活化层、SiO2纳米粗糙层、氟化层及润滑油层来实现的,见Fig.1。DA 是一种生物黏合剂,可在基底表面形成活性层,有利于进一步表面修饰。多巴胺自聚沉积过程中,引入PEI 可通过氨基与邻苯二酚之间的共价作用共沉积在材料表面,并抑制多巴胺聚集体中的非共价相互作用,防止PDA 颗粒的形成[11,12],从而实现PDA 涂层的均匀分布,得到表面带有氨基的PET-PDA。 这些氨基可通过静电作用从溶胶溶液中吸收硅酸,并促进硅酸的缩聚反应,从而形成分布均匀的SiO2涂层。并且静电力吸引使得SiO2纳米粒子与基底的结合更牢固(样品记为PET-SiO2),在文献中已有报道[13]。SiO2纳米粒子在膜表面形成纳米级粗糙结构,以增大表面与润滑油的接触面积,同时,粒子间隙为稳定存储润滑油提供毛细作用,防止润滑油的损失。进一步氟化处理后,得到PET-fluorination,以降低表面能、增加表面与润滑油的亲和力。最后灌注润滑油,得到分子级光滑表面PET-SLIPS。
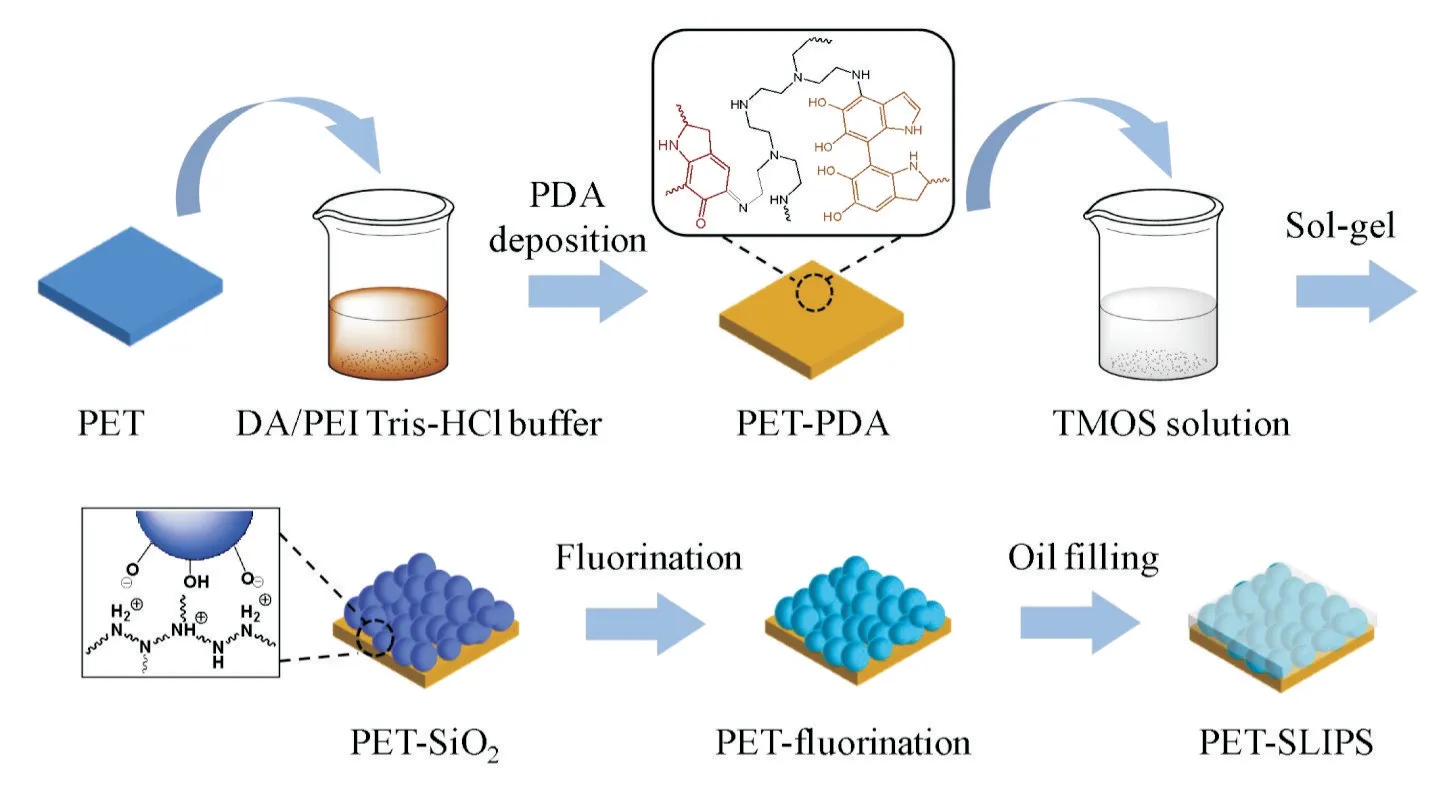
Fig. 1 Synthesis diagram of PET-SLIPS
通过SEM 和CSM 探究了改性过程中PET 纤维膜形貌以及粗糙度变化,从Fig.2 可以看出,与PET原膜(Fig.2(a),Fig.2(d))相比,经过PDA 沉积以后得到的PET-PDA 表面形貌基本没有发生变化(Fig.2(b)),粗糙度变化也很小(Fig.2(e)),说明PEI 存在下,多巴胺自聚没有产生明显的聚集性颗粒,生成的PDA 沉积层均匀。溶胶凝胶反应后,PET-SiO2表面均匀地分布着粒径20~50 nm 的SiO2纳米颗粒(Fig.2(c))。 由于PET 纤维膜基底本身的粗糙度较大,纳米尺寸的SiO2颗粒引起的膜粗糙度变化并不明显(Fig.2(f)),但根据文献报道,这种纳米尺寸的粗糙结构比微米级/微纳米结构对润滑油具有更好的保持能力[14]。
PDA 层及SiO2纳米粒子在膜表面分布的均匀性通过EDX 分析得到进一步证明。从Fig.3 可以看出,PET 原膜表面中仅观察到C 元素和O 元素(Fig.3(a));经PDA 沉积后,可以观察到PET-PDA 均匀分布的C,N,O 元素(Fig.3(b)),表明PDA/PEI 成功沉积在PET 上;PET-SiO2的EDX 元素分布图中出现了新的元素——Si 元素(Fig.3(c)),同样分布均一,表明预涂的PDA 活化层可以避免溶胶凝胶过程中SiO2粒子的堆集。

Fig. 2 (a, b, c)SEM and (d, e, f)CSM images of PET (a and d), PET-PDA(b and e), and PET-SiO2 (c and f)
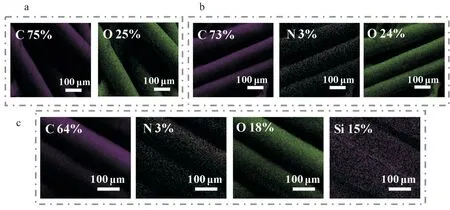
Fig.3 EDX mapping images of (a) PET, (b) PET-PDA, and (c) PET-SiO2
通过XPS 分析膜表面元素的变化。从Fig.4 可以看出,与PET 原膜相比(Fig.4a),在PET-PDA 的XPS 谱图中出现了N1s的特征峰(Fig.4b),PET-SiO2表面检测到Si 的特征吸收峰(Fig.4c),且C 与N 特征峰强度有所下降,O 的特征峰强度急剧上升。上述结果表明,SiO2纳米粗糙结构成功修饰于膜表面。经氟化处理后,样品表面出现了氟(F1s)的特征峰(Fig.4d),表明全氟硅烷对膜表面改性成功。最后,以二甲基硅油(后简称硅油)为润滑油,灌注于PETfluorination 表面,得到超滑PET 纤维膜PET-SLIPS。

Fig.4 XPS spectra of PET before and after modification
润滑油在PET-SLIPS 表面形成连续的,均相的润滑层,由于硅油的疏水性,PET-SLIPS 的水接触角为96°,并且水滴(10μL)可以在较小角度(~12°)倾斜的表面上滑动(Fig.5(A)),而润滑层不被水滴所取代,表现出光滑性质。同样,与硅油层互不相容的液体均可从PET-SLIPS 表面滑落,如Fig.5(B)所示,20μL甲基橙水溶液(HIn)、盐溶液(Saline)、牛奶(Milk)、甘油(GI)、豆浆(Soy milk)或亚甲基蓝水溶液(MB)从PET-SLIPS表面滑落,而没有留下任何污染的痕迹。相比之下,MB 溶液滴在PET 原膜上,则迅速将膜污染。这表明PET-SLIPS具有良好的疏液性。

Fig. 5 (a) Photographs showing the dynamic mobility of a water droplet (10 μL) on PET-SLIPS with a low tilting angle (~12°);(b) images of various liquids (20 μL) sliding down on PET-SLIPS and on blank PET as a control
润滑油在基底表面形成稳定的润滑层,而不被测试液体(如,水)取代,需要满足式(3)和式(4)[15]

式中:γA——测试液体(水)的表面能;γB——润滑油的表面能;γAB——测试液体和润滑油的界面能;θA和θB——平衡时测试液体和润滑油在基底表面的接触角;R——材料的粗糙度系数(R= cosθA/cosθ,θ——测试液体在润滑油灌注表面的接触角)。
计算结果如Tab.1 所示,ΔE1和ΔE2均为正值,说明硅油与PET-fluorination 的化学亲和力高于水与PET-fluorination 的化学亲和力,因此基底优先被润滑油硅油润湿。
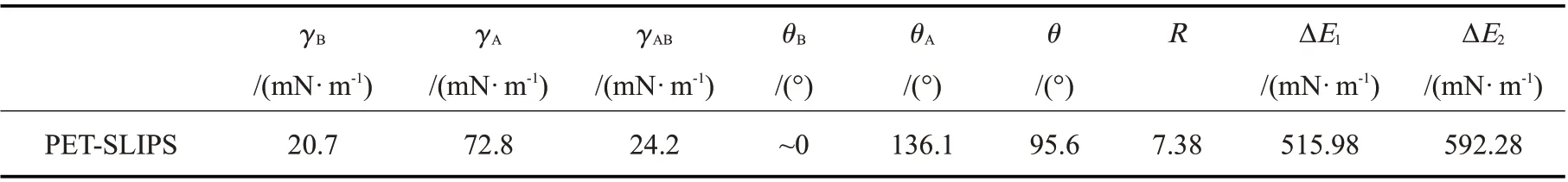
Tab.1 Surface/interface tensions of silicone oil and water, and their contact angles on PET-fluorination
2.2 SiO2纳米层及润滑层的稳定性
PET-SLIPS 的超滑性质主要源于最外层的润滑油层,而润滑油通过SiO2纳米粗糙结构的毛细作用存储于膜表面,因此润滑油在表面的稳定性首先是要求粗糙层应具有高的稳定性。 本文通过超声波、物理磨损处理前后PET-SiO2的接触角和表面形貌变化,对SiO2纳米粗糙结构的稳定性进行分析。 如Fig.6(A)所示,PET-SiO2由于SiO2的亲水性,水接触角仅为2°,在100KHz 超声波处理3 h 后,接触角基本未发生改变,SEM 图显示其表面形貌也没有明显变化,说明SiO2纳米粗糙结构在超声条件下具有优异的稳定性。实际使用的过程中的物理磨损会使材料表面的涂层脱落或损坏,造成性能下降。本实验通过将PET-SiO2在炭化硅砂纸上拉动不同距离,测试SiO2纳米粗糙结构的耐物理损伤能力。如Fig.6(B)所示,当拉动距离小于10 cm 时,接触角变化较小,CA 小于5°,其表面形貌也未发生明显变化,表明轻度的物理磨损下,PDA 黏结的SiO2纳米粗糙层的稳定性良好。当拉动距离大于10 cm 时,接触角逐渐增大。从SEM 图片可以看出,当拉动距离为30 cm 时,PET 基底表面部分纤维丝被破坏,导致表面变粗糙,疏水的部分暴露,使接触角增大。
润滑层的损失会使疏水性粗糙结构暴露,造成污染物更容易黏附在表面,本文通过对PET-SLIPS施加水流剪切力和物理磨损作用,测试其静态接触角(CA)及滞后角(CAH)变化,用以评价润滑层的耐久性和稳定性。 结果如Fig.6(C)所示,置于磁力搅拌产生的水流剪切中的PET-SLIPS,随着水流剪切时间的延长,其表面静态接触角基本不变,CAH略有增加,表明水流剪切环境下膜表面润滑油损失不明显。同样,在炭化硅砂纸的物理摩擦下,PETSLIPS 表面接触角也基本不变,这是由于润滑油的流动性,使其具有良好的自修复能力[16]。 但是当拉动距离为30 cm 时,由于基底表面会被砂纸损伤(Fig.6(B)中的M 插图d),产生沟壑,润滑油不能均匀覆盖其表面,因此CAH 显著增加。综上表明,SiO2纳米粗糙结构和润滑层都具有较好的稳定性,这为PET-SLIPS 保持其光滑性质以及长期使用奠定了基础。
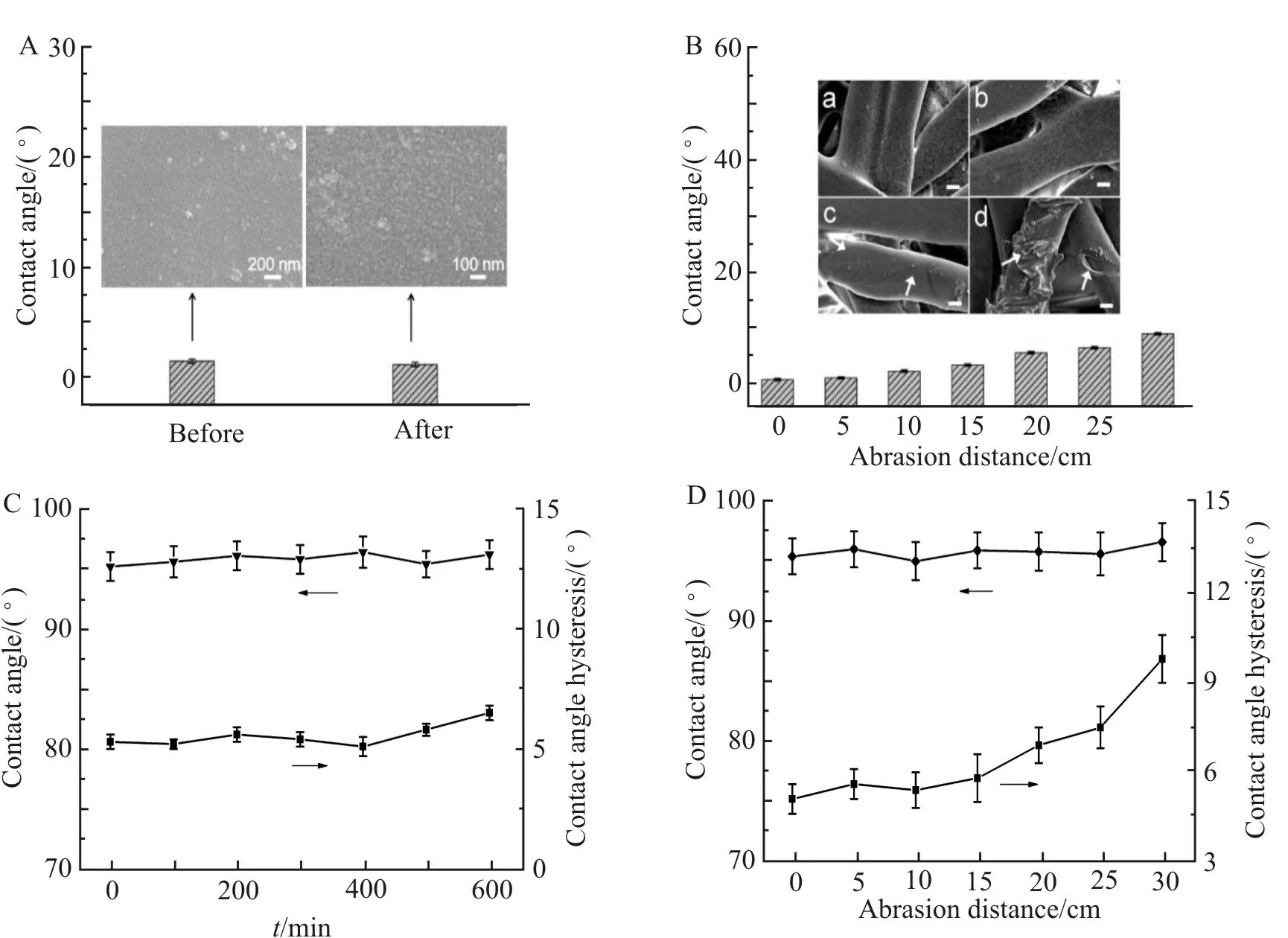
Fig. 6 (A) Contact angles of water on PET-SiO2 before and after ultrasonic treatment (inset: SEM of PET-SiO2 before and after ultrasonic treatment); (B) contact angles of water on PET-SiO2 after different abrasion distances (inset: SEM images of PET-SiO2 after abrasion distances of (a)0 cm, (b)10 cm, (c) 20 cm and (d)30 cm; scale bar: 4 μm); (C and D) variation of contact angles and contact angle hysteresis of PET-SLIPS after immersion in flowing water at a stirring speed of 400 r/min for 0~600 min (C) or after abrasion distances of 0~30 cm (D)
2.3 PET-SLIPS 的油水分离性能
利用PET-SLIPS 的疏水性,可将其应用于油水分离。当以硅油为润滑油时,由于润滑层对硅油的超润湿和对水的不润湿特性,硅油/水混合物中的油相在重力驱动下可渗透通过PET-SLIPS 膜,而水被保留在膜上方(Fig.7(a),Fig.7(b)),从而实现油水分离。同样,PET-SLIPS 也可在重力作用下实现对油包水乳液的分离。 由Fig.7(c)和Fig.7(c’)可以看出,初始乳液呈乳状,分离后的滤液变得清澈。在光学显微镜下,最初油包水乳液中分散的水滴经过分离之后消失,说明乳液中的水滴被PET-SLIPS 去除。通过卡尔费休水分测试仪测试分离前后体系中水分含量,并由式(1)计算可知,PET-SLIPS 对油水混合物和油包水乳液的分离率均超过99.9%。 根据Laplace 方程(式(5))可知,当压力大于Laplace 压力时,水相可以突破油层透过膜。
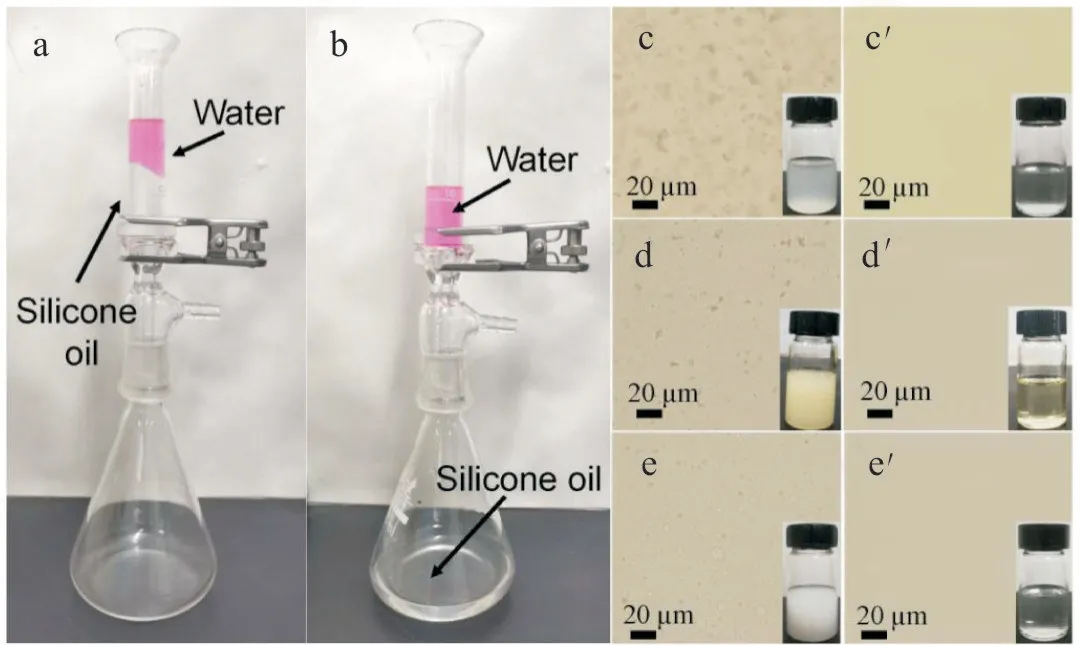
Fig.7 Snapshots of silicone oil/water mixtures (a)before and (b)after separation in a filter device (the water phase was dyed by rhodamine b, 200 mg/L), and optical microscopy images of water-in-oil emulsions (c, d, e)before and (c’, d’, e’)after separation (inset: snapshots of water-in-oil emulsions and filtered oil; c and c’: water-in-silicone oil; d and d’: water-inump oil; e and e’: water-in-PFPE)

Fig. 8 Separation efficiency of the PET-SLIPS membrane for(a~c)oil/water mixtures and (d~f)water-in-oil emulsions by gravity (the oil phases are as follows: a and d, silicone oil; b and e, pump oil; c and f, PFPE)
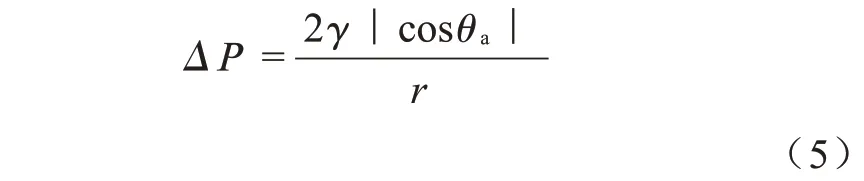
式中:ΔP——跨膜压力;r——膜孔平均半径(6 μm,由Porolux1000 仪器测得);γ——硅油-水界面张力(24.2 mN/m,采用悬滴法通过接触角仪测得[17]);θa——水在硅油润滑层上的前进角,由接触角仪测得为99°,计算得到ΔP=1261 Pa。 因此,进一步由ΔPE=ρgh(式中:ΔPE为液压;ρ为液体密度;g为重力加速度)得知,PET-SLIPS 膜可以支撑的硅油包水乳液高度约为13 cm,而不发生水相的穿透。
当以泵油、全氟聚醚(PFPE)等低表面能液体为润滑油灌注于膜表面时,同样可实现与润滑油种类一致的油包水乳液和油水混合物的分离(Fig.7(d)),Fig.7(d'),Fig.7(e),Fig.7(e')),并 保 持 高 的 分 离 率(Fig.8)。

Fig. 9 Photographs of surface of (a, b)PET and (c,d)PET-SLIPS before and after filtration of water-in-silicone oil emulsion
在油包水乳液的分离过程中,由于液滴和表面活性剂的吸附,膜不可避免地会被污染而造成分离性能下降。本文中,通过毛细作用稳定的连续的润滑油层,可抑制与之不互溶的水滴与膜基底接触,使膜在分离过程中具有防污性能;同时,连续相油相可以及时补充分离过程中损失的润滑层。如Fig.9 所示,连续过滤相同体积(28 L/m2)后,PET 原膜(Fig.9(b))被水相中染料(罗丹明B,200 mg/L)染色,并且无法清洗干净,分离率低于92%;而预先灌注硅油的PET-SLIPS 过滤油水乳液后,表面染色较轻(Fig.9(d)),分离率保持在>98.5%的高水平。这些结果表明,与PET 原膜相比,PET-SLIPS 在油水分离中具有更加优异的分离性能和抗污染性。
2.4 PET-SLIPS 的抗生物黏附性能
蛋白质和细菌的黏附是造成分离膜生物污染的重要原因。 本文使用绿色荧光标记蛋白(FITCBSA)研究了PET-SLIPS 的抗蛋白黏附性能。将PET-SLIPS 浸泡在FITC-BSA 溶液中24 h 后,使用激光共聚焦显微镜对样品正反面进行分析,由于FITC-BSA 的荧光特点,可以直观地观察蛋白质在膜表面的黏附情况。如Fig.10 所示,无论正面还是反面(Fig.10(A1)和Fig.10(A2)),PET-SLIPS 都只黏附了极少量的蛋白质,图像整体比较暗淡。 相比之下,PET 原膜的纤维结构都黏附了大量的蛋白质,正反面(Fig.10(B1)和Fig.10(B2))都展现出了较强的绿色荧光,图片整体更为明亮。绘制BSA 标准曲线,然后通过紫外分光光度法使用式(2)计算了2种膜浸泡在BSA 溶液中24 h 后的蛋白黏附量(Fig.10(C)),对比可知,PET-SLIPS 的蛋白黏附量约为50 μg/cm2,而PET 膜的蛋白黏附量达到了108 μg/cm2。 同样,XPS 结果也表明PET-SLIPS 表面蛋白黏附量少于PET 膜。 Fig.10(D)中,PET 膜浸于BSA 溶液中24 h 后,XPS 谱图显示出N1s特征吸收峰,原因是BSA 中含有大量的含氮基团;PET-SLIPS 在BSA溶液中浸泡24 h 后,则未检测出明显变化。可见,由于PET 纤维膜的疏水性,很容易黏附蛋白质,PETSLIPS 超滑膜润滑层的存在使得蛋白质无法直接接触到膜表面,蛋白质在润滑油表面很容易被冲洗掉,不易黏附,因此表现出优异的抗蛋白黏附性。
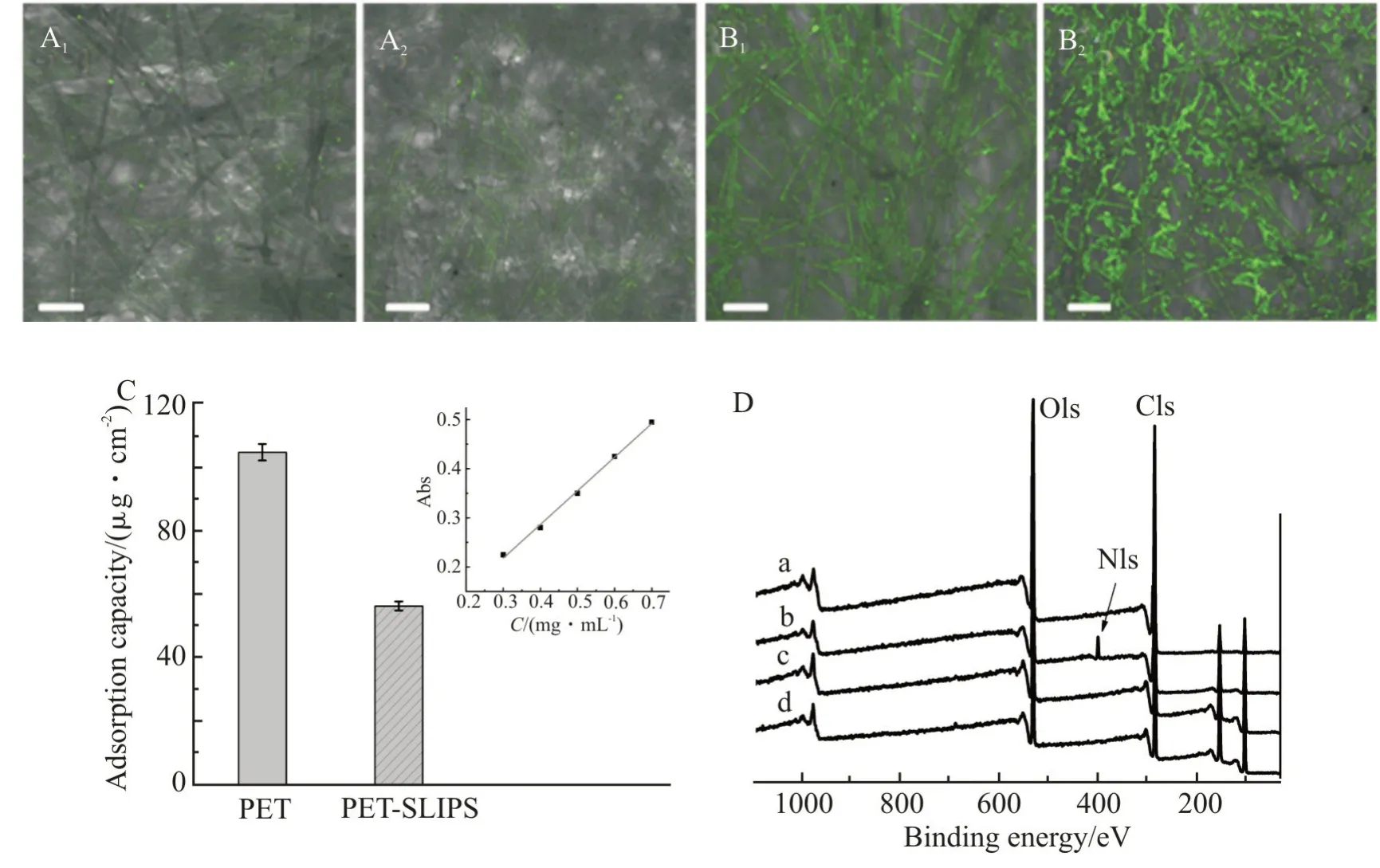
Fig.10 (A and B) CLSM images of PET-SLIPS ((A1):front; (A2):back) and PET ((B1):front; (B2):back) after immersion in FITC-BSA solution for 24 h(scale bar: 100 μm); (C) adhesion capacity of PET and PET-SLIPS for BSA(inset: standard curve of BSA based on the absorbance at 280 nm in PBS solution, pH 7.4); (D) XPS spectra of PET (a and b) or PET-SLIPS (c and d) before(a and c) and after (b and d) soaked in BSA solution for 24 h
大肠杆菌(E.coli)为工业上常见的致污细菌,因此,以大肠杆菌为模型细菌测试PET-SLIPS 的抗细菌黏附性能。 将PET 原膜和PET-SLIPS 超滑膜浸入大肠杆菌培养液中培养24 h 后,通过扫描电子显微镜可以明显看出,PET 膜表面黏附较多大肠杆菌(Fig.11(a),箭头标记处为黏附的大肠杆菌),而PET-SLIPS 表面没有观察到黏附的细菌(Fig.11(c),Fig.11(d))。 PET 原膜和PET-SLIPS 超滑膜的CFU 计数分别为(2.4±0.5)×105cm-2和(4.8±0.8)×103cm-2,这些结果表明,PET-SLIPS 超滑膜具有良好的抗细菌黏附性。

Fig. 11 SEM images of (a and b)PET and (c and d)PET-SLIPS membranes (a and c)before and (b and d)after exposure to the solution of E. coli for 24 h
综上结果表明,本文所制备的PET-SLIPS 由于表面润滑层的存在,阻碍了其他污染物直接接触基底,并且润滑层的流动性使PET-SLIPS 表面具有光滑特性,污染物极易被冲洗去除,因而具有良好的抗污染性能。
3 结论
本文在PET 基底上依次构筑PDA 活化层、SiO2纳米粗糙层、氟化层及润滑油层,制备了超滑聚酯纤维膜PET-SLIPS。该超滑膜具有良好的疏液性,多种污染液体均可在其表面滑落而不留痕迹。PET-SLIPS 的SiO2纳米粗糙层和润滑层在超声、水流剪切以及轻度物理磨损的条件下均具有较好的稳定性。由于PET-SLIPS 特殊的浸润性,可实现对油水混合物和油包水乳液的分离,分离率达到99.9%以上;同时,与PET 原膜相比,超滑膜的润滑层可抑制污染物与膜基底接触,因而具有优异的抗污染性能及抗生物黏附性能。

