多肽类抗生素的环境安全性评价研究进展
王 磊,徐向月,马文瑾,霍美霞,孙 磊,侯旖璇,刘海燕,林旭东,黄玲利*
(1.华中农业大学农业部畜禽产品质量安全风险评估实验室,武汉430070;2.华中农业大学国家兽药残留基准实验室(HZAU),农业部食品残留检测重点实验室,武汉430070)
多肽类抗生素(ABPs)是一类具有复杂多肽结构的化学物质,主要有杆菌肽、黏菌素和达托霉素等(图1)。其中黏菌素主要是通过影响敏感细菌的外膜,发生静电相互作用以破坏外膜的完整性,导致细菌功能障碍直至死亡,其对革兰氏阴性杆菌如大肠杆菌、铜绿假单胞菌等的抗菌活性强。杆菌肽的作用机理主要是抑制细菌细胞壁的合成,而万古霉素则是通过阻断细胞壁蛋白质的合成,进而使细菌死亡,二者均对革兰氏阳性菌如金黄色葡萄球菌、链球菌等有良好的抗菌活性。多肽类药物拥有广泛的靶标生物,在人类医学和动物医学中被广泛使用,自20世纪60年代以来,杆菌肽和黏菌素一直被广泛用作原料行业的抗生素和促生长剂[1]。据我国农业农村部统计,2019年我国ABPs的使用量达3500.70 t,占全部抗菌药物使用量的11.33%,按兽用抗生素类别计使用量排第二,仅次于四环素类。目前上市的多肽类产品多是口服制剂,因其在经口给药后不能被完全吸收,大部分多肽类产品以母体或代谢物的形式随粪便排出体外[2,3],导致其耐药菌逐渐增多,因此,ABPs作为对抗多重耐药细菌的最后手段变得越来越重要。

图1 多肽类抗生素达托霉素、多黏菌素变体(B1、B2、E1和E2)和杆菌肽变体(A1、B1和C1)的化学结构
兽用抗生素在环境中的安全性评价主要包括抗生素的暴露风险评估和对环境的效应评估。目前,Davis等[4]在2020年研究调查了三种常用多肽类抗生素:杆菌肽、达托霉素和多黏菌素B和E(硫酸黏菌素)的环境归宿。Yen等[5]在2021年检测了黏菌素对斑马鱼胚胎的潜在毒性。考虑到ABPs的生物活性和抗生素耐药性的潜在风险,对ABPs进行环境安全性评价是极其重要的[6]。
系统总结了ABPs在环境中安全性评价研究进展,解释了ABPs在环境中的暴露现状,阐明了ABPs在环境中的动力学行为特征和生态毒性效应,分析了ABPs耐药菌及抗性基因形成特征及去除技术,为全面评估ABPs的环境安全性及有效避免或降低该类抗生素耐药性及抗性基因(ARGs)的传播提供科学依据。
1 多肽类抗生素在环境中的检测方法及暴露现状
1.1 多肽类抗生素在环境样本中的检测方法 目前,环境样本中抗生素的检测方法主要是采用超声萃取-固相萃取、加速溶剂萃取-固相萃取、微波辅助萃取-固相萃取或QuEChERS前处理技术,使用液相色谱或液相色谱串联质谱法进行定量测定,液相色谱串联质谱法,是现阶段最为常用的检测方法[7]。液相色谱与高选择性、髙灵敏度的质谱结合可以克服背景干扰,对复杂样品达到很高的灵敏度[8]。
目前,多肽类抗生素在不同环境样本中的检测方法已有相关研究,如表1所示。Davis等[4]采用高效液相色谱-高分辨串联质谱(HPLC/HRMS/MS)对土壤样品中的多肽类抗生素进行分析,样品经淋洗液A(0.1%甲酸)和淋洗液B(0.1%甲酸乙腈)梯度洗脱,在全扫描模式下采集数据。结果表明多肽类抗生素定量限分别为0.01~4.7 mg/L(达托霉素),0.5~9.4 mg/L(多黏菌素B),0.9~11.7 mg/L(多黏菌素ES),0.6~9.7 mg/L(黏杆菌素A1),0.3~5.6 mg/L(黏杆菌素B1),0.07~1.3 mg/L(黏杆菌素C1)。Van等[9]建立了一种可同时检测和定量猪粪中包括黏菌素在内的五种常见抗生素的超高效液相色谱-串联质谱(UHPLC-MS/MS)方法,用乙腈和6%三氯乙酸的混合溶液提取后将上清液蒸发,最后使用1 mL 20%乙腈和0.1%甲酸的混合溶液复溶,UHPLC-MS/MS进行过滤,在C18色谱柱上进行梯度洗脱,所有化合物的回收率均在94%~106%之间,重复性百分比在1.7%~9.2%之间,室内重复性在2.8%~9.3%之间,该方法检出限为1.1~20.2 mg/kg,定量限为3.5~67.3 mg/kg。Xia[10]等采用UHPLC-MS/MS方法测定了猪粪中黏菌素的浓度,使用10%三氯乙酸和乙腈的混合溶液进行提取,经WCX小柱净化,黏菌素A和B的回收率在81~102%之间,定量限为10 mg/L。环境样品基质复杂,前处理工作繁琐,近年来固相萃取技术逐步应用到土壤、粪肥等抗生素检测技术中,将萃取、富集等集于一体,提高前处理效率,保障方法的重复性[10]。

表1 几种多肽类抗生素在不同环境样本中的检测方法
1.2 多肽类抗生素在环境中的暴露现状 临床医疗和畜禽养殖是环境中ABPs污染的主要来源,多肽类抗生素在不同环境基质中的暴露情况如表2所示。Menz等[12]采用基于使用模式的暴露筛选模型预测兽用抗生素平均和最坏情况下环境浓度。预测结果表明,在混有鸡粪、猪粪和牛粪的土壤中,黏菌素平均浓度约为100 μg/kg。2017年,欧洲药品管理局报告了达托霉素第一阶段环境风险评估,考虑到成人和儿童给药剂量不同,预测地表水中达托霉素的浓度为3.6~0.48 μg/L。Zhou等[13]对我国南方6个典型猪场和奶牛场11类50种抗生素的排泄量和环境发生情况进行评价,发现每头猪和牛的标准化日排泄量分别为18.2 mg/d和4.24 mg/d,杆菌肽(3.81 mg/d)是每头猪抗生素标准化日排泄量的主要贡献者。Joy等[14]探讨了不同施肥方式对施肥后土壤及径流中杆菌肽及其ARGs的迁移的影响,采集含杆菌肽的新鲜猪粪,通过广播、合并和注射方法进行土地施用,在处理组和对照组的土地上进行了三次降雨模拟试验。结果表明,在新鲜猪粪中杆菌肽的浓度为320 mg/kg,经处理后,在任何径流样本中都没有检测到杆菌肽,但检测出杆菌肽的降解产物杆菌肽F,用PCR方法在粪便样品中未检测到抗杆菌肽基因,可能是由于降雨条件下使杆菌肽加速降解为无活性的杆菌肽F,因此并未有充足的时间产生抗杆菌肽基因。
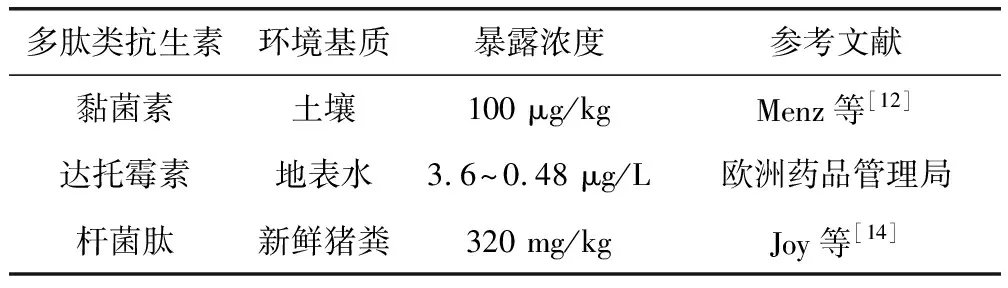
表2 几种多肽类抗生素在不同环境基质中的暴露浓度
2 多肽类抗生素环境行为研究进展
2.1 多肽类抗生素在土壤中的吸附 兽药进入环境后,会与土壤、黏土矿物、沉积物等环境介质发生吸附作用,这一过程对抗生素的迁移、降解以及生物可利用性都有重要的影响, 是决定抗生素在土壤中环境行为的关键过程之一[15]。Sarmah等[16]总结了四种兽用抗生素在环境中的暴露途径及命运,其中杆菌肽在碱性粘土中不稳定,蛭石和伊利石对杆菌肽的吸附较低,这是由于在pH值为7.9~8.2的条件下,粘土的碱度引起的阴离子行为所致。杆菌肽是一种中性物质,也是一种多肽,与许多其他氨基酸一样,可能以偶极分子的形式存在,在酸性溶液中,它以阳离子起作用,而在碱性溶液中,它以阴离子起作用,因此其在非碱性蒙脱石粘土的吸附量大。Davis等[4]研究调查了杆菌肽、达托霉素和多黏菌素B和E(硫酸黏菌素)的环境归宿,结果表明杆菌肽在砂土中的吸附系数为5.8~8,仅有轻微吸附作用,在粘质土中的吸附系数为169~250,有显著吸附作用;而硫酸黏菌素对砂土的吸附作用较强(Kd=111~256),在粘质土中没有表现出明显的吸附作用。在GUS评价法中,有机污染物的GUS 值越大,表示其淋溶迁移性越高,污染地下水的可能性也越大。当GUS>2.8时,有机污染物具有高淋溶迁移性。吕颖等[17]在总结归类环境中抗生素的基础上,计算多种抗生素的地下水污染指数GUS值并估算各类抗生素的淋溶迁移性,其中黏菌素21.97,多黏霉素4.267,杆菌肽素6.41,三种多肽类抗生素均具有高淋溶迁移性,对地下水环境以及生态健康具有极大威胁。
2.2 多肽类抗生素在环境中的降解 降解是影响土壤中抗生素生态行为的重要因素。由于环境条件不同,土壤中抗菌药可能发生一种或多种降解反应,兽药在不同环境介质中的降解途径主要包括微生物降解、化学降解和光降解三个部分。通常情况下,温度、湿度和土壤类型等因素会影响抗生素在土壤中的降解作用。Sarmah等[16]研究了杆菌肽在土壤中的降解,在每克含有粪便的土壤中添加5.6 mg抗生素,30 ℃条件下培养30天后,23%的杆菌肽仍然存在;在20 ℃条件下培养30天后,33%的杆菌肽仍然存在。谭为军[18]指出虽然降解过程在一定程度上减少了环境中兽药的含量,但一些降解产物具有与其母体化合物相似的毒性,且在一定条件下可重新转变成活性母体药物。因此,兽药的代谢及二次合成所引发的环境风险同样不容忽视。那西肽是具有良好的生长刺激作用的含硫多肽类抗生素,田书音等[19]的研究表明随动物粪便排出的那西肽仍然有抗菌活性,被排出的那西肽在猪粪和鸡粪中的半衰期分别为30 d和20 d,但是在检测用含有那西肽粪便作为肥料的作物时,在收获的农产品中并未发现那西肽残留,表明那西肽对环境的影响较小。Joy等[20]在厌氧条件下,研究了杆菌肽在猪粪中的行为,测定了其半衰期为1.9 d,降解较快,而在含有杆菌肽的猪粪中未检测到杆菌肽抗性基因。
目前有关土壤中ABPs的吸附/解吸和降解的研究较少,仍处于对相关机理的认识和探索阶段。土壤环境条件复杂,现阶段环境中所存在的抗生素类型多样,可结合养殖环境中的常用抗生素、具体的土壤质地以及气候因素来开展竞争吸附等试验,同时利用现代分子生物学技术,在分子水平深入探究土壤中的动物体内的累积和降解机理及微生物是否对于ABPs的降解产生影响,以此促进对ABPs在土壤中的吸附/解吸与降解机理的深入了解。
3 多肽类抗生素在环境中的生态效应评估研究进展
抗生素在土壤中的累积会对植物、土壤动物和微生物产生毒性效应,而其在农作物(如蔬菜)可食用部位的累积会导致食物链的污染,给人体健康造成潜在的危害。此外,进入土壤的抗生素所带来的选择压力会诱导大量耐药菌的生长,并且促进抗性基因在微生物间发生水平迁移,增加微生物群落的抗性,从而间接给公众健康带来风险。
3.1 陆生生物生态毒性 Guo等[21]研究了黏菌素对蚯蚓的生态毒性,发现黏菌素可上调热休克蛋白70基因的表达,抑制金属硫蛋白基因的表达,并且随着黏菌素暴露时间的延长,蚯蚓肠上皮超微结构受损,尤其是当暴露于100 mg/kg浓度时,线粒体出现内膜损伤和空泡化。马驿等[22]通过在土壤中添加不同浓度硫酸黏菌素,借助氯仿熏蒸浸提法和磷脂脂肪酸(PLFA)方法,分析土壤微生物生物量碳和微生物群落结构的变化特征,明确土壤微生物群落结构多样性类型的分异程度,揭示了在硫酸黏菌素的影响下,土壤微生物的数量和活性大大降低,土壤中革兰氏阴性菌PLFA表征的含量明显低于革兰氏阳性菌的含量,这与硫酸黏菌的杀菌机理有关,硫酸黏菌素为窄谱杀菌药物,对革兰氏阴性的杀菌活性强。而土壤微生物在改善土壤结构、降解土壤有机质方面有重要作用,氮是生物大分子蛋白质和核酸的关键组成元素,生物固氮约占全球植物需氮量的75%(质量分数),土壤中多种微生物具有固氮能力,固氮微生物主要靠固氮酶来完成固氮,nifH基因负责编码固氮酶组分铁蛋白亚基,范葶莉等[23]通过提取土壤总DNA,采用末端限制性片段长度多样性分析技术对土壤固氮微生物nifH基因进行多样性分析,研究了硫酸黏菌素残留对土壤固氮微生物nifH基因多样性的影响,结果表明硫酸黏菌素影响了土壤固氮微生物nifH基因的多样性,使土壤固氮微生物的丰富度和均匀度降低。ABPs的生态毒性效应虽有研究,但并未考虑到实际环境介质中ABPs的暴露量与蓄积量,且毒性作用机理尚不明确。
3.2 水生生物生态毒性 Yen等[5]检测了黏菌素对斑马鱼胚胎的潜在毒性,研究表明黏菌素比之前分析的大多数抗生素毒性更大,致死浓度的黏菌素可以严重损伤皮肤角质层细胞,导致胚胎细胞的渗透溶解;亚致死浓度会损害侧线毛细胞和机械转导,这可能对鱼类的生存构成威胁。杆菌肽作为饲料添加剂不仅能有效地抑制和杀灭鱼体和水体中的病原微生物,还可以促进鱼体生长,但近几年研究发现,杆菌肽锌对水环境有严重的破坏作用,在杀灭病原微生物的同时,还会杀灭水环境中有益微生物,破坏了水体微环境的生态平衡,造成水质恶化[24],此外杆菌肽在水环境中的残留也会通过食物链蓄积作用进入人体,对人体器官产生蓄积毒性作用。
实际环境中,包括土壤、水和粪肥,一般都是多种抗生素共存的,但现有研究以单一抗生素为考察对象的居多,这并不能充分反映实际环境中抗生素对微生物群落结构和抗性基因的影响。因此,应探讨不同类型抗生素的复合污染物在不同浓度水平下对微生物的呼吸作用、多样性和酶活性的作用机制,从而进一步探究抗生素污染对ARGs丰度的影响。
4 多肽类抗生素耐药菌及抗性基因研究进展
4.1 多肽类抗生素耐药菌及抗性基因的发生 由于抗生素在农业和人类医疗行业中的大规模使用,导致抗生素耐药菌(ARB)和ARGs以及新耐药机制的出现[25-28]。ARB和ARGs的出现是一个重大的公共卫生问题,在世界范围内构成了严重的治疗挑战[26]。2016年,在上海附近一个集约化养殖场的一头屠宰的猪中发现了第一例黏菌素耐药大肠杆菌,且在2011~2014年的15%的检测零售肉类和1%的回顾性分析样本中也存在抗性基因mcr-1[29]。自从第一个黏菌素抗性基因被发现以来,近年来又发现了其他抗性基因mcr-2~mcr-9[30]。这些基因已被证实能引起脂多糖(LPS)膜中脂质A的修饰。2018年,不仅在亚洲国家,而且在澳大利亚、欧洲、非洲、北美和南美洲的猪粪、人类和环境样本中发现了这些抗药性基因[31]。Klees等[32]评估了肉类生产链中四种耐多药细菌的流行率,在2018和2019年,在德国西北部共收集了来自肉类生产四个阶段(屠宰场,肉类加工厂,新鲜食品和城市环境)的505个样本,并利用PCR技术筛选耐多药细菌的存在,在9~26%的所有阶段样本中检测到黏菌素抗性编码mcr基因,且耐黏菌素肠杆菌(Col-E)存在于所有阶段样品的1~7%,总体结果表明,携带Col-E的mcr在屠宰场、肉类加工厂和零售食品中普遍存在。
Liu等[33]对我国9个省23个市的53个超市或农贸市场的528份蔬菜样品进行了mcr基因分析,并对mcr阳性的肠杆菌科细菌进行了鉴定,结果表明我国鲜菜中mcr-1的流行率很高,mcr-1的传播是由类似的IncX4或IncI2质粒介导的,蔬菜中的质粒与临床分离株中的质粒高度相似,这表明即食蔬菜生产商mcr-1可能会对公众健康构成巨大威胁,需要采取措施确保食品安全。Yang等[34]利用从SRA获得的122个水生宏基因组DNA数据集(92个湖水和30个海水)进行了全球调查,通过生物信息学分析,从数据集序列中提取ARGs和金属抗性基因(MRGs),结果表明在ARGs中,多药耐药基因和杆菌肽耐药基因在湖泊和海水样品中的相对丰度较高。由蓝藻水华引起的抗生素抗性基因和微囊藻毒素(MCs)的二次污染问题已成为重大的全球问题,这两种污染物共同存在于饮用水处理厂(DWTPs)中,Xu等[35]为了探究二者之间的关系,在实验室条件下研究了MCs对ARGs水平转移的影响,并在细胞和分子水平上探索了机制,结果表明MCs可以促进ARGs的传播,特别是在相对稳定的环境下如生物膜中,MC-LR是促进接合转移的最有效的微囊藻毒素亚型,比对照组高25.13倍,MCs通过调节参与接合转移的一系列基因系统,刺激活性氧(ROS)的形成和增加细胞膜通透性来影响ARGs的水平转移。
4.2 多肽类抗生素耐药菌及抗性基因的去除 自从在大肠杆菌中发现黏菌素抗性基因mcr-1以来,质粒介导的黏菌素抗性基因mcr-1的出现和迅速传播已经成为一个公共卫生问题,畜禽粪便是mcr-1的重要储存库,在高温堆肥过程中,准确量化畜禽粪便中mcr-1的流行率和其中的动态变化的研究还很少,Gao等[36]对从四种畜禽粪便中采集的51份样品中的mcr-1进行了检测和定量分析,共有16份粪便样品检出mcr-1阳性,51份样品的检出率为31%,12份mcr-1阳性粪便样品的mcr-1基因拷贝数为107~109 copies/g,堆肥过程中,在高温(44~65 ℃)下,粪便中90%以上的mcr-1在15 d内被去除,22 d后完全检测不到mcr-1,结果表明高温堆肥有效地去除了mcr-1,并抑制了其从畜禽粪便向环境的扩散。Le等[37]研究了施用了黏菌素的粪便和堆肥对抗黏菌素大肠杆菌、肺炎克雷伯菌和铜绿假单胞菌的影响,以及粪肥中其ARGs的流行情况,结果表明施用带有黏菌素的粪便对其耐药菌没有明显的影响,并且堆肥能够使其抗性基因减少,但即使经过6周的堆肥,携带抗性基因的质粒仍然可以向受体转移,说明堆肥不能完全消除通过鸡粪传播抗生素耐药性的风险。
堆肥工艺是有效去除ABPs抗性基因的方法,但ABPs在堆肥过程中的降解与迁移研究较少。堆肥工艺可控条件较多,可通过调节温度、调整通气量或通气方式、控制堆肥时间和含水量等有针对性地优化堆肥条件,使ABPs及其耐药基因得到有效的降解。
5 展 望
ABPs不仅在人类医疗行业中起到至关重要的作用,同时在养殖行业防治动物疾病发挥了巨大的作用,但也带来了环境污染和公共健康方面的问题与挑战。保护环境安全和人类健康的前提则是深入了解ABPs的环境行为和生态效应,进行风险评估。在环境样本检测方面,采用多种分析技术联用是检测土壤等环境样本中ABPs的主要方法,但近年来对ABPs的迁移和去除方面的研究较少,ABPs在环境中的降解产物行为及毒性研究几乎空白,为土壤中ABPs的作用机理研究提供新的思考角度。关于ABPs对植物的生态毒性并未进行深入研究,可利用现代分子生物学技术探究ABPs在植物中的积累和降解机理,以此为受污染土壤的作物种植和含抗生素畜禽粪便的施用量提供可靠的参考依据。研究如何能够降低甚至去除环境中的ABPs及其耐药基因残留,是保护环境安全和人类健康的重要途径之一,现阶段对于ABPs的耐药基因的去除技术仅有堆肥工艺,因此有关ABPs及其耐药基因的去除技术仍需进一步研究。

