Cardiobacterium valvarum临床分离株的生物学特性研究及16S rRNA鉴定
徐晓涵,孙铭艳,刘言霞,王 楠,陶元勇
心杆菌属(Cardiobacterium)是两端圆形,具有多形性的革兰阴性杆菌,属于HACEK(心杆菌属、嗜血杆菌属、艾肯菌属、金杆菌属、放线杆菌属)组中的一员,作为人类正常的上呼吸道菌群,在其他粘膜表面少见[1-4]。正常情况下,该菌并不致病,但在免疫力低或者细菌定植部位发生改变时可能致病,其感染的危险因素包括:牙列不良、牙周炎、感染性心内膜炎(infective endocarditis,IE)、心脏解剖异常、内窥镜检查、心脏植入电子设备和人工心脏瓣膜等[5-6],感染的死亡率约为10%。
1962年,心杆菌属首次报道在IE的病原菌中,该菌经美国卫生署传染病中心鉴定命名为类巴斯德CDCgroup-Ⅱ-D杆菌[7],1964年,Slotnick等[8]对该菌进一步研究发现,其生化特征不同于巴斯德杆菌、嗜血杆菌等菌,因而命名为人心杆菌(Cardiobacteriumhominis,C.hominis)。在2004年之前,C.hominis一直是心杆菌属中的唯一物种,直到2004年,Han等人[9]从动脉瘤破裂而导致心内膜炎的病人中分离出一种不同于C.hominis的细菌,经鉴定为C.valvarum。该菌大部分情况下会导致心脏发生感染[3-4,10-11],但偶尔也会造成关节、骨髓等的感染[12-13]。目前对于C.valvarum的临床特点尚不完全清楚,研究发现C.hominis和C.valvarum的表型图谱非常相似,利用其表型特征很难区分两种细菌,而且该菌容易被误诊为多杀性巴氏杆菌[5]。虽然MALDI-TOF-MS鉴定该菌属的成功病例已被报道过[14-15],但目前认为该方法只能提供推测的鉴定依据,不能作为决定性的鉴定依据,要想准确鉴定C.valvarum,分子诊断的方法是必不可少的[16],本文通过16S rRNA基因测序技术对分离菌进行鉴定,对疾病的诊断具有重要意义。
1 材料与方法
1.1 病例资料 男,69岁,因2个月无明确原因的胸闷和憋气,活动后加剧,到本院就诊。病人曾有“脑梗死”病史6月余,没有留下后遗症,病情好转后出院。初次入院时体格检查:体温36.4 ℃,心率107次/min,脉搏18次/min,血压120/75 mmHg,二尖瓣听诊区可闻及3/6杂音,心脏超声:二尖瓣后叶脱垂并返流,多发赘生物,左房增大,严重的三尖瓣、肺动脉瓣返流,提示IE。实验室辅助检查:血沉101 mm/h,CRP 82 mg/g,血红蛋白88 g/L,免疫球蛋白G 25.4 g/L,补体C 30.77 g/L。根据血培养和影像学检查结果,诊断为IE、心脏瓣膜病、二尖瓣关闭不全(重度)、三尖瓣关闭不全(中-重度)、肺动脉高压等。入院后采血培养,在BacT/AERT 3D120全自动血培养系统中,需氧血培养瓶在孵育74~80 h后呈阳性。进行手术后,病理报告显示二尖瓣中性粒细胞浸润及坏死,给与舒普深药物抗感染治疗。术后20 d,感染得到控制,停用舒普深药物,给予三代头孢药物抗感染治疗,术后23 d,复查炎性因子基本正常,改用头孢他啶药物继续抗感染治疗。自抗感染治疗后血培养均为阴性,病人没有发烧、干咳、呼吸困难、胸痛等病症,病情稳定。
1.2 主要仪器及试剂 法国梅里埃公司的VITEK 2 Compact全自动微生物分析仪,美国Applied Biosystems公司的3730XL测序仪、2720 thermal cycler PCR 仪,北京六一仪器厂的DYCP-31DN DNA电泳槽、DYY-5稳压电泳仪,上海复日科技仪器有限公司的FR980凝胶成像仪,上海生工生物工程有限公司的SK8255 Ezup 柱式细菌基因组 DNA 抽提试剂盒和SK8131 SanPrep柱式DNA 胶回收试剂盒等。
1.3 细菌鉴定及药敏试验 取病人报阳性的血培养标本接种于哥伦比亚血平板,35 ℃培养74~96 h后观察菌落形态。选取单个菌落涂片进行革兰染色后镜检;使用GN卡、VITEK 2 Compact全自动微生物分析仪进行鉴定,按照说明书进行操作。采用E-test法进行药敏试验。
1.4 生化反应 上机鉴定该菌的生化反应特征,并与已发表的C.valvarum进行比较。
1.5 16S rRNA基因测序
1.5.1 细菌基因组DNA的提取 挑取哥伦比亚血平板上培养的单个菌落接种于肉汤培养基中,将细菌菌液过夜培养,第2 d取1 mL加入1.5 mL的离心管中,室温8 000 r/min离心1 min,弃上清,收集菌体。按照SK8255 Ezup柱式细菌基因组DNA抽提试剂盒说明书进行DNA的提取。
1.5.2 细菌16S rRNA的扩增 PCR反应体系:0.5 μL模板(基因组DNA20~50 ng/μL),2.5 μL 10×Buffer(含Mg2+),1 μL dNTP(各2.5 mmol/L),0.2 μL TaqDNA聚合酶,细菌的16S rRNA基因扩增采用两个通用细菌引物27F(5′-AGTTTGATCMTGGCTCAG-3′)和1492R(5′-GGTTACCTTGTTACGACTT-3′)。PCR反应条件:94 ℃预变性 4 min;94 ℃ 45 s,55 ℃ 45 s,72 ℃ 1 min,共30个循环;72 ℃修复延伸10 min。PCR产物1%琼脂糖经电泳进行观察(设置为150 V,100 mA,20 min),在自动凝胶成像系统上观察,对结果进行判定解析。
1.5.3 PCR产物回收及测序 从PCR产物电泳条带上切割所需要DNA目的条带,使用SK8131 SanPrep柱式DNA 胶回收试剂盒说明书上的提纯方法进行回收,所得产物交由上海生工生物工程有限公司进行DNA测序。
2 结 果
2.1 分离菌的鉴定及药敏试验 35 ℃ 5% CO2条件下在哥伦比亚血平板培养96 h,见到大小为0.5 mm,圆形、凸起、光滑、不透明、灰色、弱α-溶血的菌落(图1)。延长培养时间后,菌落大小几乎也达不到1 mm。机器显示unidentified Organism,上机鉴定未能鉴定该分离菌。取单个菌落涂片经革兰染色,镜下可见到小、两端圆形、革兰氏阴性的多形性杆菌,有时呈簇状排列,无鞭毛、无芽胞、无荚膜(图2)。药敏试验显示,该分离菌对青霉素、头孢噻肟、头孢曲松、复方新诺明、环丙沙星、亚胺培南、美罗培南、左旋氧氟沙星均敏感。
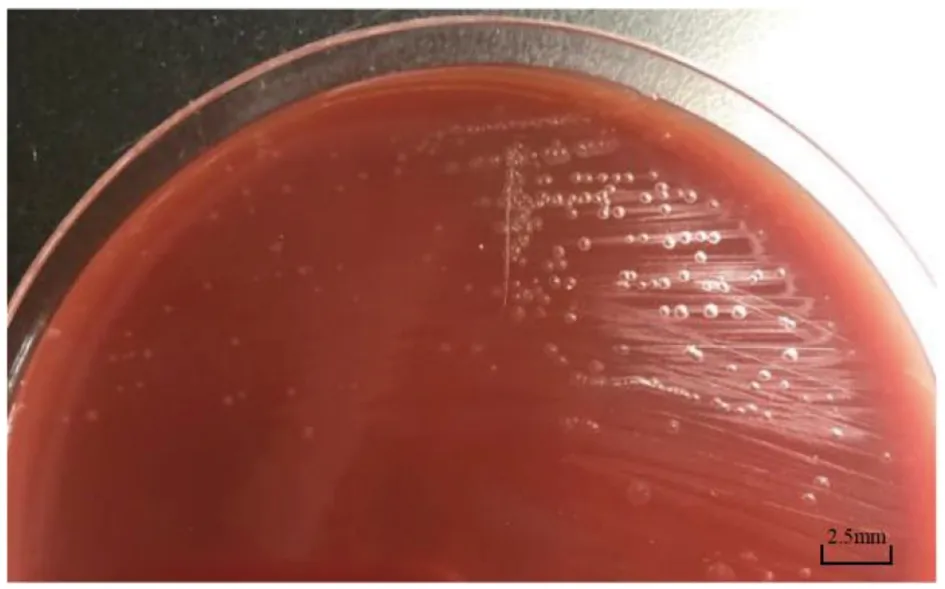
图1 培养96 h后菌落形态Fig.1 Bacterial colony after culturing for 96 h
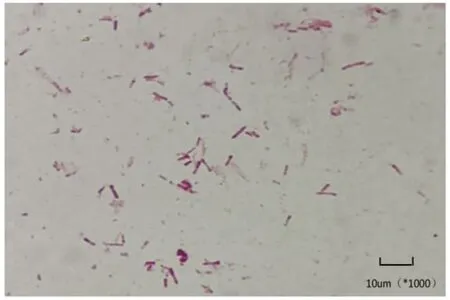
图2 分离菌镜下形态(革兰染色,10×100)Fig.2 Morphology of isolated strains under microscope(Gram staining,10×100)
2.2 分离菌的生化反应 生化反应结果如下:L-吡咯烷酮芳胺酶、L-阿拉伯醇、D-纤维二糖、β-半乳糖苷酶、β-N-乙酰氨基葡糖苷酶、β-葡糖苷酶、β-丙氨酸芳胺酶pNA、脂肪酶、古老糖、D-塔格糖、D-海藻糖、丙二酸盐、5-酮基-D-葡糖糖酸盐、L-乳酸盐碱化、α-葡糖苷酶、琥珀酸盐碱化、β-N-乙酰氨基半乳糖苷酶、甘氨酸芳胺酶、赖氨酸脱羧酶、L-组氨酸同化、香豆酸、β-葡萄糖醛酸酶、L-苹果酸盐同化、L-乳酸盐同化、柠檬酸盐均为阴性,谷氨酰芳氨酶pNA、谷氨酸-甘氨酸-精氨酸芳胺酶为阳性。分离菌与已发表的C.valvarum部分生化反应结果比较见表1。
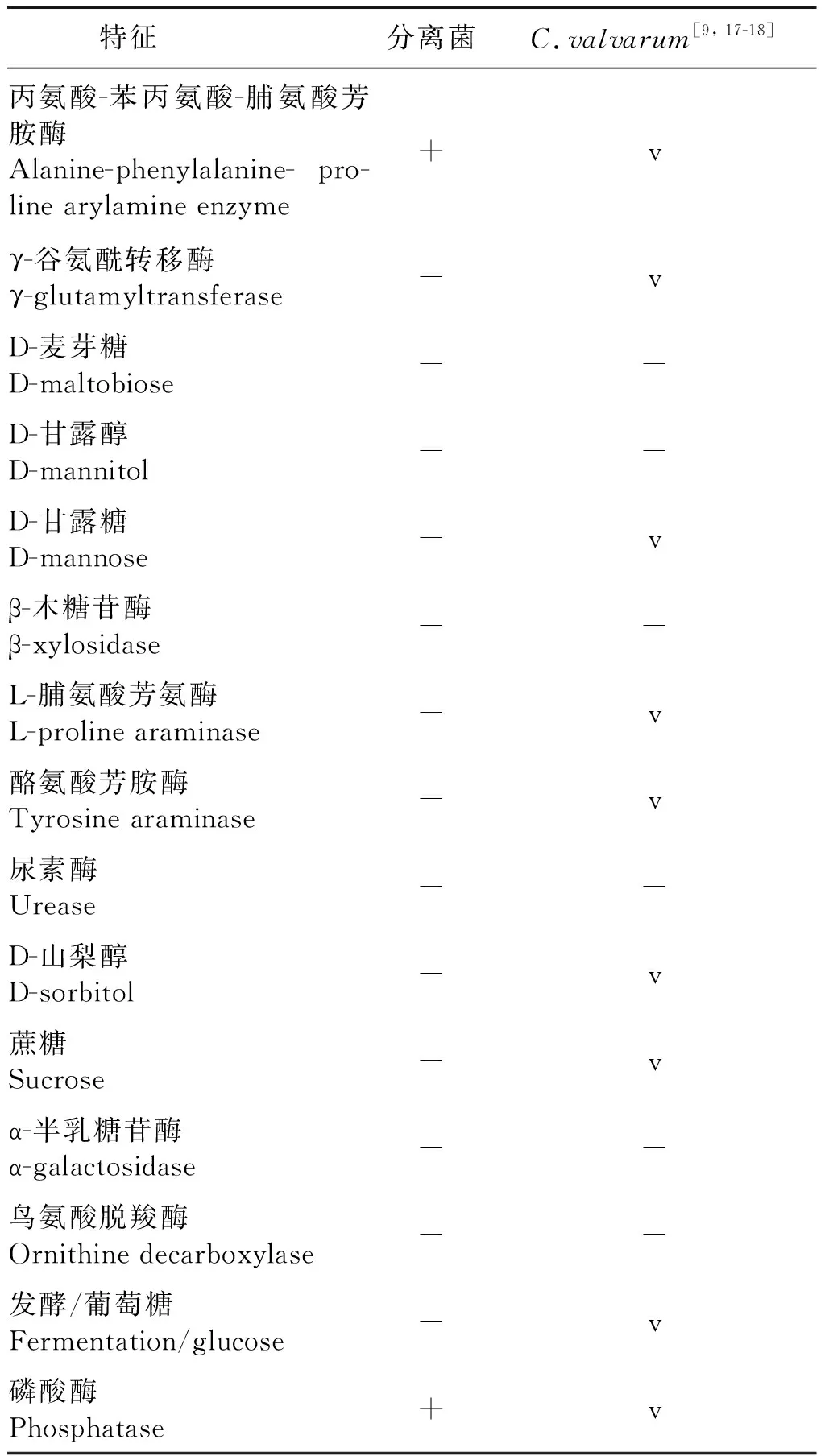
表1 分离菌与已发表的C. valvarum部分生化反应结果比较Tab.1 Comparison of partial biochemical reaction results between isolates strain and published by C. valvarum
2.3 16S rRNA基因测序分析 对分离菌的DNA进行扩增,在1%的琼脂糖凝胶上电泳,得到大小约为1 450 bp的扩增产物,在NCBI的BLAST网站进行测序分析后,发现该分离菌与已发表的C.valvarum菌株F0432(GenBank登录号:HM596295.1)的16S rDNA的同源性为99.59%,选择与之同源序列相似度高的菌株,使用MAGA 7.0.26软件,准备分离株、与分离株同源序列相似度高的菌株的序列文件(保存为fasta格式)。选择Align DNA,弹出的窗口中设置比对参数(一般采用默认参数),进行多序列比对(保存为masx格式)。进入MEGA 5主界面,点击Phylogeny,选择Construct/Test Neighbor-Joining Tree…弹出的对话框询问:弹出建树参数设置对话框,更改No. of Bootstrap Replications为1 000,其他参数默认即可,构建进化树,如图3所示,鉴定为C.valvarum。
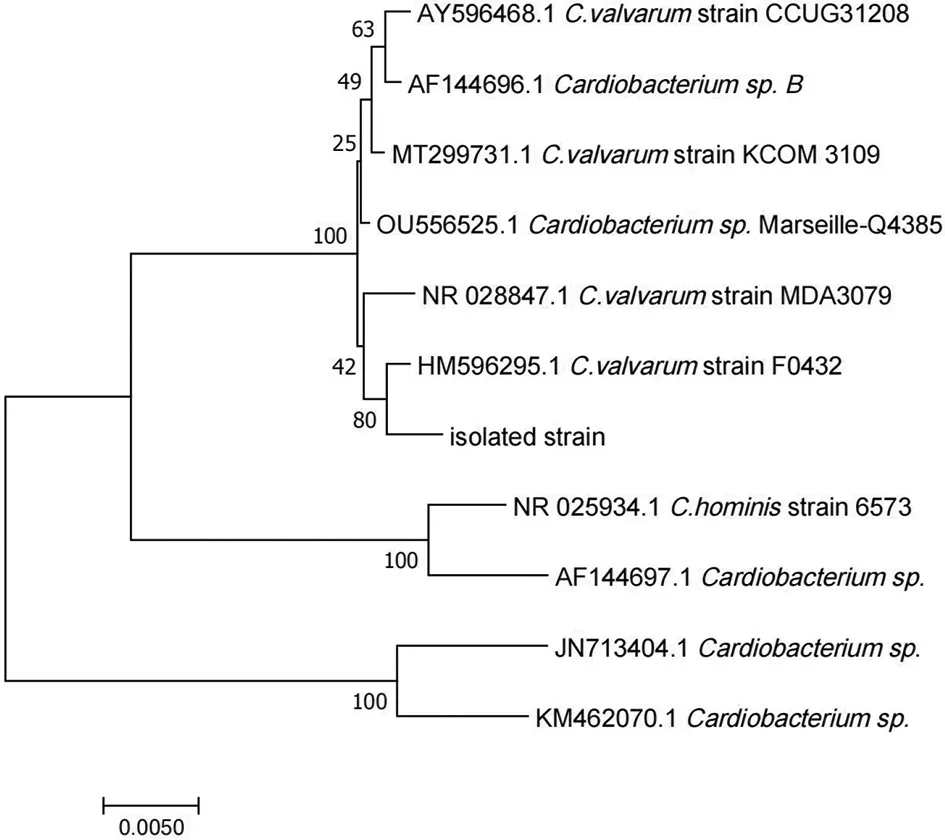
图3 分离菌的系统进化树Fig.3 Phylogenetic tree of the isolated strain
3 讨 论
近年来,C.valvarum引起的IE临床表现比较复杂,常常缺乏典型的症状,特别是老年患者,由于细菌C.valvarum生长缓慢,潜伏周期较长,因而会使病情逐步加剧,容易延误诊断。C.valvarum的革兰染色有时不均匀,是一种具有多形性的革兰阴性杆菌,在血琼脂平板上有轻微的α溶血[6]。研究发现,C.valvarum与C.hominis临床表现不同可能与C.valvarum生长缓慢有关[12],C.valvarum培养3~4 d后才可见到小菌落(0.5 mm),在延长培养时间后也达不到1.0 mm。而C.hominis在96 h后菌落直径可达2.2 mm。C.valvarum形态随培养基的不同而变化,当在血琼脂平板上生长时,它是一个相当大的常规杆菌;在巧克力琼脂平板上生长时,则变成了短小的杆菌[9]。在生化反应中,C.valvarum具有氧化酶的活性,可以发酵果糖、甘露糖和山梨醇,这些特点与C.hominis相似[18]。但C.valvarum可以产生细胞色素氧化酶,不产生过氧化氢酶,尿素水解、七叶苷水解和硝酸盐还原试验为阴性,可以利用果糖、山梨糖醇和甘露糖,但不利用麦芽糖、蔗糖或甘露醇,从而区别于C.hominis[9,17,19-20]。然而,目前对这些特性的描述并没有达成共识,不同的表型方法可能会给出不同的结果。
由于C.valvarum生长缓慢、营养要求较高,缺乏选择性培养基,在普通的琼脂平板上生长不良,因而进行药敏试验比较困难[21]。据报道,C.valvarum对各种抗菌药物都敏感[9,16-17,19,22-23],但目前已有对磺胺甲恶唑/甲氧苄啶类药物耐药菌株的相关报道[20],因而需要进一步积累药敏资料来验证相关药敏试验。目前的数据表明心杆菌属对常用的β-内酰胺类药物敏感,以前的病例大多使用β-内酰胺类药物治疗,预后良好[17,24]。根据IE预防、诊断和治疗指南(2009年版)[25]治疗非-内酰胺酶产生的HACEKIE的IE病例,静脉注射氨苄青霉素/青霉素加庆大霉素4周是一种选择。本例患者接受了舒普深药物抗感染治疗治疗1周后,给予第三代头孢菌素类药物治疗约3周,感染得到控制。
截止到目前为止,仅报道过为数不多的C.valvarum病例,由于该菌具有菌落形态、生化反应的不典型、不易分离和培养等的特点,加上各型仪器的数据库不完善,给该菌带来的疾病诊断造成了一定的难度。本次实验的分离株不能通过VITEK 2 Compact全自动微生物分析仪、MALDI-TOF-MS进行鉴定,这可能与病原菌的基因文库不完善有关,提示可以通过完善细菌的基因文库获得更多的细菌鉴定方法。16S rRNA测序可以得到C.valvarum明确的诊断,但仅仅依靠该技术对稀有菌进行鉴定是远远不够的,因此,对于一些罕见菌的鉴定我们可以首先考虑16S rRNA测序的方法,同时联合其他的分子诊断技术如多重PCR等方法对罕见菌进行综合分析,结合多种方法使罕见菌的鉴定更加精确可信,以便临床医生尽早对疾病做出准确判断。
利益冲突:无
引用本文格式:徐晓涵,孙铭艳,刘言霞,等.Cardiobacteriumvalvarum临床分离株的生物学特性研究及16S rRNA鉴定[J].中国人兽共患病学报,2022,38(7):614-618. DOI:10.3969/j.issn.1002-2694.2022.00.083

