重组酶聚合酶侧流层析技术检测新冠病毒核酸快速诊断方法的初步建立
张淼源,卢佩珊,李佳宁,李佳乐,郑炜欣,欧阳岁东
2019年底暴发的新型冠状病毒(SARS-CoV-2,以下简称新冠病毒)引起的肺炎疫情,对我国乃至全球的公共卫生体系、人民生命健康安全和国家经济发展形成了巨大威胁。截至2021年11月1日,新型冠状病毒肺炎(COVID-19)已在210多个国家或地区蔓延,全球累计新冠确诊病例超过2.4亿人,累计死亡病例达500万人[1],国外新冠疫情的蔓延程度远远超过国内,全球疫情防控形势仍处于高度严控状态,新冠肺炎防控形势依旧十分严峻。早诊断、早隔离、早预防免疫仍是目前防控新冠病毒肺炎蔓延扩散最有效的方法。因此,建立新冠病毒的快速、高效检测的方法在新冠肺炎疫情防控方面具有极其重要的意义。
目前新冠病毒的检测方法有抗原、抗体和核酸分子检测方法[2-4]。其中荧光定量PCR技术是进行分子诊断的金标准。然而荧光定量PCR诊断耗时长(一般需要4~5 h)、昂贵的反应仪器以及专业的技术操作人员等弊端限制了其应用范围。因此,亟需建立一种灵敏度高、操作方便、技术要求低的快速检测方法来进行及早检测。
重组酶聚合酶扩增技术(Recombinase polymerase amplification,RPA)是2006年英国TwistDx公司新开发的一种新型核酸恒温扩增技术[5],具有反应时间短、可在 37~42 ℃的恒温下实现对特定核酸序列的扩增和退火、检测结果易辨识等优点,并对仪器设备要求低,无需精密仪器即可完成反应,近年来发展十分迅速,已被广泛应用于病原学检测,公共食品安全等各个领域[6]。本研究拟根据编码新冠蛋白N基因的保守序列设计新冠病毒RPA引物和探针,从而构建一种新冠病毒的RPA-LFD检测方法,并验证该方法的灵敏度、特异性,从而为建立一种高效简便、灵敏度高、特异性强并适用于现场检测的即时检验(Point-of-Care Testing, POCT)技术方法奠定基础。
1 材料与方法
1.1 实验试剂及仪器 含新冠病毒N基因的质粒由山东大学高等研究所王培会教授惠赠;电泳级琼脂糖和DNA Ladder Marker购自宝生物大连生物技术有限公司; 质粒小提试剂盒和PCR产物纯化试剂盒购自美国OMEGA公司;TwistAmp○RBasic扩增试剂盒,TwistAmp○Rnfo RPA扩增试剂盒购自英国TwistDx公司;Milenia Genline HybriDetect胶体金侧向流动试纸条购自德国Milenia公司;流感病毒、副流感病毒、鼻病毒、腺病毒和呼吸道合胞病毒等核酸检测参考品均来自广东和信健康科技有限公司;PCR引物、RPA引物和探针由广州艾基生物技术公司合成。使用仪器包括PCR反应仪、水浴锅、单道移液器、振荡涡旋器、小型离心机。
1.2 病毒基因组的快速提取 参照快速核酸裂解液(通用型)(山东安普未来公司)的试剂盒操作说明书进行。
1.3 引物与探针的设计 根据中国疾病控制中心公布的新冠病毒N基因(Accession:: MT731346.1)的保守序列区域设计引物与探针,见表1。
1.4 引物的筛选和RPA反应体系的确定 首先利用普通PCR方法鉴定3对PCR引物,引物序列如上所示,PCR反应条件为95 ℃ 5 min, 94 ℃ 15 s、58 ℃ 15 s、72 ℃ 30 s、共32个循环, 72 ℃ 10 min 延伸。
根据TwistAmp○RBasic扩增试剂盒说明书进行RPA反应。 RPA扩增体系50 μL:将 RPA 上游引物2.4 μL(10 μmol/L),RPA下游引物 2.4 μL(10 μmol/L),ddH2O 11.2 μL,Rehydration Buffer 29.5 μL 预混后转入含有冻干酶制剂的 0.2 mL反应管中,混匀后加入2 μL 100 ng新冠病毒质粒模板及2.5 μL MgoAc (280 mmol/L)混匀并瞬离后置于39 ℃水浴锅中反应20 min用于扩增靶基因,反应后用PCR产物纯化试剂盒纯化PCR产物,最后取10 μL纯化的扩增产物进行琼脂糖电泳检测拍照。
最后根据TwistAmp○Rnfo RPA扩增试剂盒说明书进行RPA-LFD反应。RPA反应在37 ℃水浴锅中反应20 min用于扩增靶基因,然后取出5 μL扩增产物稀释到装有95 μL试纸条测试缓冲液EP管中进行试纸条检测, 观察试纸条条带出现后在5 min内完成读取。
1.5 敏感性实验 用含有新冠病毒N基因的质粒作为RPA的标准品,以10倍的梯度稀释,加入体系以最优反应条件扩增,反应结束后用侧流试纸检测,来验证引物与探针的敏感性,质粒的初始浓度为10 ng/反应。
1.6 特异性实验 分别用流感病毒、副流感病毒、鼻病毒、腺病毒通过核酸快速释放液裂解病毒,吸取同样体积的裂解液,加入体系以最优反应条件扩增,反应结束后用侧流试纸检测,验证引物与探针的特异性。
2 结 果
2.1 RPA引物的筛选及RPA方法的验证 为了获得特异性强,扩增效果好的RPA的引物,我们分析了不同新冠病毒株N基因的保守序列区域,我们设计了3对RPA引物,通过PCR方法对含有新冠病毒N基因的质粒进行扩增,结果显示RPA-Primer1引物扩增效果最好(图1)。 进而根据TwistAmp Basic试剂盒要求操作测试用RPA检测新冠病毒核酸 (图2), 以试剂盒中提供的引物和阳性样品的RPA反应作为参考显示RPA反应体系工作正常,我们用新冠病毒RPA-Primer1引物可以检测到新冠病毒核酸的存在。因此,RPA-Primer1引物可以作为建立检测新冠病毒侧流层析试纸条的候选引物。
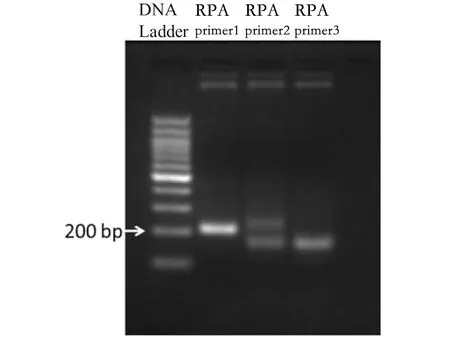
图1 新冠病毒的RPA引物的筛选Fig.1 Screening of RPA primers for SARS-CoV-2

图2 TwistAmp Basic试剂盒检测新冠病毒核酸Fig.2 Detecting SARS-CoV-2 nucleic acid by TwistAmp Basis kits
2.2 RPA-LFD反应条件优化 根据RPA侧流层析试纸检测的要求,我们对RPA-Primer1引物进行修饰,增加侧流层析试纸检测探针,按照TwistAmpTMnfo试剂盒的操作说明建立新冠病毒核酸的RPA-LFD的检测方法。为了获得最佳的反应条件,我们对RPA-LFD的反应时间和温度进行了测试(图3A-B), 结果显示RPA-LFD检测新冠病毒核酸的最佳反应温度为37~40 ℃最佳的反应时间是15~20 min,所以我们选择建立的RPA-LFD检测新冠病毒核酸的最佳反应体系为:反应温度为37 ℃,反应时间为15 min。

图3 RP-LFD检测新冠病毒核酸的反应温度(A)和时间(B)的选择Fig.3 Temperture (A) and time (B) course of RPA-LFD assay for SARS-CoV-2 nucleic acid detection
2.3 灵敏度试验 分别选取系列稀释度模板浓度进行RPA-LFD扩增,反应在37 ℃,15 min后读取 LFD结果,RPA-LFD反应检出新冠病毒核酸的极限可低至100 fg/反应(图4)。

图4 RPA-LFD检测新冠病毒核酸的灵敏度Fig.4 Sensitivity test for SARS-CoV-2 nucleic acid detection by RPA-LFD assay
2.4 特异性试验 该反应体系对新冠病毒、流感病毒、副流感病毒、鼻病毒和腺病毒进行特异性检测,结果显示RPA-LFD只对新冠病毒有特异性反应,而对流感病毒、副流感病毒、鼻病毒和腺病毒没有交叉反应(图5)。 该结果表明本方法可以特异性扩增并检测新冠病毒,具有良好的特异性。

图5 RPA-LFD检测新冠病毒核酸的特异性Fig.5 Specificity test for SARS-CoV-2 nucleic acid detection by RPA-LFD assay
3 讨 论
由新冠病毒引起的COVID-19已蔓延至全球几乎所有国家和地区。 建立快速准确的筛查对于控制SARS-CoV-2的持续传播极为重要。 目前新冠病毒的筛查和诊断任务主要还依赖于实验室中的荧光定量PCR技术。然而这一技术依赖于贵重的仪器和专业人士的操作,对于基层医院和广大农村地区检测很难进一步推广。解决这种检测困境的方法之一是开发更人性化的检测技术,且该技术可用于非专业实验室环境甚至家庭测试。通过采用LAMP等温扩增方法与金标准RT-qPCR方法相比显示出更多优点,如仪器依赖性更低、速度更快、特异性更好。然而,在大多数这些等温扩增技术中,重组酶聚合酶扩增技术具有独特的优势,反应时间短、灵敏度高、特异性强、检测产物方式多样化、操作简单,可为实现基层医院和偏远地区的快速检测。
本研究利用RPA技术,通过侧流层析试纸条LFD建立的新冠病毒RPA-LFD检测方法, 针对新冠病毒的保守序列设计了引物和探针,该方法的反应体系最佳温度为37 ℃,最佳反应时间为15 min,从反应开始,可在5 min后用 LFD检测到扩增产物的存在,该检测方法可以直接读取结果,不需要电泳仪,特异性强,对流感病毒、副流感病毒、鼻病毒和腺病毒等呼吸系统感染性病毒均没有交叉反应;灵敏度高,检测限低至100 fg/反应。同时操作简便,检测耗时短,在现场快速检测诊断方面具有显著的优越性。目前国际上也已有相关基于RPA技术检测新冠病毒的报道[7-10],但本研究建立的新冠病毒RPA-LFD的检测方法因为37 ℃的最佳反应温度可更适合为新冠病毒肺炎现场快速诊断及防控提供技术参考。尽管如此,RPA-LFD方法仍然存在一些缺点,需要不断改进,例如RPA引物探针本身存在着 “噪音”现象,即随着时间的推移,阴性对照可能会在试纸条上慢慢出现轻微的检测线。 目前本研究采用控制LFD结果读取时间(5 min以内), 使用Image J对检测线进行灰度分析,提高结果判定的客观性。由于新冠病毒临床样品目前基于各种条件难以采集,因此我们没有开展RPA-LFD检测新冠病毒快速诊断方法在临床上的样品验证。在以后收集新冠临床样品后,我们将进一步完善建立RPA-LFD检测新冠病毒方法。
综上所述,本研究建立的新冠病毒核酸RPA-LFD检测方法具有较高的特异性和敏感性,操作简便,适用于现场快速检测。该方法具有在现场快速检测和基层医疗卫生机构大规模检测使用的潜力。
利益冲突:无
引用本文格式:张淼源,卢佩珊,李佳宁,等. 重组酶聚合酶侧流层析技术检测新冠病毒核酸快速诊断方法的初步建立[J].中国人兽共患病学报,2022,38(7):577-581. DOI:10.3969/j.issn.1002-2694.2022.00.077

