纤恙螨属线粒体基因组研究进展
杨慧娟,董文鸽
恙虫病又称丛林斑疹伤寒,通过恙螨叮咬引起,是世界上危害严重的一类人兽共患寄生虫病,既往曾被列为我国法定传染性疾病[1-2]。纤恙螨属Leptotrombidium隶属于动物界Animalia、节肢动物门Arthropoda、蛛形纲Arachnida、蜱螨亚纲Acari、真螨总目Acariformes、前气门目Prostigmata、恙螨科Trombiculidae[3]。全世界记录了近3 000种恙螨,在中国已报告500余种[4]。恙螨生活史比较复杂,分为7个时期:包括卵、次卵、幼虫、若蛹、若虫、成蛹和成虫[5]。除幼虫必须营寄生生活以外,其他生活史时期均为营自由生活[6]。幼虫导致的直接危害是形成以黑褐色焦痂为特征的恙螨性皮炎。目前已测序的3种纤恙螨(红纤恙螨Leptotrombidiumakamushi、地里纤恙螨Leptotrombidiumdeliense和苍白纤恙螨Leptotrombidiumpallidum)均为恙虫病的重要传播媒介恙螨[7]。
线粒体存在于大多数真核生物细胞,为各种生命活动提供能量,是进行有氧呼吸的主要场所[8]。线粒体基因组是一般大小为15~20 kb的闭合双链环状分子,共37个基因,包括22个tRNA基因、13个蛋白编码基因(nad1-6;nad4L;cox1-3;cob;atp6;atp8)和2个rRNA基因(rrnS和rrnL),通常还包括一段较长的非编码区[9-10]。近年来,随着新一代高通量测序技术的兴起以及技术的逐渐成熟,越来越多蜱螨线粒体全基因组被测定。据NCBI基因组数据库统计,纤恙螨属仅3种恙螨提交了线粒体基因组全序列。
本文综述了3种纤恙螨(苍白纤恙螨,登录号: NC_007177);红纤恙螨,登录号: NC_007601)和地里纤恙螨,登录号: NC_007600)线粒体基因组的分子结构、非编码区、碱基组成、蛋白编码基因、基因重叠与基因间隔、tRNA和rRNA基因特征,分析纤恙螨属线粒体基因组独特的结构特征和变异情况,为进一步了解恙螨的分子进化、系统发育研究提供更多的证据。
1 纤恙螨属线粒体基因组的结构特点
迄今为止已测序的3种纤恙螨(苍白纤恙螨、红纤恙螨和地里纤恙螨)线粒体基因组均为闭合环状分子,大小分别为16 779 bp、13 698 bp、13 731 bp[11]。后生动物典型的线粒体基因组包括22个tRNA基因、13个蛋白编码基因、2个rRNA基因以及1个非编码区(也叫控制区)(NCR)[12]。3种纤恙螨非编码区的数量不止1个,红纤恙螨和地里纤恙螨有2个非编码区,苍白纤恙螨有4个非编码区。大多数后生动物线粒体基因组编码2个rRNA基因(rrnL和rrnS),但在苍白纤恙螨中,多了一个大亚基rRNA基因(rrnL)和一个小亚基rRNA假基因(PrrnS),且长度只有rrnS的一半[13]。一般来说,线粒体基因含量和排列在较低分类水平(科和属)上是保守的,而在较高分类水平(门)上差异较大[14]。比较3种纤恙螨与节肢动物祖先以及前气门目部分物种的线粒体基因组,发现不同科之间线粒体基因排列有很大不同,且同属内不同物种的基因排列也存在较大差异(图1)。首先,与节肢动物祖先线粒体基因组相比,红纤恙螨和地里纤恙螨有29个不保守基因边界,11个保守基因边界;苍白纤恙螨有34个不保守基因边界,10个保守基因边界。其次,蚌螨属2个物种显示了2种类型的基因排列(图1),基因簇trnA-nad3-trnF-trnT-trnY-trnN-trnL1-CR-trnH-trnS1-nad4-trnR-trnV却是共有的,说明这个基因簇是蚌螨属的共有衍征;蠕形螨属2个物种显示了种类型的基因排列,共享2个基因簇trnL1-trnV-rrnS-trnF和trnM-trnN-trnS1-trnE;同样,纤恙螨属3个物种显示2种类型的基因排列(图1),4个衍生的基因簇trnH-nad4L-trnL1-trnT-trnL2-nad1-trnY、trnS1-trnP-nad4-R-V、trnD-atp8-atp6-cox3-trnE-trnG-trnN和trnW-nad5-trnF-trnA-nad3是纤恙螨属的共有衍征[15-18]。
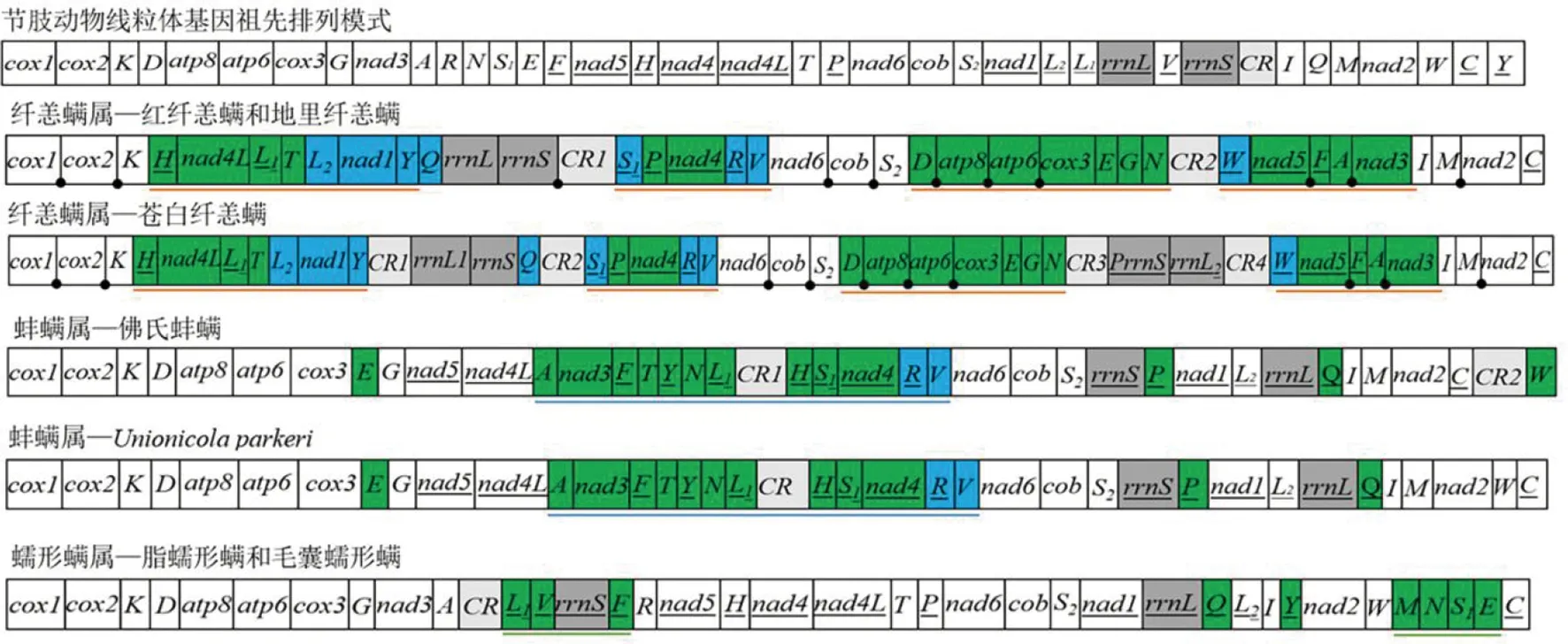
注:下划线表示基因在N链上。蓝色表示反向移位,绿色表示仅发生移位,rrnS和rrnL用深灰色表示,控制区用浅灰色表示。下划线表示共享的基因簇。图片下方的圆圈表示保守的基因边界。图1 节肢动物祖先以及前气门目部分物种的线粒体基因排列顺序[11]Fig.1 Mitochondrial gene arrangement order in arthropod ancestors and in some species of Prostigmata[11]
2 线粒体基因组非编码区
线粒体基因组中最大的非编码区叫做控制区(control region),负责线粒体DNA复制和转录的起始,控制区的进化速度比线粒体DNA其他区域快3~5倍[19]。因此,控制区序列广泛用于遗传多样性[20]、种类鉴定[21]、群体遗传结构和起源进化[22]等研究。在昆虫中,由于控制区A+T含量较高,也称控制区为A+T富集区(A+T-rich region)[23]。3种纤恙螨非编码区A+T含量在59.54%~66.71%之间。控制区的长度在不同分类群中差异很大,甚至在亲缘性较高的物种之间也是如此[24]。苍白纤恙螨控制区总长度为2 742 bp(表1)。红纤恙螨和地里纤恙螨控制区总长度分别为521 bp和591 bp(表1)。这就解释了为什么苍白纤恙螨的线粒体基因组要比另外2种纤恙螨的线粒体基因组大。红纤恙螨和地里纤恙螨2个控制区大小相近,苍白纤恙螨4个控制区大小不同,且3种纤恙螨控制区的核苷酸序列几乎相同。由于协同进化导致控制区核苷酸序列高度相似[25],可推测这3种纤恙螨是协同进化而不是独立进化。只有独立进化才能导致控制区核苷酸序列的差异,最终导致其中某一个控制区退化或缺失[26]。此外,重复控制区的碱基替换速率低于非重复控制区的碱基替换速率。所以,在使用控制区作为系统发育标记之前,应检查线粒体基因组排列是否存在重复控制区,以避免重复控制区对系统发育估计的负面影响[27]。控制区在后生动物中相对保守,通常位于rrnS和rrnL之间[28],但3种纤恙螨控制区的位置具有极强的变异性(图1)。
有研究表明,动物线粒体基因组控制区长度的变化都是由串联重复序列的重复类型及重复次数引起,因此控制区被认为是线粒体基因组DNA序列和大小变异的主要来源[29-30]。这一结论在鱼类、哺乳类、鸟类、爬行类和昆虫等线粒体基因组研究中得到了证实[31-32]。目前仅在狄斯瓦螨Varroadestructor和户尘螨Dermatophagoidespteronyssinus的控制区中发现存在串联重复序列[33-34]。通常认为DNA复制过程中的滑链可导致串联重复序列的出现[35]。3种纤恙螨控制区均未存在串联重复序列,说明这3种纤恙螨在线粒体基因组复制过程中没有发生DNA滑链现象。
3 纤恙螨属线粒体基因组的碱基组成
3种纤恙螨A+T含量分别为67.47%、69.95%、70.96%,G+C含量分别为32.53%、30.05%、29.04%(表1)。发现红纤恙螨和地里纤恙螨的A+T含量略低于螨类线粒体基因组的平均A+T含量(75.34±4.78%)[36],只有苍白纤恙螨的A+T含量在螨类线粒体基因组的平均A+T含量范围内。3种纤恙螨A+T含量与G+C含量两两之间相差不大,一般情况下,同科或同属之间A+T与G+C含量相近[37]。后生动物线粒体基因组在核苷酸组成上通常表现出明显的链偏向[38]。这被认为是由于一种不对称的突变模式导致,其中一条链在转录和复制过程中暂时保持单链状态,使DNA更容易受到损伤[39]。核苷酸链偏向可以用AT-偏斜和GC-偏斜来测量(分别为(A%-T%)/(A%+T%)、(G%-C%)/(G%+C%))[40]。3种纤恙螨线粒体基因组AT-偏斜与GC-偏斜均为负值,AT-偏斜与后生动物线粒体基因组典型的链偏向(AT-偏斜为正,GC-偏斜为负)相反,GC-偏斜则相同(表1),造成这种链偏向的逆转可能是控制区倒置的结果,因为控制区倒置受线粒体DNA的不对称突变约束影响[41]。此外,在螨类线粒体基因组中,似乎很少见到正GC-偏斜。但3种纤恙螨cox1基因第3密码子的AT-偏斜和GC-偏斜与后生动物典型的链偏向相反(表2),cox1基因在核苷酸和氨基酸水平上进化最慢[42]。
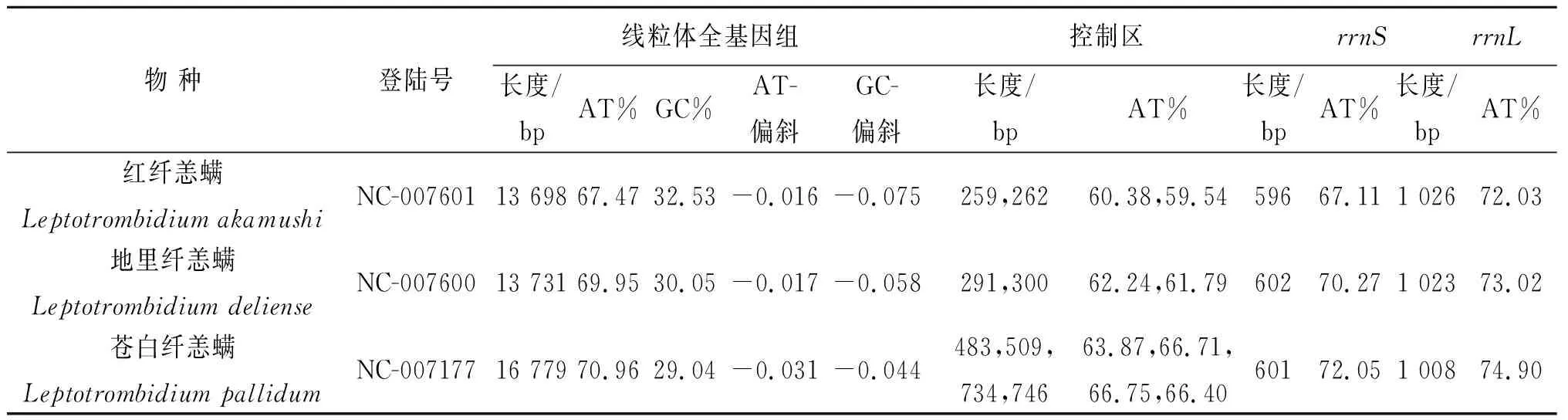
表1 3种纤恙螨线粒体基因组的核苷酸组成Tab.1 Nucleotide composition of the mitochondrial genomes of three species of the genus Leptotrombidium
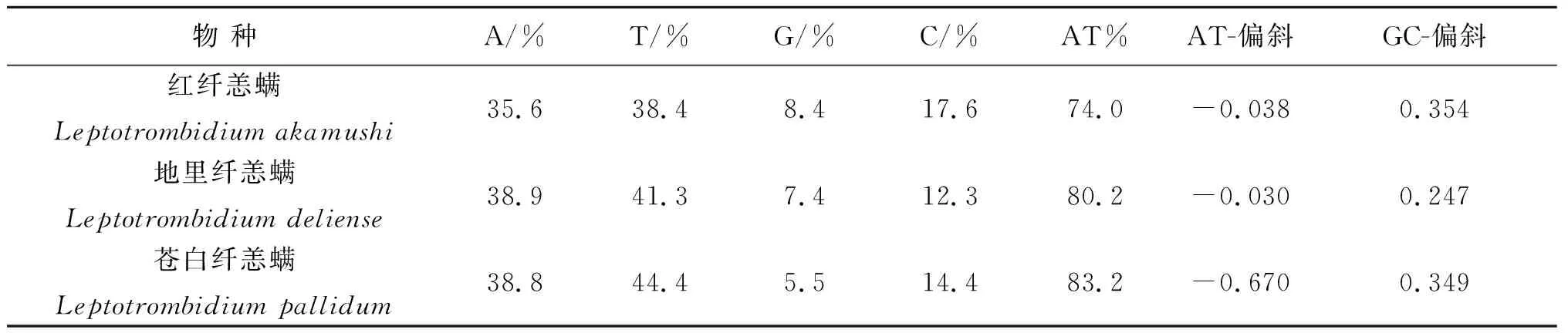
表2 蛋白编码基因cox1第3密码子的核苷酸组成[43]Tab.2 Nucleotide composition at the third codon of the protein-coding gene cox1[43]
4 纤恙螨属蛋白编码基因
线粒体基因组13个蛋白编码基因进化速率不一致,通常用作DNA条形码分子标记来鉴定物种以及作为种下阶元研究亲缘关系[44]。3种纤恙螨蛋白编码基因大多以标准的ATN(ATA、ATT、ATG、ATC)为起始密码子,少数使用非标准的起始密码子,如苍白纤恙螨nad4基因以TTG为起始密码子。特殊的起始密码子可以缩短基因间距,避免基因重叠现象,其转录后经过编辑可以形成正确的起始密码子来执行功能[45]。线粒体基因组13个蛋白编码基因大多以TAA、TAG及不完整的T或TA为终止密码子。红纤恙螨和地里纤恙螨有6个蛋白编码基因(cox1、cox3、nad2、nad6、atp6、atp8)的终止密码子是TAA,另外7个蛋白编码基因以不完整的密码子作为转录终止信号(6个T,1个TA);苍白纤恙螨有7个蛋白编码基因以TAA或TAG为终止密码子(6个TAA,1个TAG),其他6个蛋白编码基因,4个以T作为转录终止信号,2个以TA作为转录终止信号。不完整的终止密码子通过转录后经多聚腺苷酸化修饰最终形成完整的终止密码子[46]。昆虫线粒体蛋白编码基因A+T含量相对较高(64.00%~86.70%)[47]。3种纤恙螨(红纤恙螨、地里纤恙螨和苍白纤恙螨)蛋白编码基因A+T含量分别为67.20%、70.10%、71.40%,说明纤恙螨属线粒体基因组13个蛋白编码基因的A+T含量比大部分昆虫低。
5 纤恙螨属线粒体基因组基因重叠区与基因间隔区
基因重叠区是指同一段核酸序列参与不同基因编码的现象;基因间隔区是指线粒体基因组中编码基因之间存在的非编码序列,大小变化很大。大部分昆虫的线粒体基因组基因之间排列比较紧密,基因重叠区和基因间隔区较少[48]。3种纤恙螨的线粒体基因组有多处基因重叠区和基因间隔区。红纤恙螨有3个基因重叠区,地里纤恙螨有5个基因重叠区,重叠范围均在1~4 bp;苍白纤恙螨有10个基因重叠区,重叠范围在1~13 bp。红纤恙螨的基因间隔区有15个,间隔范围在1~31 bp;地里纤恙螨的基因间隔区有8个,间隔范围在1~10 bp;苍白纤恙螨的基因间隔区有9个,间隔范围在1~746 bp。间隔基因的出现一般促进生物进化,因为间隔基因有利于更多遗传信息储存和变异概率增多。
6 纤恙螨属线粒体tRNA和rRNA基因特征
真螨总目tRNA基因的平均大小[平均值为(54.8±1.0) bp]比寄螨总目[平均值为(62.0±1.3)bp]tRNA基因的平均大小要小很多,导致部分tRNA基因无法形成典型的三叶草式二级结构,即: 缺失D臂或缺失T臂或同时缺失D臂和T臂[49]。通常,后生动物线粒体基因组22个tRNA基因只有丝氨酸的tRNA(trnS1(AGN))基因缺失D臂,而其他tRNA基因缺失D臂现象较为罕见[50]。因此,后生动物丝氨酸的tRNA基因缺失D臂被认为是一个祖征[51]。3种纤恙螨tRNA基因断臂现象十分常见,红纤恙螨和地里纤恙螨有17个tRNA基因缺少D臂或T臂,苍白纤恙螨有18个tRNA基因缺少D臂或T臂;红纤恙螨和地里纤恙螨有7个tRNA基因(trnC、trnF、trnH、trnP、trnQ、trnT和trnW)缺失T臂,苍白纤恙螨在这2种纤恙螨缺失T臂的基础上还多了trnL2缺失T臂,但3种纤恙螨缺失D臂的10个tRNA基因(trnA、trnG、trnI、trnL1、trnN、trnR、trnS1、trnS2、trnV和trnY)是相同的(表3)。Shao RF等推测苍白纤恙螨18个tRNA基因非典型的二级结构不影响正常的生理功能[15]。已有研究表明,猪蛔虫tRNA基因缺少D臂或T臂具有正常的生理功能[52],线粒体tRNA基因缺失D臂或T臂的原因可能是这些tRNA基因在翻译时和它们相互作用的蛋白质是在细胞核中编码所造成的[53]。然而,蛛形纲动物似乎有一种补偿机制,允许截短的tRNA基因在翻译时与核糖体相互作用来维持这些tRNA基因的功能以此来减少突变发生[54]。
3种纤恙螨2个rRNA基因分别编码大亚基rrnL和小亚基rrnS,2个rRNA基因(rrnS和rrnL)在其它螨类以及大多数节肢动物线粒体基因组中均由轻链(N-链)编码[55]。红纤恙螨和地里纤恙螨的2个rRNA基因均位于重链(J-链)上。苍白纤恙螨的2个rrnL基因,一个rrnL基因位于轻链(N-链)上,另一个rrnL基因位于重链(J-链)上[56]。3种纤恙螨rrnS基因A+T含量分别为67.11%、70.27%和72.05%(表1),均不在螨类rrnS基因范围内(76.5±4.2)%。rrnL基因A+T含量分别为72.03%、73.02%和74.90%(表1),只有苍白纤恙螨rrnL基因A+T含量在螨类rrnL基因范围内(78.0±4.1)%[33]。与雅库巴果蝇相比,3种纤恙螨rrnL基因都缺失螺旋B9、B11、B12、B20、C1、D1、CD1和H3,但复合螺旋D17-D18-D19却是独有的[57]。螺旋E2和E19只有苍白纤恙螨单独缺失,且螺旋H2高度保守。rrnS基因缺少螺旋1、2、4、5、6、7、8和12,复合螺旋19-20-21和39-40-42具有与其他节肢动物完全不同的二级结构[58]。有研究表明,rRNA基因大小的减少可能与tRNA基因缺失T-臂之间存在着某种关联[59]。
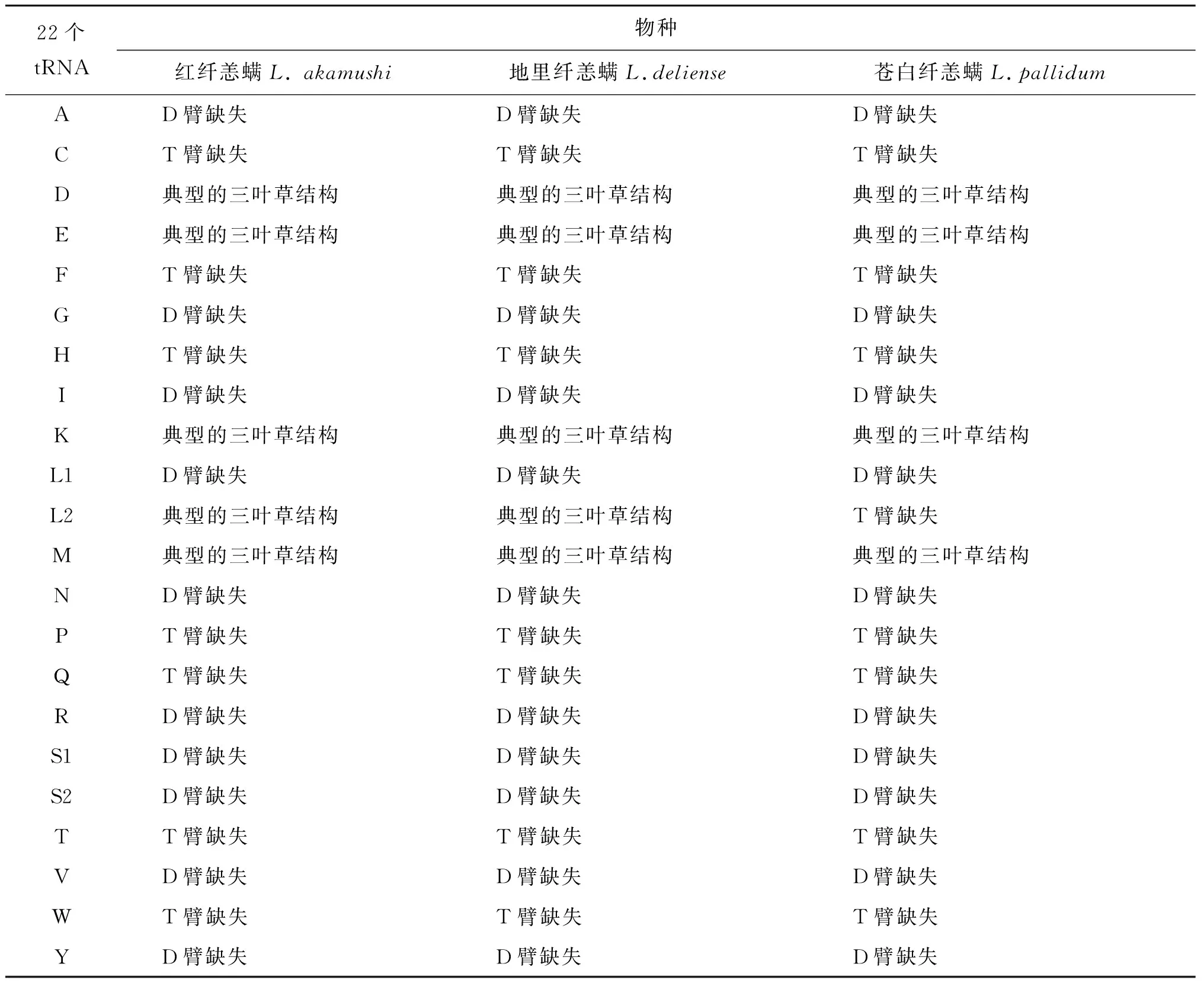
表3 3种纤恙螨tRNA基因缺D臂和T臂的情况[51]Tab.3 Three species of the genus Leptotrombidium tRNA genes lacking the D and T arms[51]
7 讨论与展望
对纤恙螨属3种纤恙螨线粒体基因组的分子结构、非编码控制区(A+T富集区)、碱基组成、蛋白编码基因、基因重叠与基因间隔、tRNA基因和rRNA基因特征进行了初步分析,发现与节肢动物祖先有很多不同之处。3种纤恙螨tRNA和rRNA基因比其他蜱螨亚纲物种要小很多,rRNA基因大小的减少可能与tRNA基因缺失T-臂之间存在着某种关联,Yamazaki N等人认为tRNA和rRNA基因大小的减少反映了线粒体基因组一种独特的趋势,即线粒体基因组的最小化[60],他提出的这种假设还有待验证。苍白纤恙螨tRNA基因非典型二级结构不影响tRNA基因的正常功能,另外2种纤恙螨部分tRNA基因非典型二级结构是否对某些功能造成影响还不得而知,目前也没有发现同时缺少D-臂和T-臂的tRNA基因是否影响其正常功能。后续可以采取更多的实验方法,进一步探究缺乏D-臂或T-臂或同时缺失D-臂和T-臂的tRNA基因是否具有正常生物学功能。
3种纤恙螨协同进化能否判断纤恙螨属中所有物种都是协同进化还是某些物种是独立进化,或者这3种纤恙螨成为恙虫病的传播媒介恙螨是否与多个非编码区有关,仍是一个有待钻研的问题。3种纤恙螨cox1基因第三密码子位置的AT-偏斜和GC-偏斜与后生动物典型的链偏向相反,是不是可能与cox1在核苷酸和氨基酸水平上是进化最慢的基因有关?因此,需要加强对纤恙螨属线粒体基因组学的研究来说明这种解释是否成立。
总之,通过比较和归纳现有纤恙螨属线粒体基因组的结构特征和变异情况,其将为全面认识蜱螨亚纲线粒体基因组提供新的科学依据,3种纤恙螨的这些独有特征是否是整个纤恙螨属的特征还有待研究,因此,在今后的研究中,应该不断扩大和丰富恙螨线粒体基因组的测序规模,从线粒体基因组角度出发,更好地对恙螨科系统进化甚至是物种起源进行准确分析,我国是受恙虫病危害较严重的国家,而纤恙螨属是传播恙虫病的重要媒介。结合我国恙虫病流行的实际开展恙螨研究,在丰富蜱螨亚纲基因组数据库的同时,也促进了螨媒物种多样性的研究,在一定程度对流行性出血热及其媒介革螨的预测、预警、防控具有直接的指导价值和现实意义。
利益冲突:无
引用本文格式:杨慧娟,董文鸽. 纤恙螨属线粒体基因组研究进展[J].中国人兽共患病学报,2022,38(7):649-656. DOI:10.3969/j.issn.1002-2694.2022.00.084

