肌酐冰冻人血清国家标准品的研制
于婷,蔡华,孙晶,胡泽斌,曲守方
·技术与方法·
肌酐冰冻人血清国家标准品的研制
于婷*,蔡华*,孙晶,胡泽斌,曲守方
100050 北京,中国食品药品检定研究院体外诊断试剂所(于婷、孙晶、胡泽斌、曲守方);611731 成都,迈克生物股份有限公司参考系统部(蔡华)
肌酐是水溶性的有机含氮化合物。血清中的肌酐主要是由肌肉组织中磷酸肌酸和肌酸通过非酶促、不可逆的脱磷酸反应生成的代谢终产物,并由肾脏排出。由于肌酐从肾小球滤过后不被肾小管重吸收,受饮食因素影响也小,因此血清肌酐和内生肌酐清除率更能准确反映肾小球滤过率(GFR)即肾脏的排泄功能。目前临床上将 GFR 作为慢性肾脏病诊断与分期的依据,准确检测肌酐具有重要的临床意义[1-3]。
虽然国际上已有肌酐血清基质的标准品(SRM967a,美国国家标准和技术学会研制),但费用较高,且采购周期长,国内虽亦有肌酐血清型国家标准品,但多以研究为主,数量不足以满足国内百余家肌酐检测试剂盒厂家溯源用以及临床应用。因此本实验室开展了血清型肌酐国家标准品的研制工作,一方面为了满足各方需求,另一方面也将进一步促进血清肌酐测定的标准化。
1 材料与方法
1.1 材料
1.1.1 仪器 2XZ-1 旋片式真空泵购自临海谭氏真空设备公司;78-1 磁力搅拌器购自常州国华公司;Multipette M4 连续分液器购自德国 Eppendorf 公司;ML625-DLL 分液装置购自瑞士汉密尔顿公司;磁力搅拌器购自宁波群安实验仪器有限公司;2034C-02 真空抽滤装置购自天津津腾实验设备有限公司;Triple Quad 5500 液相色谱串联三重四级杆液质联用仪、AB5500 液相色谱串联质谱仪、AB API5500 Agilent 1260超高效液相色谱-质谱联用仪购自美国 Applied Biosystems 公司;7180 生化分析仪购自日本日立公司。
1.1.2 试剂盒 均匀性和稳定性评价用试剂盒为迈克生物股份有限公司生产的肌酐测定试剂盒(肌氨酸氧化酶法),批号 1220081;互通性评价用试剂盒为肌酐测定试剂盒(肌氨酸氧化酶法)分别为迈克生物股份有限公司产品,批号 1220081;上海科华生物工程股份有限公司产品,批号20200412;美康生物科技股份有限公司产品,批号 20104101;中生北控生物科技股份有限公司产品,批号 200811。
1.2 方法
1.2.1 候选品制备 收集外观清澈透明,无溶血、黄疸和乳糜的血清,并检测梅毒螺旋体抗体、人类免疫缺陷病毒抗体、乙肝病毒表面抗原和丙肝病毒抗体。将上述传染病四项为阴性的血清,采用肌酐检测试剂盒进行测值后,按照正常(水平 I)及异常(水平II)分别合并成 2 份大样,充分混匀后,三重过滤及除菌。将上述处理后的血清按照0.5 ml 分装,共分装 2000 套(2 支/套)。最后于–70 ℃条件下保存。
1.2.2 均匀性评价 按照 JJF 1343-2012《标准物质定值的通用原则及统计学原理》[4]评价,采用单因素方差法进行分析。标准规定,总体数目大于或等于 1000 时,抽取数目不少于 30 个。肌酐候选品分装 2000 套,因此每水平随机抽取 30 支样本,采用全自动生化分析仪测定抽样,均测定3 次。
1.2.3 稳定性评价 按照“1.2.2”项中的文件评价。2 ~8 ℃、–20 ℃条件下放置 1、2、4、7、12、20、30 d,20 ~ 25 ℃条件下放置 1、2、4 和 8 h 后进行稳定性研究。每个温度点和时间点下放置 2 支候选品水平 I 和水平II。采用肌酐检测试剂盒(肌氨酸氧化酶法)和全自动生化分析仪,同时对取出的全部样本进行检测,每个样本测定 3 次,求均值。中间穿插测定 2 个水平的质控品。每个温度下测定值就是水平I 或水平II在对应温度下相应时间的肌酐浓度。以时间为横坐标,测定均值为纵坐标作图,进行线性拟合回归,计算斜率和斜率的标准差s,对候选品中的肌酐浓度进行趋势性分析。根据公式⑴计算斜率的标准差s。在置信水平为 0.95,自由度为-2 的条件下,得到(0.95, n-2)值。计算(0.95, n-2)·s的值,比较 || 与(0.95, n-2)·s,如果 || <(0.95, n-2)·s,则斜率不显著,表明候选品稳定,反之则不稳定,可采取减少时间点的数目再进行分析,以得到候选品的稳定期限。

1.2.4 协作赋值 要求参加定值的实验室数量不少于3 家,且近 2 年参加了血清中肌酐测定的参考实验室外部质量比对或国内参考实验室室间比对,结果均通过。要求在正式赋值实验前,正确度样本及质控符合要求后方可进行定值实验。采用肌酐参考测量程序[5-7]赋值,实验分 3 次进行。每次水平I、水平II取 3 支,各重复检测 3 次,最终得到27 个有效数据。计算均值、标准偏差及变异系数,候选品水平 I、水平II的肌酐测定值为各实验室采用格拉布斯法剔除离群值后的均值再合并计算得到的总均值。
1.2.5 不确定度评定 按照“1.2.2”项中的文件评定。不确定度来源主要包括候选品的均匀性、稳定性和定值三部分。公式⑵为候选品合成标准不确定度CRM。

char:定值引入的不确定度;bb:均匀性引入的不确定度;s:稳定性引入的不确定度。
1.2.6 互通性评估 按照《WS/T 356-2011 基质效应与互通性评估指南》[8]评估。采用参考方法和常规方法(4 种不同生产厂家的肌酐检测试剂盒),同时对选定的一系列具有代表性的临床血清样本(不少于 25 份)和候选品进行检测,利用两种方法测得的临床血清样本的结果建立回归关系。如果候选品采用常规方法的测定均值落在 95% 置信区间内,说明候选品对常规方法无基质效应,表明在参考方法和常规方法间具有互通性。
2 结果
2.1 均匀性
采用单因素方差分析法,肌酐候选品水平 I、水平II的值分别为 1.3350 和 0.8342,均小于0.05(1.6564),表明均匀性良好,结果详见表 1。
2.2 稳定性
对肌酐候选品水平 I、水平II进行稳定性评价,结果详见表 2 ~ 3。经统计分析,由表4 可知,水平 I 和水平II在 2 ~ 8 ℃和–20 ℃条件下均能稳定 30 d;在20 ~ 25 ℃条件下均能稳定 8 h。
2.3 协作赋值
3 家实验室参加了协作赋值。肌酐候选品水平 I、水平II定值结果的实验室内变异系数分别在 0.8% ~ 1.2% 和 0.8% ~ 1.3% 范围内,表明各实验室建立的参考方法稳定;且水平 I、水平II在各家测定结果之间的差异均小于 2.0%,表明数据可靠。协作赋值结果详见表 5。
2.4 不确定度评定
2.4.1 赋值引入的不确定度 计算公式为:
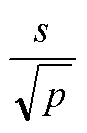
式中为 3 个实验室测值的总标准差;为实验室总数。按照该公式得到的候选品水平 I、水平II赋值引入的不确定度分别为0.9064 μmol/L、1.9457 μmol/L。
2.4.2 均匀性引入的不确定度 以表 1 中的方差结果进行计算,计算公式为:

among:组间均方;within:组内均方;:(有效)单元数。按照该公式,计算出候选品水平 I 均匀性引入的不确定度为 0.3535 μmol/L。由于水平II 组间均方(9.1490)小于组内均方(10.9672),采用公式⑸(within为组内自由度,为检测次数)计算得到 0.8170 μmol/L。
表1 肌酐候选品均匀性结果(μmol/L)
样本号水平 I 水平 II 185.886.485.4 302.7305.8311.1 286.487.285.8 308.8310.5303.8 385.084.286.8 302.9311.5301.7 485.884.085.2 306.8297.0309.7 584.085.684.8 305.8302.3303.6 684.683.085.6 296.2305.2306.6 785.884.084.4 306.6303.3301.7 885.888.187.2 312.1307.6303.8 984.484.085.0 307.8307.0311.1 1085.884.284.0 305.4303.5307.8 1185.284.684.6 301.9306.2304.1 1287.084.886.0 308.2307.0309.6 1383.486.086.6 310.1304.3307.6 1483.483.686.6 306.0301.1307.4 1586.285.684.8 301.7307.0307.6 1685.887.486.2 307.2308.8307.2 1785.284.086.6 305.8307.0306.2 1885.684.885.4 308.2308.4308.6 1984.684.884.6 302.7309.0302.7 2086.083.887.0 307.0308.6308.6 2185.085.285.0 307.6310.7306.8 2284.085.686.4 304.4311.7303.3 2386.484.288.2 301.7309.7305.0 2484.484.484.4 306.2309.5303.7 2583.685.886.4 305.6312.7305.0 2685.084.485.2 303.5302.1303.7 2786.487.286.4 305.0309.2305.0 2886.284.287.0 302.3312.5305.6 2986.085.684.6 302.5305.8303.1 3084.886.285.2 305.8305.0303.3 MSamong1.4939 9.1490 MSwithin1.1190 10.9672 F1.3350 0.8342 F0.051.6564 1.6564
表2 2 ~ 8 ℃ 和–20 ℃条件下肌酐候选品稳定性结果(μmol/L)
天数(d)水平 I 水平 II 2 ~ 8 ℃–20 ℃ 2 ~ 8 ℃–20 ℃ 084.384.9 312.85310.52 185.084.2 309.58310.50 283.983.7 305.52309.95 485.384.7 306.33309.47 785.385.3 301.02303.35 1084.585.6 303.30303.93 2085.685.6 304.07303.78 3085.785.5 306.88305.22
表3 20 ~ 25 ℃ 条件下肌酐候选品稳定性结果(μmol/L)
时间(h)水平I水平 II 084.1292.9 284.2293.7 484.5293.7 884.4293.5
表4 肌酐候选品稳定性分析结果
保存条件|k|t(0.95, n-2)·sk结果判定 水平 I20 ~ 25 ℃8 h0.036190.12913稳定 2 ~ 8 ℃30 d0.001710.00186稳定 –20 ℃30 d0.001890.00192稳定 水平 II20 ~ 25 ℃8 h0.053100.28031稳定 2 ~ 8 ℃30 d0.004750.01373稳定 –20 ℃30 d0.008820.00936稳定
表5 肌酐候选品协作赋值结果
实验室编号水平I水平 II 180.7304.9 283.1311.1 383.7310.3 总均值(μmol/L)82.49308.76 总标准偏差 1.57 3.37 RSD(%)1.9 1.1

2.4.3 稳定性引入的不确定度 公式u=s·中s为稳定性数据经线性拟合得到方程的斜率的标准差,为候选品的有效期。肌酐候选品稳定性引入的不确定度结果详见表 6。
表6 肌酐候选品稳定性引起的不确定度
sk天数(d)us 水平I0.0008300.0235 水平 II0.0038300.1148
2.4.4 合成不确定度 将候选品的赋值、均匀性和稳定性所引入的不确定度进行合成,计算得到合成不确定度:
候选品I:

候选品 II:
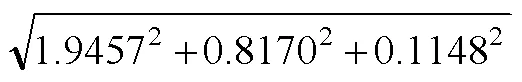
经协作赋值及不确定度的评定,最终得到候选品水平 I 和水平II的肌酐浓度分别为:(82.5 ± 1.9)μmol/L(2)和(308.8 ± 4.2)μmol/L(= 2)。
2.5 互通性评估
采用参考方法和常规方法(4 家肌酐试剂盒,均为肌氨酸氧化酶法,按照各说明书进行分析)对不少于 25 份新鲜血清样本同时测定,通过新鲜临床样本测定结果得到线性回归方程,将参考方法测定均值为 x 轴,计算肌酐候选品y 值的 95% 置信区间,结果显示候选品水平 I 和水平II常规方法测定值均位于该区间范围内,即表明候选品具有良好的互通性(表 7)。
3 讨论
肌酐是临床检验中常规检测项目,其检测的准确性在慢性肾病筛查、监测中起非常关键的作用。血清肌酐的检测方法较多[9],包括苦味酸法[10-11]、酶法、高效液相色谱、液相色谱串联质谱等。但临床上多采用全自动生化分析仪和以肌氨酸氧化酶法或苦味酸法为基础的检测试剂盒进行检测,操作比较简便。现已有上百家生产厂家取得了肌酐检测试剂盒的医疗器械注册证。然而各家因溯源方式、校准品基质的选择等方面不尽相同,测值存在一定差异[12]。目前在对临床机构的检测结果应具有可比性的呼声越来越强的形势下,建立参考方法及研制标准物质[13],将有效推动量值的溯源,促进临床检验工作的标准化。
经查询,在检验医学溯源性联合委员会(JCTLM)网站上公布的血清中肌酐检测的参考方法有 7 种,6 种基于同位素稀释质谱原理,1 种为同位素稀释表面增强拉曼散射法。本研究中,3 家实验室均采用的是 JCTLM 公布的方法,且各家在本次赋值实验前已建立并稳定运行该方法较长时间,可以有效保证赋值结果的准确性和可靠性。最终的结果也验证了这一点,两水平赋值结果的实验室间变异系数均在 2.0% 范围内。本批血清基质肌酐国家标准品候选品,以人血清为基质,未添加防腐剂、抗生素等外源性物质,最大程度地保持了临床样本的性质。本批候选品的均匀性和稳定性结果均满足要求,并将定期对稳定性进行长期监测,同时通过与 4 种主流肌酐检测试剂的互通性评价,亦表明候选品的互通性良好。总之,本次研制的肌酐冰冻人血清候选品,稳定性、均匀性、互通性良好,定值结果准确,可以作为国家标准品使用。该批血清基质的肌酐标准品将主要用于体外诊断试剂研发生产企业的量值溯源、参考实验室或临床实验室测定的校准或正确度验证等。上述应用将有效促进临床血清肌酐检测结果的互认以及肌酐检测试剂盒的监管工作。
表7 肌酐候选品的互通性评价(μmol/L)
常规方法编号参考方法均值95% 上限95% 下限常规方法均值结果判定 1 80.7 93.6 59.1 82.7良好 304.9324.6290.0300.6良好 2 80.7107.4 58.1 86.7良好 304.9374.0324.5337.7良好 3 80.7 94.1 63.0 81.4良好 304.9327.2295.9305.6良好 4 80.7 96.3 63.8 83.1良好 304.9334.7302.1321.8良好
[1] Wang L. Application of cystatin C combined with creatinine and urea nitrogen in renal impairment. Guide China Med, 2021, 19(4):108-109. (in Chinese)
王丽. 胱抑素C与肌酐、尿素氮联合检测在肾功能损害中的应用. 中国医药指南, 2021, 19(4):108-109.
[2] Chen R, Wang P, Peng Y, et al. Diagnostic value of urea albumin creatinine ratio combined with serum creatinine to early decrease of glomerular filtration rate in elderly patients with hypertension. ChinJ Evid Bases Cardiovasc Med, 2021, 13(3):325-328. (in Chinese)
陈睿, 王旁, 彭燕, 等. 尿白蛋白与肌酐比值联合血肌酐对老年高血压患者早期肾小球滤过率下降的诊断价值. 中国循证心血管医学杂志, 2021, 13(3):325-328.
[3] Sun W, Xie Q, Chen HY, et al. Chronic kidney disease epidemiology equation and full age spectrum equation in adults with chronic kidney disease. Chin J Med Imaging Technol, 2021, 37(1):113-117. (in Chinese)
孙雯, 谢权, 陈鸿颜, 等. 慢性肾脏病流行病合作工作组方程和肌酐全年龄段方程用于成人慢性肾脏病. 中国医学影像技术, 2021, 37(1):113-117.
[4] General Administration of Quality Supervision, Inspection and Quarantine. JJF 1343-2012 General and statistical principles for characterization of reference materials. Beijing: China Standards Press, 2012. (in Chinese)
国家质量监督检验检疫总局. JJF 1343-2012 标准物质定值的通用原则及统计学原理.北京: 中国标准出版社, 2012.
[5] Dai XH, Fang X, Yang MR, et al. Application of liquid chromatography/LTQ linear ion trap mass spectrometry for quantifying the biomarkers creatinine and cortisol in serum. Anal Lett, 2008, 41(16):2912-2922.
[6] Dodder NG, Tai SS, Sniegoski LT, et al. Certification of creatinine in a human serum reference material by GC-MS and LC-MS. Clin Chem, 2007, 53(9):1694-1699.
[7] National Health and Family Planning Commission of the People's Republic of China. WS/T 413-2013 Reference mesurement method for serum creatinine—Isotope dilution liquid chromatography tandem mass spectrometry. Beijing: China Standards Press, 2013. (in Chinese)
中华人民共和国国家卫生和计划生育委员会. WS/T 413-2013 血清肌酐测定参考方法 同位素稀释液相色谱串联质谱法. 北京: 中国标准出版社, 2013.
[8] Ministry of Health of the People's Republic of China. WS/T 356-2011 Guideline for evaluation of matrix effects and commutability. Beijing: China Standards Press, 2011. (in Chinese)
中华人民共和国卫生部. WS/T 356-2011 基质效应与互通性评估指南.北京: 中国标准出版社, 2011.
[9] Tan HJ, Luo CH, Yang L, et al. Methodological evaluation for determination of creatinine in serum and its development. Syst Med, 2019, 4(8):191-194. (in Chinese)
谭红军, 罗春华, 杨林, 等. 肌酐检测方法学评价及其研究进展. 系统医学, 2019, 4(8):191-194.
[10] Nah H, Lee SG, Lee KS, et al. Evaluation of bilirubin interference and accuracy of six creatinine assays compared with isotope dilution-liquid chromatography mass spectrometry. Clin Biochem, 2016, 49(3):274-281.
[11] Niu CC, Wan YF, Li T, et al. Correcting bias of creatinine testing using Jaffe assay by double-levels calibration. Chin J Clin Lab Sci, 2017, 35(9):654-656. (in Chinese)
牛长春, 万雅芳, 李甜, 等. 双水平校准纠正苦味酸法肌酐检测偏移. 临床检验杂志, 2017, 35(9):654-656.
[12] Song YX, Ou MX, Li SJ, et al. Methodology comparison of serum creatinine determined by isotope dilution liquid chromatography tandem mass spectrometry, enzymatic method and Jaffe method. Lab Med, 2013, 28(8):698-703. (in Chinese)
宋云霄, 欧美贤, 李水军, 等. 同位素稀释质谱法、酶法和碱性苦味酸法测定血清肌酐方法比较. 检验医学, 2013, 28(8):698-703.
[13] Jin ZG, Ju Y, Tang LP, et al. Establishment and application of serum creatinine reference method in accuracy survey. Lab Med, 2015, 30(11):1070-1073. (in Chinese)
金中淦, 居漪, 唐立萍, 等. 血清肌酐参考方法的建立及其在正确度调查中的应用. 检验医学, 2015, 30(11):1070-1073.
10.3969/j.issn.1673-713X.2022.04.010
国家重点研发计划(2019YFF0216501)
胡泽斌,Email:huzebin@nifdc.org.cn;曲守方,Email:qushoufang@126.com
2021-12-31
*同为第一作者

