重链沉积病的分子机制及诊疗进展*
张 园 ,范 芸 ,曾彩虹
(1 东部战区总医院/国家肾脏病临床医学研究中心,南京大学附属金陵医院,江苏 210016;2 南通大学附属医院肾内科;3 无锡市人民医院肾内科)
重链沉积病(heavy chain deposition disease,HCDD)是一种因单克隆免疫球蛋白重链在组织沉积所致的全身性疾病,属于罕见的单克隆免疫球蛋白沉积病(monoclonal immunoglobin deposition dis ease,MIDD),肾脏是最常被累及的器官,还可累及肝脏、甲状腺、皮肤、骨骼肌等[1-2],36%~50%患者随访1 年内需要血液透析治疗[3]。HCDD 发生机制尚不清楚,可能与重链恒定区(constant region,CH)1段缺失[4-8]以及单克隆重链激活补体系统有关[4-5]。治疗目标是去除异常浆细胞克隆,减少异常重链产生。近年来MIDD 发病率明显增加[9],深入认识该病十分必要,本文就HCDD 发病机制、诊断和治疗进展进行综述。
1 正常及异常重链结构
免疫球蛋白分子由两条轻链(light chain,LC)和两条重链(heavy chain,HC)组成。重链含 450~550个氨基酸残基,重链根据抗原性差异分为μ 链、γ链、α 链、δ 链和 ε 链,分别对应免疫球蛋白 IgM、IgG、IgA、IgD 和 IgE。轻链包括 κ 和 λ 两种亚型,轻链产生较重链约多40%,轻链和重链结合形成完整的免疫球蛋白,未结合的轻链进入血液即为游离轻链(free light chains,FLC)。人类重链基因位于第14号染色体,分为4 个不连续的基因节段,从着丝点5’末端起依次为可变区(VH)、多样性区(DH)、接合区(JH)和恒定区(CH)。成熟的 IgG、IgA 和 IgD 重链各有 1 个可变区(VH)和 3 个恒定区(CH1、CH2 和CH3),IgM 和 IgE 重链各有 1 个可变区(VH)和 4 个恒定区(CH1、CH2、CH3 和 CH4)。正常重链转录后在内质网中加工成多肽与重链结合蛋白结合,再与轻链结合转运至高尔基体中组合,重叠形成蛋白质后分泌。(图1、图2[10])
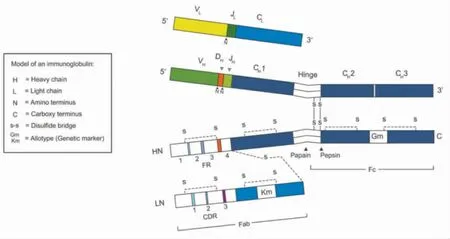
图1 IgG 二维模型

图2 重链基因结构示意图
HCDD 中常见的异常重链为CH1 缺失,也可同时伴有CH2 缺失,CH1 结构域中仅数个密码子缺失少见[11]。CH1 缺失或变异是异常重链进入血液的前提。缺失CH1 的重链不能与重链结合蛋白结合,未成熟的重链会分泌进入血循环,但缺失CH2、CH3不影响重链与重链结合蛋白结合[5]。BONAUD 等[12]从HCDD 患者体内分离出γ1-重链(γ1-HC)靶向插入Igκ 基因,建立 HCDD 小鼠模型,证实 CH1 缺失是异常单克隆重链分泌的前提。
重链VH 的理化特性与肾小球/小管基底膜的重链沉积有关。BRIDOUX 等[11]发现在VH 中突变的互补决定区域(CDR)和框架区域可能改变了重链极性,且VH 三维结构变异导致疏水区(主要在CDR中)的形成,这可能有利于蛋白质聚集;电镜和免疫电镜显示,游离VH 带正电荷,因而具有在肾小球和肾小管基底膜阴离子部位沉积的倾向。
BENDER 等[13]通过蛋白质印迹法在HCDD 患者骨髓和血清中发现完整的λ 轻链和缩短约17 kDa λ轻链。在缺乏轻链的小鼠模型中,很少有CH1 截短的重链,因此认为轻链缺陷可能是促进重链CH1 缺失和分泌的首要条件。这样可以避免重链滞留于浆细胞内,减轻内质网应激,最终改善异常浆细胞的适应性和存活率。
2 MIDD 发病机制
MIDD 显著的病理特点是细胞外基质大量聚集并形成结节样病变。有研究表明,轻链沉积病(light chain deposition disease,LCDD)患者系膜细胞在体外孵育后分泌大量细胞粘合素,并以此为中心聚集形成结节样病变[14]。单克隆游离轻链可以诱导系膜细胞最终转变为接近于肌成纤维细胞的表型,系膜基质合成增加,基质金属蛋白酶的合成及活性下降[15]。
HCDD 结节形成过程与LCDD 结节形成相似,但 HCDD(尤其是 γ1 和 γ3-HCDD)患者血清 C3 水平降低,并伴有肾组织 C3 和 IgG 的线性沉积[1,11],这与大多数LCDD 不同。过多的轻链也可能通过激活补体途径导致轻重链沉积病(light and heavy chain deposition disease,LHCDD)的临床病理特点[16]。有研究表明,补体水平在HCDD 患者治疗过程中可以逐渐恢复至正常[17]。我们近期的研究(尚未发表)显示,在HCDD 患者肾组织中补体三种途径均被激活,循环中存在补体旁路途径及经典途径的激活。血C1q与血肌酐水平呈负相关,血补体sC5b9、尿补体C1q、Bb、C3a、C5a 及 sC5b9 与 24 小时尿蛋白定量呈正相关。说明HCDD 患者体内存在补体经典途径及旁路途径的活化,且补体活化程度与血肌酐及蛋白尿严重程度相关。在疾病后期补体激活与肾损伤之间可能存在恶性循环,阻断这种恶性循环可能有助于疾病治疗。
3 MIDD 诊断方法
HCDD 可先于多发性骨髓瘤、轻链淀粉样变性等恶性浆细胞疾病数年出现,转化率平均每年1%。单克隆蛋白(M 蛋白)大小,免疫球蛋白类型,FLC 变化程度以及染色体异常等因素均可影响转化率。尽管终末器官的损伤通常和B 细胞的负荷不成比例[18],但FLC 和M 蛋白检测在HCDD 的诊疗中尚有一定参考意义。
FLC 水平代表轻重链生产率和肾脏清除率。FLC 浓度随适应性免疫活性而增加,而κ/λ 值则保持不变,κ/λ 异常表示某种类型的单克隆FLC 过量。κ/λ 正常值 0.26~1.65,<0.26 为存在单克隆 λ 轻链,>1.65 为存在单克隆κ 轻链。应注意的是,由于血清FLC 清除动力学的改变,肾功能不全患者的κ/λ 值略有增加(0.37~3.1)。BRIDOUX 等[11]和 NASR 等[19]研究显示,HCDD 患者 FLC 比值及浓度均异常。GERTH 等[20]认为 κ/λ 值对 MIDD 预测具有良好的敏感性,FLC 血清半衰期很短,可以作为骨髓瘤对化疗反应的标志物。然而,ZHANG 等[21]研究发现,即使HCDD 患者 FLC 浓度在参考范围内,κ/λ 值也可能异常,FLC 浓度超出参考范围,κ/λ 值也可能正常,认为 FLC 浓度及 κ/λ 值对 HCDD 患者诊断及预测价值有限。
血清蛋白电泳(serum protein electrophoresis,SPEP)是最常用的定量检查,但不能显示单克隆免疫球蛋白类型,而血清免疫固定电泳(serum immunofixation electrophoresis,IFE)可以鉴定单克隆免疫球蛋白种类,但不能定量。在15 例HCDD 患者中,SPEP 检测单克隆免疫球蛋白阳性率为60%,IFE阳性检测率为80%[11]。在一项针对64 例MIDD 患者(其中 HCDD7 例)的研究中,SPEP 和 IFE 在 86%患者中检测到单克隆免疫球蛋白峰,尽管IFE 及FLC不能单独作为诊断性检验,但两者结合可使敏感性从94.3%提高到97.4%,有一定参考价值[19]。通常IFE 与组织沉积的免疫球蛋白类型一致,但ZHANG等[21]报告1 例患者组织沉积为IgG3,但血清IFE 显示为IgAκ,目前尚不能解释。
梅奥诊所开发的激光显微切割肾小球的蛋白质质谱分析(laser microdissection/mass spectrometry,LMD/MS)是检测单克隆蛋白最新方法,可以确定单克隆蛋白的类型并进行定量,已成功用于诊断LCDD 和HCDD[22-23],其敏感性似乎优于血清FLC,但要全面推广还需要更多数据支持。肾活检仍是目前诊断MIDD 的金标准。
4 治疗进展
4.1 化疗 1999 年 MOULIN 等[4]提出不管最初eGFR 水平如何,HCDD 应尽早采用基于硼替佐米的化疗方案。BONAUD 等[12]建立的HCDD 转基因小鼠模型显示,产生截短γ-HC 的异常浆细胞对硼替佐米的反应比产生完整免疫球蛋白的浆细胞更敏感,证实硼替佐米作为HCDD 基础治疗的可行性。近年研究显示,以硼替佐米为基础的化疗可使HCDD 患者迅速临床缓解,包括血肌酐下降[21,24-25]、eGFR 升高[21,24]、κ/λ 恢复正常或接近正常[11,24-25]、血红蛋白升高或稳定[24]、免疫印迹阴性[11]、血白蛋白升高[11,21,26]及补体恢复正常或接近正常[26]。也有研究认为,接受不同化疗方案(包括硼替佐米、雷公藤、环磷酰胺、长春新碱、阿霉素和来那度胺等)的患者肾脏功能都能得到改善[13,21,27]。
初始肾功能可作为MIDD 患者进展至终末期肾脏疾病的独立预测因素[11],治疗后FLC<40 mg/L、无严重间质纤维化是肾反应的独立预测因子[25]。但也有研究认为初始血清肌酐水平不能预测疾病结局[21],可能是因为HCDD 被早期发现且对化疗反应良好,或是因为病例数太少而无法显示统计学差异。另外,在γ-HCDD 中角质层松弛可能先于肾脏损伤发生,是早期诊断的宝贵指标[26]。
4.2 高剂量美法仑/自体干细胞移植 高剂量美法仑/自体干细胞移植(high-dose melphalan and autologous stem cell transplantation,HDM/ASCT)可能作为某些患者的二线治疗[25]。KOURELIS 等[28]研究显示,MIDD 患者接受基于ASCT 或蛋白酶体抑制剂(如硼替佐米)治疗后,5 年总体肾脏存活率分别为67%和57%,eGFR<20 mL/min·1.73 m2和肾脏应答(使用AL 或国际骨髓瘤工作组标准)可独立预测透析的进展。BRIDOUX 等[11]报告 1 例 HCDD 患者使用美法仑11 个疗程后随访7 年,肾脏及血液获得完全应答,2 例HCDD 患者采用硼替佐米治疗后行ASCT,肾功能完全或部分改善。HDM/ASCT 治疗可使某些患者长期生存,但需扩大样本量证实。
4.3 补体治疗 补体疗法对非典型溶血尿毒综合征、C3 肾小球肾炎、抗中性粒细胞胞浆抗体相关性小血管炎、狼疮肾炎、IgA 肾病和局灶节段性肾小球硬化等疾病可能益处[29],能改善肾脏参数和补体水平[17,30]。美国FDA 已批准依库丽单抗作为治疗肾脏疾病中的补体封闭剂,能有效阻断C5 裂解并阻止C5a 和 sC5b9 的形成[17]。NASR 等[31]报道,接受 B 细胞消耗药物治疗的单克隆IgG 沉积病可达部分缓解,在膜增生性肾小球肾炎伴单克隆免疫球蛋白沉积或免疫触须样肾小球病治疗中采用利妥昔单抗也可能有益。
4.4 肾移植 迄今为止仅有少量MIDD 患者肾移植,未化疗而行肾移植的LCDD 的复发率71%~86%,1 例 HCDD 患者移植 2.5 年后复发[32],虽然有 1例HCDD 获得其姐姐的活体肾移植后随访8 个月肾功能良好[7],但缺乏长期随访数据。表明在血液系统恶性肿瘤未治疗前,不应进行肾移植[33-34]。BATALINI 等[35]指出,对于由AL 淀粉样变性和MIDD 引起的终末期肾衰患者,HDM/ASCT 可安全有效地诱导血液学完全应答并延长生存期,持久血液学应答可使这些患者成为肾移植的候选对象。
5 小 结
HCDD 患者异常重链的形成有明显的个体差异,FLC、M 蛋白和补体检测对诊断及治疗过程的评价有一定参考意义,质谱诊断价值尚待进一步明确。以硼替佐米为代表的化疗表现较好的血液学反应,但因发病率低目前仍缺乏HCDD 治疗指南或共识。HDM/ASCT 和肾移植可以作为某些患者的二线治疗,补体治疗也可能为HCDD 治疗开辟新的途径。

