结肠息肉内镜下治疗的并发症分析
宰德富 张丽丽
结肠息肉是消化内科的一种常见病、多发病,是指高出肠黏膜的腔内突起,一般肠镜检查至少有10%~15%的检出率,足见其常见多发,且其发生率常随年龄的增加而升高。结肠息肉对人体的危害主要取决于结肠息肉的类型,临床上以腺瘤性息肉对人体的危害性最大,这不仅是因为息肉不断增长阻塞肠道引起梗阻,并且可致出血、腹泻等症状,更重要的是腺瘤性息肉有发生癌变的危险。因此,一般的处理是见息肉即予以根除,并予全瘤摘除。以往多行外科切除,现普遍采用内镜下治疗,但对治疗后并发症的发生并没有引起足够重视。本文对本院确诊并行内镜下治疗的结肠息肉患者的并发症发生情况进行分析,以便进一步指导内镜医师的工作,提高技术水平。现报告如下。
1 资料与方法
1.1 一般资料 选取本院2019 年6 月~2021 年8 月在本院住院行无痛电子结肠镜检查并行内镜下结肠息肉治疗的患者2156 例作为研究对象,其中男1129 例,女1027;年龄17~88 岁,平均年龄(56.4±12.8)岁;合并糖尿病216 例,高血压168 例,冠心病108 例;术前手术史129 例。排除标准:排除资料不全者、经病理结果证实为恶性肿瘤者。
1.2 器械 采用Olympus Q290 型电子结肠镜以及ERBE EIO 200D 消化内镜工作站、圈套器、氩气管、活检钳、注射针、尼龙绳套扎器、金属钛夹、黄金刀、丢刀等,以及1∶10000 肾上腺素,0.4%亚甲蓝注射液等。
1.3 术前准备 所有患者术前1 周均必须停用肠溶阿司匹林以及抗凝剂,术前常规行血细胞分析、凝血功能、生化系列(如血糖、肝肾功能等)、传染系列、心电图、胸部拍片等检查,如有明显异常则先纠正至正常范围内再行检查。术前6~8 h 开始口服聚乙二醇电解质散溶液、达克罗宁胶浆等药物作肠道准备。用芬太尼、丙泊酚静脉麻醉。
1.4 手术方法 所有患者均由本科具有内镜诊治资质的6 名医师完成。麻醉成功后,应用单人徒手内镜短缩法钩拉进镜至回盲部,然后退镜反复观察寻找病灶,发现息肉后进行确认及评估。评估内容:息肉数目:分为单发(1 枚)及多发(≥2 枚)。息肉的大小分3 类:<5 mm、5~20 mm、>20 mm。形状:山田分类[1]:Ⅰ型:隆起的起势部较平滑而无明确境界;Ⅱ型:隆起的起势部有明确的境界;Ⅲ型:隆起的起势部略小,形成亚蒂;Ⅳ型:隆起的起势部有明显的蒂部;LST:侧向发育型。把Ⅰ、Ⅱ型称为无蒂息肉,而Ⅲ、Ⅳ型则称为有蒂息肉。根据术中的初步评估结果分别选择以下操作:结肠息肉<5 mm 者,选用单纯活检钳钳除术、单纯高频电切术或氩气刀烧灼术;山田分型Ⅳ型患者选择尼龙绳套扎或底部注射亚甲蓝注射液后给予金属夹夹闭根部+高频电切除术;结肠息肉直径5~20 mm患者,根据情况选择以上术式,或圈套器套切术,或底部注射亚甲蓝注射液后高频电切或套切治疗,或采用内镜下黏膜切除术(endoscopic mucosal resection,EMR),结肠息肉≥20 mm 患者,行EMR 或经内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)治疗。
1.5 术后并发症处理 术后密切观察并发症发生情况,并发症主要包括出血、穿孔、腹痛、感染以及息肉电凝电切术后综合征、低血糖、尿潴留等。
1.5.1 出血 根据情况可分为息肉切除术中出血以及术后延迟性出血。对于术中出血,可在术中给予内镜下止血,包括局部喷洒孟氏液、去甲肾上腺素溶液、对出血点进行电凝烧灼等,必要时可给予钛夹夹闭出血点,此种情况的出血不计。术后延迟性出血指术后24 h 后便血或者黑便,可静脉推注或静脉滴注止血药物,如果效果不佳则果断行急诊肠镜检查进行内镜下止血治疗,必要时可将特别严重者转外科手术治疗。
1.5.2 穿孔 主要指手术中观察到确定的裂口或者术后清醒患者存在比较明显且严重的腹痛,并且经腹部CT 检查证实有腹腔游离气体,说明存在穿孔。对于术中裂口则在术中给予钛夹夹闭病变处;对于术后穿孔必须给予禁食,短期内密切观察,症状无缓解则果断行急诊肠镜下钛夹夹闭治疗,如果急诊肠镜无法寻找破口则立即转外科手术治疗。
1.5.3 腹痛 仔细鉴别并排除穿孔导致的腹痛,息肉切除后可按疼痛程度分为轻、中、重3 个级别,轻度腹痛:间歇发作,程度较轻,可以忍受,无需用药治疗;中度腹痛:有时发作,持续性疼痛,程度中等,如果影响休息则需用止痛药物治疗;重度腹痛:持续性发作,程度较重,不能忍受,则必须用药物控制。
1.5.4 感染 指结肠息肉内镜下切除术后出现发热、腹痛或腹泻、合并血白细胞升高等表现,对于确定为感染的患者以静脉应用抗生素治疗为主。
1.5.5 其他 与禁食有关的低血糖及卧床导致的尿潴留,本研究不做统计。
1.6 观察指标 观察患者术后并发症发生情况,对比不同性别、年龄、手术史、息肉数目及操作方式患者术后并发症发生情况。
1.7 统计学方法 采用SPSS19.0 统计学软件对研究数据进行统计分析。计量资料以均数±标准差()表示,采用t检验;计数资料以率(%)表示,采用χ2检验。P<0.05 表示差异具有统计学意义。
2 结果
2.1 不同性别、年龄、手术史、息肉数目患者术后并发症发生情况比较 2156 例患者中,95 例(4.41%)出现并发症,其中出血36 例(1.67%),穿孔4 例(0.19%),腹痛34 例(1.58%),感染21 例(0.97%),无一例死亡。不同性别患者术后并发症发生率比较差异无统计学意义(P>0.05);年龄≥60 岁患者术后并发症发生率5.62%高于年龄<60 岁患者的3.55%,差异具有统计学意义(P<0.05);有手术史患者术后并发症发生率8.53%高于无手术史患者的4.14%,差异具有统计学意义(P<0.05);息肉数目≥2 枚患者术后并发症发生率4.86%高于息肉数目1 枚患者的1.84%,差异具有统计学意义(P<0.05)。见表1。

表1 不同性别、年龄、手术史、息肉数目患者术后并发症发生情况比较[n(%)]
2.2 不同操作方式术后并发症发生情况比较 行活检钳钳除术患者的并发症发生率均低于行氩气刀烧灼术、高频电切术、圈套器勒除术、注射后高频电切术、EMR/ESD 患者,行氩气刀烧灼术、高频电切术、圈套器勒除术、注射后高频电切术患者的并发症发生率均低于行EMR/ESD 患者,差异具有统计学意义(P<0.05)。见表2。
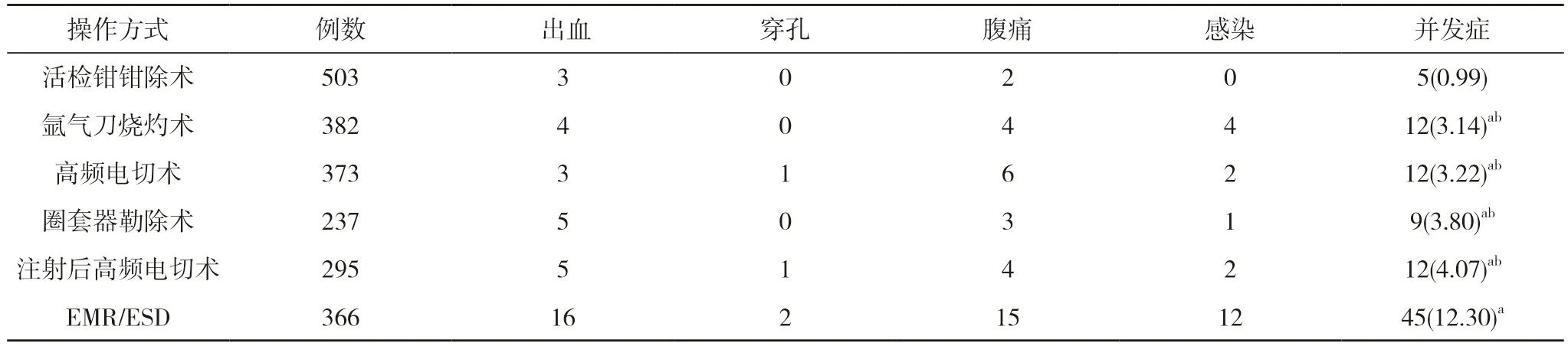
表2 不同操作方式术后并发症发生情况比较[n,n(%)]
3 讨论
结肠息肉是下消化道最常见的疾病之一,通常认为是由肠黏膜上皮组织过度增生所导致,临床上可分为增生性、炎症性、错构性(Peutz-Jegher 息肉)、肿瘤性(腺瘤)四大类。Morson 等早年提出的腺瘤-癌序列变化过程具有病理学依据,腺瘤越大、数目越多、形态越不规则、绒毛成分越多越易癌变,是结肠腺癌的主要危险因素之一,目前公认的原则是见瘤即切[2]。传统的外科开腹手术虽然具有疗效确切的优点,但因其操作较复杂,创伤较大,患者的耐受性很差,因此已逐渐被电子结肠镜下治疗所取代[3]。但临床工作中发现结肠镜下切除结肠息肉有一定的并发症发生风险,给患者和手术医师造成了一定的心理负担,因此深入研究结肠镜下治疗结肠息肉术后并发症的发病因素、发病特点、不同内镜操作方式术后并发症发生情况以及术后并发症的相关预防措施等对提高内镜下治疗结肠息肉的临床疗效等具有重要意义。
1/3的患者结肠息肉内镜下切除术后可能会有轻微的胃肠道症状,如腹痛、腹胀、恶心及腹泻等,属于正常现象,一般24~48 h 内可缓解[4],大部分无需特殊治疗。结肠息肉内镜下切除术后较严重的并发症主要是出血、穿孔、腹痛、发热、息肉电凝电切综合征等,其中结肠息肉术后出血(PPB)是内镜下治疗最常见的并发症,国外报道延迟性出血为0.6%~8.6%[5],对于直径>10 mm 的结肠息肉,内镜下切除术后出血风险增加2.0~4.5 倍[6],EMR 或ESD 术后迟发性出血为6.5%[7,8]。研究表明,PPB 原因有结肠息肉、患者本身、术者操作等3 个方面的因素[9],密切危险因素有:年龄较大(>65 岁)、合并高血压等慢性疾病、术前曾服用抗血小板及抗凝药、息肉较大(>10 mm)、术前肠道准备不充分、电凝电切的模式选择不准确、意外切除、一次性切除多个息肉(本组就有1 例患者一次性切除106 枚息肉发生PPB)等。在结肠息肉本身的因素中与PPB 关系最密切的因素为息肉大小,在患者因素中与出血关系最密切的是既往有高血压病史,而且出凝血时间延长[10]。EMR 或ESD 术后出血原因则主要与其所切除的结肠息肉体积比较大,创面较广泛,而且息肉的血液供应较丰富有关,同时EMR 或ESD 治疗方式比较复杂、术者操作水平的不同也会影响术后并发症的发生。本组有36 例(1.67%)患者并发出血,主要为延迟出血,其发生率与原因符合以上文献中报道的情况,出血发生后分别给予了静脉应用止血药物及急诊肠镜下止血等正确处理方法,取得了良好的效果,本组中没有一例转往外科行手术止血治疗。穿孔的发生与患者年龄大、体质差、术后未严格执行卧床休息、起床活动时间过早、进食固体食物过早等因素有关,属于少见而严重的并发症,本组共发生4 例(0.19%)。对于穿孔,首先应及时识别,对于术后麻醉药物作用消失后的腹痛应仔细鉴别,腹痛不易解释的话应及时行相关检查明确诊断,确定穿孔后要及时行急诊肠镜下夹闭穿孔,并给予补液、营养支持、控制感染等,本组4 例患者都得到了妥善的处理,最终痊愈出院。本组有34 例(1.58%)患者术后出现了腹痛,且多属于轻中度腹痛,腹痛的原因与术中操作不细致、过度充气、暴力牵拉等有关,多能耐受,一般除应用止痛剂外无特殊处理措施。结肠息肉切除术后发生感染的主要原因为术前肠道准备不好、一次性切除息肉的数量过多、所切除息肉的创面过大,并且患者年龄较高、患者的肌体抵抗力较差等。本组有21 例(0.97%)感染患者,所有患者经静脉应用抗生素后均治愈。
内镜下切除结肠息肉有许多种方法,主要有活检钳直接除术、氩气刀烧灼术、高频电切术、尼龙绳套扎术、圈套器套切术、EMR 和ESD 等,主要根据结肠息肉的大小、息肉的形态不同而定。从各种治疗方法的并发症来说,对于较小的息肉(<5 mm)进行单纯活检钳钳除、氩气刀烧灼术、单纯高频电切除等治疗的并发症极少,对于5~20 mm 大小的息肉,使用冷圈套器套切术(CSP)并发症也减少,而对于较大息肉(>20 mm)采取EMR 或ESD 则术后出现并发症率较高。本组结果显示,在不同操作方式并发症发生率的比较中也支持这一观点,行氩气刀烧灼术、高频电切术、圈套器勒除术、注射后高频电切术患者的并发症发生率均低于行EMR/ESD 患者,差异具有统计学意义(P<0.05)。这与覃桂聪等[11]的研究结果一致。近年来对适合大小的息肉多鼓励冷圈套器切除,具有切除率高、出血等并发症较少等优点[12],在实践中也积极应用,效果良好。
通过对本组病例并发症的分析,大体总结了以下预防方法,仅做参考:①虽然对无痛肠镜有诸多非议,但临床上无痛肠镜的普遍开展,可以使手术医师从容进行操作,确实改善了患者对结肠镜下息肉治疗的依从性,可有效减轻患者术中及术后的痛苦,缩短手术治疗时间,提高手术治疗效率,因此值得推广。②严格选择病例。术前必须对患者的情况进行全面评估,检测血常规、凝血功能、生化指标(血糖、血脂、肝肾功能等)、心电图、胸部拍片等基本项目,排除有出血性疾病及其他慢性疾病等风险性较高的患者,并与麻醉医师充分沟通,做到防患于未然。③术前良好的肠道准备可为术者提供清晰的视野,是保障操作顺利进行和预防出血、穿孔、感染等并发症的必备条件。④手术医师必须耐心细致,严禁暴力操作。热活检钳夹起组织不要过多、避免电流功率过大、电凝电切时间不宜过长等均是避免组织损伤、预防穿孔的重要措施。必要时可在黏膜下层进行局部液体注射,可增加病变与固有肌层的距离,使圈套器更容易套住病变等,应鼓励使用。⑤结肠息肉内镜下切除后必须立即仔细观察手术部位是否存在出血或灼伤过度的情况,如果有则给予电凝止血或局部喷洒止血药物,必要时可给予钛夹封闭。目前研究支持钛夹可一定程度减少结肠息肉内镜下切除术后并发症的发生率,对于直径>20 mm 的粗蒂息肉内镜下切除后推荐预防性使用,但对于是否降低出血风险并未提供足够证据[13],但经验支持钛夹的积极合理应用可减少出血、穿孔等并发症发生的风险,这与文献[14,15]报道一致。⑥结肠息肉内镜下切除术后给予患者正确、合理的饮食指导可明显预防和减少并发症的发生,护理人员必须嘱咐患者术后根据手术情况分别禁食不同时间,然后先以流质饮食为主,逐渐过渡到正常饮食[16-18]。术后严格卧床休息,密切观察患者有无腹痛、发热、便血等情况,一旦发现异常情况要及时汇报给医生,医生必须提高警惕,仔细鉴别,积极进行观察及相关处理,必要时可给予患者急诊结肠镜检查及治疗,切实保障患者安全[19,20]。因此,内镜下切除结肠息肉尽管有一定并发症,仍不失为一种简便、易于接受的治疗方法,随着技术的进步及操作水平的提高,能将并发症发生风险控制在最低,使内镜下治疗成为结肠息肉安全、成熟的常规治疗方法。
综上所述,结肠息肉内镜下治疗术后并发症的发生与患者年龄、是否有手术史、息肉数目、不同操作方式等因素有关,患者年龄越大、术前有手术史、多发息肉等术后并发症发生率较高,EMR/ESD 术后并发症发病率明显高于其他操作方法。因此,合理选择病例、根据患者及结肠息肉的具体情况选择合适的操作方式可以有效降低和防止并发症的发生。

