特异性敲低海马RNA甲基转移酶Pcif1对空间学习记忆的影响与机制研究
孙祖浩,所信君,夏贤友,赵爽,窦妍,于春水△
学习和记忆与海马神经元内基因的协同表达有关[1-2],而基因表达受RNA 修饰的调控。RNA 甲基化是常见修饰,受YTH 蛋白家族N6 甲基腺嘌呤RNA 结合蛋白1(Ythdf1)、甲基转移酶3(Mettl3)、磷酸化C端结构域相互作用因子1(Pcif1)、脂肪量和肥胖相关蛋白(Fto)和alkB 同源基因5(Alkbh5)的调控[3-4]。研究表明,条件性敲除海马组织Ythdf1或Mettl3可损害小鼠的学习和记忆功能[5-6];慢病毒介导的Mettl3在海马组织的过表达或Cre-LoxP系统介导的Fto敲低可导致小鼠小脑发育异常[7-8];CRISPR/Cas9 系统介导的海马Fto敲低或短发卡RNA(short hairpin RNA,shRNA)干扰介导的表达下调内侧前额叶皮层Fto可增强小鼠的恐惧记忆[9-10]。Pcif1是新发现的一种RNA 甲基转移酶,可催化N~6,2′-O-二甲基腺嘌呤(m6Am)的形成[11-12]。敲除HEK293T细胞的Pcif1可以减少RNA 的m6Am 修饰,从而增加mRNA 的稳定性[13-14];选择性敲低肿瘤组织Pcif1表达可以抑制肿瘤发生和肿瘤组织的化疗耐药性[15]。目前鲜见Pcif1对学习记忆调节作用的相关报道。本研究旨在探索RNA 甲基转移酶Pcif1对海马相关的空间学习记忆的调控及其分子机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 8 周龄雄性C57BL/6J Nifdc 小鼠27 只,体质量25~30 g,购自北京华阜康生物科技股份有限公司,实验动物生产许可证号:SCXK(京)2021-0006。所有动物实验均经天津医科大学实验动物管理和使用委员会批准(批准号:
IACUC E2015093)。
1.1.2 主要试剂及仪器AgeⅠ和EcoRⅠ限制性内切酶购自美国赛默飞世尔科技有限公司;Plko.1-puro、pCMV-VSV-G、psPAX2和RS-AAV-CMVNLS-EGFP 质粒购自连云港市创瑞生物制品贸易有限公司;异氟烷购自深圳市瑞沃德生命科技有限公司;RIPA 裂解缓冲液、PMSF 和CCK-8 试剂盒购自北京索莱宝科技有限公司;蛋白上样缓冲液购自上海碧云天生物技术有限公司;PVDF 膜购自德国默克集团;β 分泌酶1(BACE1)、胱天蛋白酶3(Caspase 3)、突触后致密蛋白95(PSD95)和GAPDH 兔抗鼠一抗购自美国Proteintech 公司;Pcif1、B 细胞淋巴瘤-2 相关蛋白X(Bax)、B 细胞淋巴瘤-2(Bcl-2)兔抗鼠一抗和羊抗兔二抗购自英国Abcam 公司;超敏ECL化学发光试剂盒购自苏州新赛美生物科技有限公司;嘌呤霉素购自安诺伦(北京)生物科技有限公司;细胞培养基、胎牛血清和Trizol 购自美国Gibco 公司;Annexin V-FITC/PI 双染试剂盒购自江苏凯基生物技术股份有限公司。立体定位注射仪和Morris 水迷宫设备购自深圳市瑞沃德生命科技有限公司;Western blot实验设备购自美国伯乐生命医学产品有限公司;化学发光成像系统购自美国赛默飞世尔科技有限公司;冰冻切片机购自德国徕卡公司;酶标仪购自美国伯腾仪器有限公司;倒置荧光显微镜购自日本奥林巴斯株式会社;流式细胞仪购自美国碧迪公司。
1.2 研究方法
1.2.1 在线数据库查询Pcif1在大脑的表达情况 检索Tabula Muris 数据库(tabula-muris.ds.czbiohub.org)查询Pcif1在小鼠大脑常见细胞中的RNA 表达水平[16]。检索Human Protein Atlas(https://www.proteinatlas.org/)数据库查询Pcif1在小鼠大脑重要区域的蛋白水平[17]。检索Human Brain Transcriptome(https://hbatlas.org/)数据库查询Pcif1在人脑重要区域的从出生到衰老的转录水平[18]。
1.2.2 shRNA 的设计及慢病毒和腺相关病毒的包装 靶向小鼠Pcif1的shRNA 序列的引物委托北京擎科生物科技有限公司合成,上游引物:5′-CCGGCCATCCATGTTTCGTGAAATTCTCGAGAATTTCACGAAACATGGATGGTTTTTG-3′;下游引物:5′-AATTCAAAAACCATCCATGTTTCGTGAAATTCTCGAGAATTTCACGAAACATGGATGG-3′。首先,引物退火后与经AgeⅠ和EcoRⅠ酶切的Plko.1-puro质粒连接、转化后构建慢病毒包装质粒。得到的质粒经过测序验证后,与pCMV-VSV-G 及psPAX2 质粒共同转染293T 细胞包装得到慢病毒LV-shPcif1。质粒上的shRNA 片段和U6片段被克隆出来,与XbaⅠ和SpeⅠ限制性内切酶切开的线性AAV包装质粒(RS-AAV-CMVNLS-EGFP)同源重组,得到的质粒进行AAV 包装,得到AAV-shPcif1 和AAV-EGFP。AAV-shPcif1和AAV-EGFP的病毒元件包括反向末端重复序列、巨细胞病毒启动子、增强绿色荧光蛋白和U6 启动子,Pcif1-shRNA 序列为AAV-shPcif1独有,病毒使用滴度为3.5×1012vp/mL。
1.2.3 立体定位注射AAV-shPcif1 敲低小鼠海马Pcif1小鼠按照随机数字表法分为3 组:Pcif1敲低组(注射AAVshPcif1)、假手术组(注射AAV-EGFP)和野生组(不做任何处理)。异氟烷麻醉小鼠,小鼠头部被固定在立体定位仪上,切开小鼠头皮暴露颅骨,并保持前后囟门的高度差和矢状缝左右10 mm 处的高度差均在0.3 mm 以内。使用手持颅钻钻开颅骨,微量注射器在左右背侧海马CA1区,即前囟后2.0 mm、矢状缝左右1.5 mm以及脑组织下1.0 mm处分别注射1 μL病毒,注射速率为100 nL/min。注射完成后常规饲养小鼠3周,使病毒充分表达。小鼠全脑冰冻切片荧光成像确认病毒进入海马组织,Western blot验证Pcif1的敲低效率。
1.2.4 Morris水迷宫实验测试小鼠空间学习记忆 立体定位注射3 周后对小鼠进行Morris 水迷宫测试,步骤参照文献[19-20],观察小鼠在平台可视期(第1天)的游泳速度、在训练期(第2~6天)的逃避时间以及在测试期(第7天)的跨平台次数和目的象限停留时间。
1.2.5 Western blot检测海马组织相关蛋白表达 使用RIPA裂解缓冲液和PMSF 提取海马组织蛋白。蛋白产物经4 ℃、5 000 r/min离心5 min,收集上清液。按4∶1的体积比例加入上样缓冲液,95 ℃加热15 min使蛋白变性。对变性蛋白溶液行聚丙烯酰胺凝胶电泳以分离蛋白,蛋白溶液的上样量根据Western blot预实验检测的内参蛋白的浓度进行调整。电泳结束后湿转法将蛋白转移至PVDF膜上,5%脱脂牛奶室温封闭60 min。然后将PVDF膜切割成合适大小的条带,将条带置于兔源Pcif1(1∶1 000)、Bax(1∶1 000)、Bcl-2(1∶2 000)、BACE1(1∶1 000)、Caspase 3(1∶2 000)、PSD95(1∶1 000)和GAPDH(1∶5 000)一抗中4 ℃孵育过夜。次日回收一抗,PBST洗膜3次,加入羊抗兔二抗(1∶2 000),室温孵育60 min。回收二抗,PBST洗膜3次,滴加ECL曝光液,化学发光成像系统中成像。
1.2.6 构建稳定敲低Pcif1的HT22细胞系 使用LV-shPcif1感染HT22 细胞(感染复数=1),完成感染后使用嘌呤霉素筛选细胞得到稳定敲低Pcif1的HT22 细胞(HT22-shPcif1 组)。使用对照慢病毒感染HT22细胞并进行筛选,得到对照HT22细胞(HT22-Ctrl组)。Western blot鉴定2组细胞Pcif1表达水平,方法参照1.2.5。
1.2.7 全转录组测序(RNA-seq) 使用Trizol 试剂提取HT22-Ctrl 组和HT22-shPcif1 组细胞总RNA,每组设3 个重复样本,所有样本RNA的完整度值均≥9.7。RNA质控及测序工作委托北京诺禾致源科技股份有限公司完成。使用Trim Glore 预处理RNA-seq 原始数据,使用Kallisto 将测序数据比对到mouse genome(vM25)参考基因组。基因差异倍数>1且FDR 校正后P<0.05 的基因定义为差异表达基因。在ToppGene Suite(http://toppgene.cchmc.org)对差异表达基因进行功能富集分析,富集结果进行FDR 多重比较校正(P<0.05)[21]。
1.2.8 细胞毒性实验(CCK-8)检测细胞增殖能力 提前将HT22-shPcif1和HT22-Ctrl细胞分别置于400 μmol/L H2O2条件下培养2 d,然后在0、12、24、36 和48 h 时间点使用CCK-8探针孵育细胞,方法参考CCK-8 试剂盒说明书,使用酶标仪检测490 nm波长处的光密度(OD)值,绘制细胞的增殖曲线。
1.2.9 细胞划痕检测细胞迁移能力 方法参考文献[22],将HT22-shPcif1组和HT22-Ctrl组细胞分别接种到6孔板,接种密度为1×105/孔。待细胞扩增到相互接触形成单层细胞薄层时,使用100 μL 的枪头划痕,在划痕后0 h 和36 h,在显微镜下观察并拍摄多个位置的细胞迁移状态。使用Photoshop CC2014软件测量空白区域的面积,计算细胞迁移率,细胞迁移率=(0 h划痕面积-36 h划痕面积)/0 h划痕面积×100%。
1.2.10 流式细胞术检测细胞凋亡 HT22-shPcif1 组和HT22-Ctrl组分别在400 μmol/L H2O2条件下培养2 d后,使用异硫氰酸荧光素(FITC)和碘化丙啶(PI)染剂孵育细胞,完成孵育的细胞在1 h 内使用流式细胞仪检测细胞总的凋亡水平,即早期和晚期凋亡细胞百分比之和。
1.3 统计学方法 除了RNA-seq 数据以外的实验数据均使用GraphPad Prism 8 软件进行统计分析,正态分布的计量资料以±s表示,2 组间均数比较采用独立样本t检验;3 组间比较采用单因素方差分析,组间多重比较采用Tukey’s 检验。非正态分布的计量资料以M(P25,P75)表示,组间比较采用Kruskal-Wallis检验。P<0.05为差异有统计学意义。
2 结果
2.1Pcif1在小鼠大脑内的表达水平 通过查询公共数据库发现,Pcif1在大脑中呈时空表达。Tabula Muris 数据库提示Pcif1在少突胶质细胞前体细胞、神经元、少突胶质细胞、周细胞、Bergmann 胶质细胞和内皮细胞中表达较高,见图1A。检索Human Protein Atlas数据库发现,Pcif1在小鼠大脑的多个脑区和核团中均有表达,表达量由高到低依次为嗅觉皮层、杏仁核、海马、大脑皮层、小脑、基底神经节、脑桥和髓质、丘脑、中脑和下丘脑,见图1B。检索Human Brain Transcriptome数据库发现,Pcif1在胚胎期高表达,出生后略有下降,但在整个生命过程中一直保持相对稳定的高表达,见图1C。
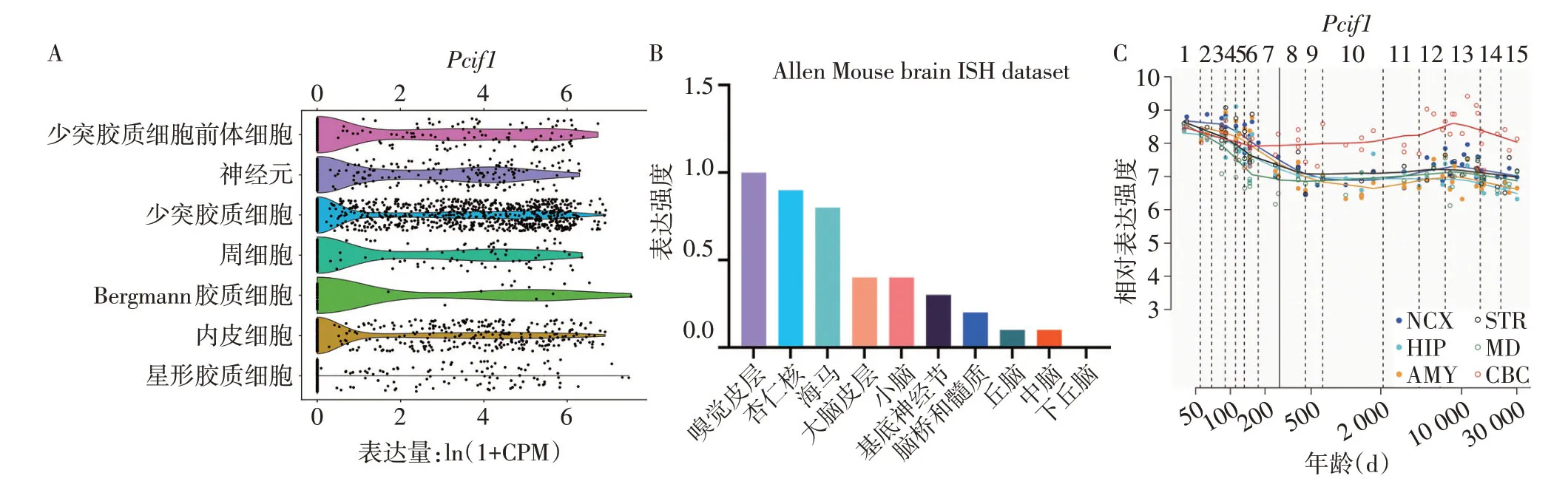
Fig.1 Pcif1 related expression data from Tabula Muris,Human Protein Atlas and Human Brain Transcriptome datasets图1 Tabula Muris,Human Protein Atlas和Human Brain Transcriptome数据库中有关Pcif1的表达数据
2.2 敲低海马Pcif1对小鼠的空间学习记忆的影响 立体定位注射3 周后,小鼠冰冻脑切片荧光成像在海马CA1区观察到绿色荧光,提示建模成功,见图2。在Morris水迷宫实验的第1天(平台可视期),3 组小鼠的游泳速度差异无统计学意义(P>0.05);在第5 天(训练期),敲低组的逃避时间短于假手术组(P<0.05);在第6 天(训练期),敲低组的逃避时间短于野生组(P<0.05);在第7 天(测试期),敲低组小鼠的目的象限时间显著长于其他2组,此时3组跨平台次数比较差异无统计学意义,见图3、表1。

Fig.2 Representative fluorescence image of frozen mouse brain section(×25)图2 小鼠冰冻脑切片荧光成像图(×25)

Fig.3 Representative swimming paths of mice from 3 groups图3 3组小鼠水迷宫测试游泳轨迹图
2.3 与敲低HT22细胞Pcif1有关的差异表达基因及其功能注释 与HT22-Ctrl组比较,HT22-shPcif1组细胞中共发现2 065 个差异表达基因,其中84 个基因显著上调,74个基因显著下调,见表2、图4。功能富集分析显示,表达上调基因在4 类分子功能、118个生物学过程和4 种细胞成分中显著富集,主要与细胞凋亡、迁移和增殖有关;表达下调基因主要在6类分子功能和42个生物学过程富集,见图5。
2.4 HT22-shPcif1 组细胞在正常环境下迁移能力的变化及H2O2环境下凋亡和增殖能力的变化 Western blot 结果证实,HT22-shPcif1 组细胞中Pcif1表达较HT22-Ctrl组明显下调,见图6。细胞划痕实验发现,在正常培养条件下HT22-shPcif1 组细胞的迁移率比HT22-Ctrl 组更高(P<0.01),见图7、表3。在400 μmol/L H2O2条件下培养48 h 后,CCK-8 实验显示HT22-shPcif1 组细胞的增殖能力高于HT22-Ctrl 组,见图8;流式细胞术结果显示,HT22-shPcif1 组细胞的凋亡率相比HT22-Ctrl 组显著降低(P<0.01),见图9、表3。

Tab.1 Morris water maze results of 3 groups of mice表1 3组小鼠Morris水迷宫测试结果 (n=9)

Tab.2 Differentially expressed genes of HT22-shPcif1表2 HT22-shPcif1差异表达基因

Fig.4 Volcano plot of differentially expressed genes of HT22-shPcif1图4 HT22-shPcif1差异表达基因火山图
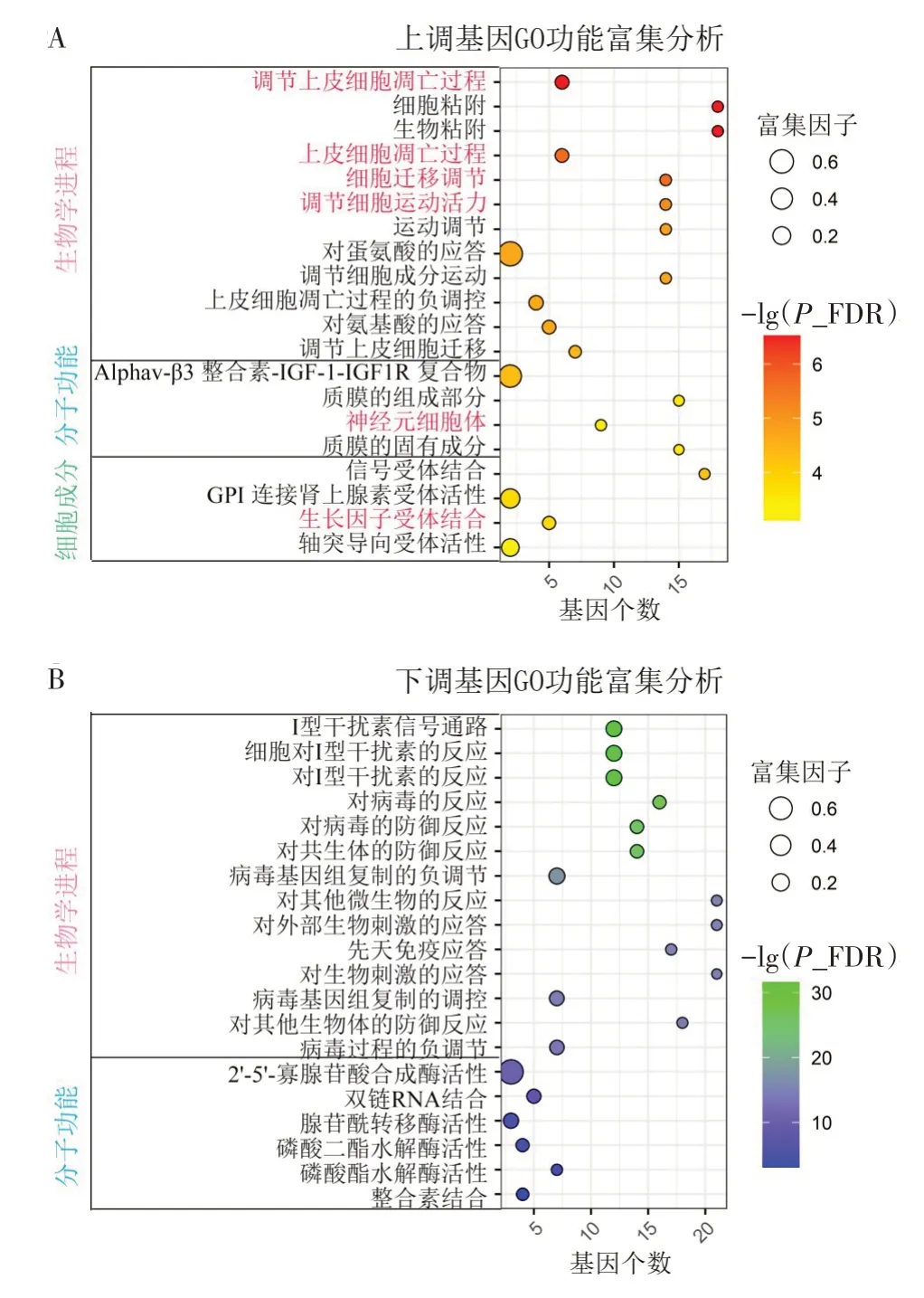
Fig.5 GO analysis of differentially expressed genes of HT22-shPcif1图5 HT22-shPcif1差异表达基因GO分析

Fig.6 Protein levels of Pcif1 in HT22-shPcif1 and HT22-Ctrl cells measured by Western blot assay图6 Western blot检测HT22-shPcif1和HT22-Ctrl细胞的Pcif1蛋白水平

Fig.7 Comparison of migration between HT22-shPcif1 and HT22-Ctrl cells(×100)图7 HT22-shPcif1和HT22-Ctrl细胞迁移的比较(×100)
Tab.3 Comparison of cell migration and apoptosis of HT22-shPcif1 and HT22-Ctrl cells表3 HT22-shPcif1和HT22-Ctrl细胞迁移和凋亡比较 (n=3,%,±s)

Tab.3 Comparison of cell migration and apoptosis of HT22-shPcif1 and HT22-Ctrl cells表3 HT22-shPcif1和HT22-Ctrl细胞迁移和凋亡比较 (n=3,%,±s)
**P<0.01。

Fig.8 Growing curves of HT22-shPcif1 and HT22-Ctrl cells under 400 μmol/L H2O2 condition图8 400 μmol/L H2O2条件下HT22-shPcif1和HT22-Ctrl细胞的生长曲线
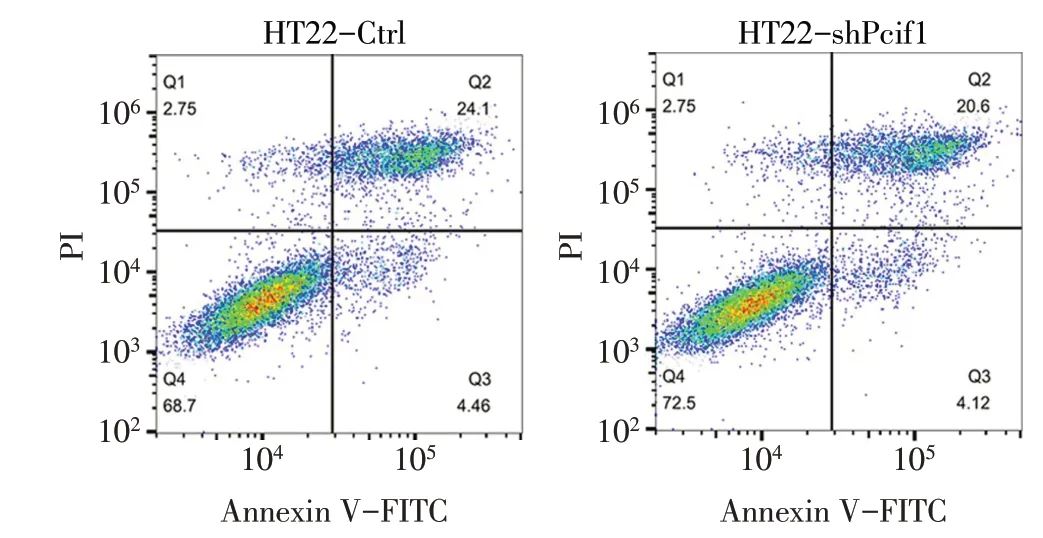
Fig.9 Comparison of apoptosis measured by flow cytometry between HT22-shPcif1 and HT22-Ctrl cells under 400 μmol/L H2O2 condition图9 400 μmol/L H2O2条件下流式细胞术检测HT22-shPcif1和HT22-Ctrl细胞凋亡比较
2.5 敲低Pcif1 促进小鼠海马组织中抗凋亡蛋白的表达 Western blot 结果显示,与野生组和假手术组相比,敲低组小鼠海马组织Pcif1 的表达显著下调(P<0.05);抗凋亡蛋白Bcl-2 显著上调(P<0.05),促凋亡蛋白Bax和Caspase3的表达水平差异无统计学意义(P>0.05)。敲低组BACE-1 蛋白的表达较野生组和假手术组显著上调;PSD95 蛋白表达差异无统计学意义。见图10、表4。

Fig.10 The relative expression of Pcif1,Bcl-2,Bax,Caspase3,BACE-1 and PSD95 in hippocampal tissues of three groups of mice measured by Western blot assay图10 Western blot检测3组小鼠海马组织Pcif1、Bcl-2、Bax、Caspase3、BACE-1和PSD95的相对表达
3 讨论
3.1Pcif1在小鼠的大脑的主要区域终生维持较高的表达水平 公共数据库提供的信息表明,无论是基因还是蛋白质水平,Pcif1在小鼠大脑中均保持较高的表达水平。在人脑中,Pcif1终生维持较高的表达水平,由于Pcif1具有高度的进化保守性[23],其在小鼠的大脑中也应该终生表达。Pcif1的广泛表达与m6Am在小鼠脑内的广泛分布具有一致性[24]。据此可以推测,Pcif1能够像其他RNA甲基化调节蛋白酶一样,对大脑的生理功能具有重要的调节作用。
3.2 敲低海马Pcif1的表达能够促进小鼠的空间学习记忆 本研究发现,Morris 水迷宫测试实验结果与预期相反,敲低海马组织的Pcif1促进了小鼠的空间学习记忆。以往研究表明,其他RNA甲基转移酶和RNA 甲基位点结合蛋白对大脑的可塑性和学习记忆起有益的调节作用,而RNA去甲基化酶则起不利的调节作用。例如,在小鼠脑组织敲低Mettl3会导致小脑发育异常,并提高小脑内新生的颗粒细胞的凋亡水平[25];条件性敲除海马组织的Mettl3和YTHDF1会损害小鼠的长期记忆形成[5-6];下调海马组织的Fto可增强小鼠的恐惧记忆[9]。总体来说,RNA 甲基转移酶促进小鼠的认知能力,这是因为其能催化并维持RNA甲基化修饰,从而对相关基因的RNA 翻译和RNA 定位起正向调节作用[26]。Pcif1对小鼠空间学习记忆的调控与其他RNA 甲基转移酶相反,可能是由于催化的RNA 甲基化种类不同,Pcif1催化形成m6Am,而Mettl3催化形成m6A。m6Am 修饰仅发生在mRNA 的5′端帽子结构后的第1 个腺嘌呤上,而m6A 修饰主要发生在mRNA 的3′未翻译区域和终止密码子的腺嘌呤上。m6A是哺乳动物mRNA 最常见的修饰,而m6Am 的含量只占m6A 含量的1/30~1/10。m6Am 和m6A 修饰的位置及含量的差异可能会导致甲基基团对mRNA理化性质影响不同,最终影响基因的表达以及小鼠空间学习记忆的表现。
3.3 敲低Pcif1会导致细胞的凋亡、迁移和增殖发生变化 对HT22-shPcif1 细胞进行RNA-seq 分析,发现了许多差异表达基因,这些基因能够富集到细胞凋亡、迁移和增殖等通路,提示Pcif1对细胞凋亡、迁移和增殖等重要功能具有调节作用。细胞实验验证了RNA-seq 的预测结果,细胞划痕实验表明敲低Pcif1后细胞的迁移、增殖能力提高,细胞凋亡水平下降。海马组织的Western blot 结果表明敲低Pcif1会促进海马组织内的抗凋亡蛋白的表达,该结果与细胞实验一致,表明敲低Pcif1可通过上调抗凋亡蛋白降低细胞的凋亡水平。
Tab.4 Comparison of hippocampal relative protein levels of Pcif1,Bcl-2,Bax,Caspase3,BACE-1 and PSD95 of three groups of mice表4 3组小鼠海马组织Pcif1、Bcl-2、Bax、Caspase3、BACE-1和PSD95蛋白相对水平 (n=3,±s)
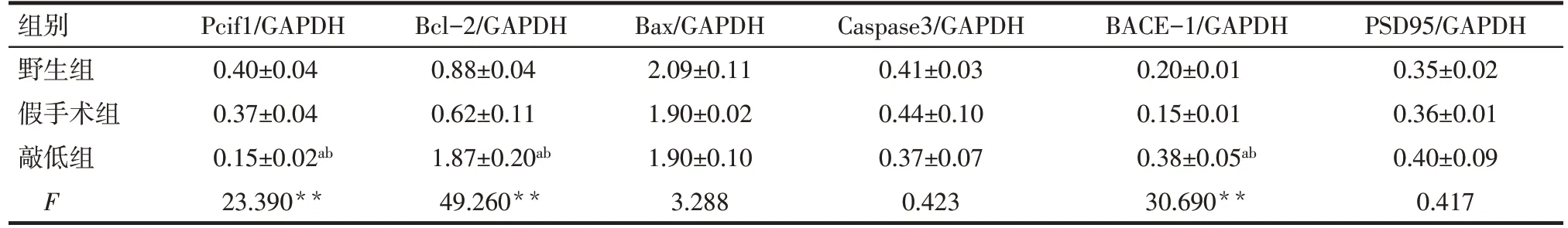
Tab.4 Comparison of hippocampal relative protein levels of Pcif1,Bcl-2,Bax,Caspase3,BACE-1 and PSD95 of three groups of mice表4 3组小鼠海马组织Pcif1、Bcl-2、Bax、Caspase3、BACE-1和PSD95蛋白相对水平 (n=3,±s)
**P<0.01;a与野生组比较,b与假手术组比较,P<0.05。
3.4Fgf21是潜在的Pcif1影响学习记忆的中介因子 有研究发现,Fgf21具有神经保护作用,能在体内和体外降低细胞凋亡水平[27],而神经元凋亡水平升高会损害个体的认知功能[28];敲除Fgf21会降低上皮细胞迁移和伤口愈合速率[29],而神经元迁移可以促进长期记忆的形成[30];上调Fgf21的表达会促进海马神经元再生[31],足够的正常神经元对于维持突触网络和信息传递至关重要。另外,给AD大鼠注射外源性Fgf21会缓解AD 大鼠的记忆障碍和降低磷酸化tau 表达及氧化应激[27]。本研究发现,敲低Pcif1会促进细胞的迁移、抗凋亡和增殖等功能,这与上调Fgf21对细胞功能的影响一致。RNA-seq 也证实了Fgf21在HT22-shPcif1 细胞中的表达量显著增加了1.86 倍,进一步增加了Fgf21是中介因子的可能性。笔者下一步计划在海马共同敲低Pcif1和Fgf21,研究其对小鼠空间学习记忆的影响;在HT22细胞上共同敲低Pcif1和Fgf21,研究其对细胞迁移、增殖和凋亡的影响,明确Fgf21是否为敲低Pcif1促进空间学习记忆的中介因子。
综上所述,敲低海马RNA甲基转移酶Pcif1对神经系统是有利的,在细胞水平,能够上调抗凋亡蛋白表达、促进细胞迁移和增殖;在动物水平,能够促进小鼠的空间学习记忆能力。

