孤立性小脑后下动脉夹层的高分辨磁共振管壁成像表现
谢珊珊,冉云彩,王 潇,刘娟芳,付其昌,张 勇,程敬亮
1)郑州大学第一附属医院磁共振科 郑州 450052 2)郑州大学第一附属医院介入科 郑州 450052
小脑后下动脉(posterior inferior cerebellar artery,PICA)是椎动脉颅内段最大的分支,在小脑的血供中起着重要作用。PICA供血区是小脑缺血性卒中最常见的梗死发生区域,约占40%[1]。PICA供血区梗死的病因包括大动脉粥样硬化、心源性栓塞、椎动脉夹层以及PICA原位分支病变等[2]。继发于PICA夹层(PICA dissection,PICAD)的缺血性脑梗死十分少见,加之PICA管径细小,检查手段有限,因此,有关PICAD临床和影像表现的报道很少。近年来,随着影像技术不断发展和完善,尤其是高分辨磁共振管壁成像(high-resolution magnetic resonance vessel wall imaging,HRMR-VWI)技术的临床应用,PICAD越来越多地被发现和诊断。本文回顾性分析了 8例PICAD的临床和MRI表现特点,并结合文献复习,探讨PICAD的HRMR-VWI特征,以帮助临床诊断。
1 对象与方法
1.1 研究对象回顾性分析2019年1月至2020年1月在郑州大学第一附属医院磁共振科进行HRMR-VWI且经临床诊断为孤立性PICAD患者的资料。PICAD诊断标准主要参照颅内动脉夹层诊断共识和标准[3]。入选标准:①具有和PICA供血区有关的延髓或小脑急性缺血症状和体征。②影像学未见蛛网膜下腔或脑室内出血。③MR影像特征有夹层征象,如动脉偏心性狭窄伴外管径扩张、串珠征或节段性狭窄、壁间血肿、双腔征、内膜瓣和夹层动脉瘤等[4-5],且这些征象均未累及椎基底动脉。④无明显心源性栓塞的证据。⑤ 1个月内无外伤史。最终共纳入8例患者。本研究符合《赫尔辛基宣言》原则及相关伦理要求。
1.2 检查方法MRI采用德国西门子Prisma 3.0 T MR扫描仪,64通道头颈联合线圈。扫描序列包括头部MRI常规序列、HRMR-VWI平扫和增强T1WI以及头颈部MRA序列。头部MRI常规序列包括T1WI、T2WI、液体衰减反转恢复序列(fluid attenuation inversion recovery imaging,FLAIR)和扩散加权成像序列(diffusion weighted imaging,DWI)。HRMR-VWI平扫采用优化的三维可变翻转角度快速自旋回波T1加权(T1-weighted-sampling perfection with application of optimized contrasts using different flip angle evolution,T1W SPACE)序列;扫描参数:TR 900 ms,TE 15 ms,FOV 200 mm×200 mm,矩阵320×320,层厚 0.6 mm,采集时间7 min 36 s。增强扫描对比剂为钆喷酸葡胺(德国拜耳公司),注射速率1.5 mL/s,注射剂量2 mL/kg。采用西门子后处理软件对原始矢状位图像进行轴位、冠状位重建。头颈部MRA采用三维时间飞跃法(time of flight,TOF);扫描参数:TR 20 ms,TE 3.63 ms,FOV 200 mm×200 mm,矩阵 256×256,层厚1.0 mm,采集时间8 min 46 s。8例均完成上述MRI检查,另有4例完成磁敏感加权成像(susceptibility-weighted imaging,SWI)。
所有MRI图像均由两名具有5 a以上阅片经验的磁共振科医生进行独立判读,判断过程中隐藏患者的临床信息,对于是否存在PICAD和缺血性病变意见不一致时协商确定。
2 结果
PICAD患者的临床特征见表1。8例中,男7例,女1例,年龄31~65岁。其中,5例出现头晕,3例出现恶心或呕吐,其他如共济失调、颜面部及肢体麻木、肢体无力等较少见(表1)。所有患者均无明显诱因(外伤、颈部按摩、过度体力活动、血液系统疾病或结缔组织病);除1例患者外,余7例均伴有明显的血管危险因素。美国国立卫生研究院卒中量表(NIHSS)评分除1例为2,1例为3外,其余患者入院时均为0或1。
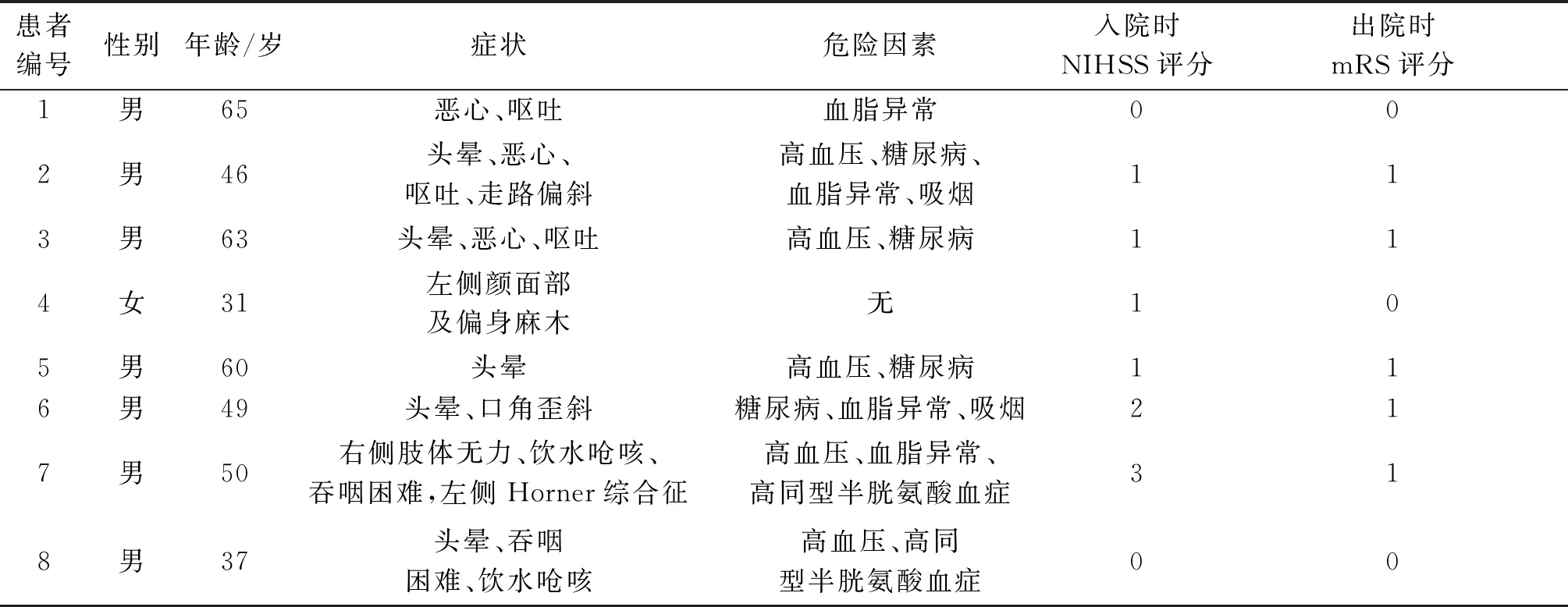
表1 PICAD患者的临床特征
PICAD患者的MRI表现见图1及表2。自患者起病到获取第一次DWI及常规平扫序列的时间为4 h~4 d,其中2例为外院图像。DWI显示PICA急性梗死区域:3例为单侧小脑,2例为延髓外侧份,1例为单侧小脑和同侧延髓外侧份,1例为单侧小脑和同侧小脑扁桃体,1例为单侧小脑、小脑蚓部和延髓外侧份。轴位T1WI、T2WI、FLAIR序列上PICA走行区均未发现明显异常。

上排:病例2;中下排:病例3。A:DWI显示右侧小脑半球可见斑片状弥散受限稍高信号,提示亚急性脑梗死;B:MRA上右侧PICA未见显示;C:HRMR-VWI平扫显示右侧PICA延髓外侧段后壁增厚呈稍短T1信号,D:HRMR-VWI增强扫描呈明显半月形强化;E:DWI显示右侧小脑斑片状弥散受限高信号,提示急性脑梗死;F:MRA原始图像上右侧PICA近端浅淡显影,以远闭塞;G:重建冠状位增强T1WI可见强化范围延续至带帆扁桃体段;H:HRMR-VWI平扫示右侧PICA延髓外侧段条状稍短T1信号;I:HRMR-VWI增强扫描呈明显强化
SWI、MRA和HRMR-VWI的检查时间一致。4例行SWI,其中3例显示PICA条状低信号,1例未见明显异常。MRA原始图像上2例PICA未见明显异常,2例未见显影,2例闭塞,1例狭窄,1扩张。根据患者起病至获取HRMR-VWI的时间[6],分为急性期(0~3 d)1例,亚急性早期(4~9 d)4例,亚急性晚期(10~60 d)3例。HRMR-VWI显示8例PICAD中,7例夹层位于右侧,1例位于左侧,病变侧PICA均起源于同侧椎动脉颅内段;3例PICA延髓前段或外侧段壁间血肿,呈半月形或环状等T1信号,其中1例管腔狭窄,2例管腔未见明显异常;2例表现为PICA起始处管腔扩张并管腔内血栓形成;2例表现为PICA延髓外侧段-带帆扁桃体段血管外径增粗,呈条状稍短T1信号,提示存在壁间血肿;1例表现为PICA延髓前段及外侧段串珠样改变,腔内呈短T1信号,提示腔内血栓形成。增强后,除1例未见强化外,余异常血管阶段均可见明显强化。具体见表2。

表2 PICAD的影像表现
患者3在发病4 h时给予静脉溶栓,而后改为抗血小板治疗;余患者均接受抗血小板药物治疗,病程稳定。所有患者出院时mRS评分为0或1。
3 讨论
3.1 PICAD的临床特征PICA从近端到远端可分为5段[7]:延髓前段、延髓外侧段、扁桃体延髓段、带帆扁桃体段、皮层段。通常,PICAD的临床表现和夹层发生的位置有关,发生在PICA近端的夹层多引起缺血性脑梗死,而远端夹层多引起蛛网膜下腔出血[8]。此外,后循环的夹层动脉瘤由于破裂多引起蛛网膜下腔出血,而夹层造成的血管狭窄甚或闭塞往往引起缺血性事件[9]。本组病例中,所有患者均未形成夹层动脉瘤,且大多数病变发生在PICA近端,仅1例延续至带帆扁桃体段,临床上均表现为缺血性脑梗死。头晕或恶心、呕吐是本组患者最常见的临床症状,与之前报道[10]的枕部疼痛为常见症状不符,可能与本组病例中梗死部位多累及前庭小脑有关。以往的研究[8]提示PICAD可能和高血压、外伤、结缔组织病等有关,但其根本原因尚无定论。本组患者均无外伤、颈部按摩、过度体力活动、结缔组织疾病等诱因;7例均伴有明显的血管危险因素如高血压、糖尿病、血脂异常等。
3.2 PICAD的影像表现
3.2.1PICAD的传统影像表现 脑动脉夹层的诊断中,最常用的影像技术有数字减影血管造影(digital subtraction angiography,DSA)、CT血管造影(computed tomography angiography,CTA)和MRA。内膜瓣和双腔征是最典型的夹层征象,但在临床中,上述征象仅见于少数病例[11]。串珠征、线样征和梭形扩张是动脉夹层在DSA上常见的影像学征象,但其他病变如肌纤维发育不良等也会有类似表现[12]。此外,DSA上还可观察到动脉夹层呈锥形狭窄或闭塞,但不是夹层的确诊征象。CTA和MRA上的表现与DSA相仿,但CTA和MRA在显示内膜瓣和双腔征上优于DSA[13]。MRA原始图像上可观察到内膜瓣和双腔征,但有时常被误认为血流伪影而漏诊[14]。PICA不仅管径细小、走行曲折,且变异率高。据报道[2,7],PICA发育不良占15%~32%,一侧缺失占6%~26%。因此,MRA对PICA的显示及评估更为困难。本组病例中,MRA显示2例闭塞,1例扩张,具有一定提示意义;余1例狭窄、2例未显影,首先需与一侧PICA发育不良或缺失相鉴别;另2例未见明显异常,推测与夹层壁间血肿未引起管腔形态的改变有关。
3.2.2PICAD的HRMR-VWI表现 近年来的一些研究[15-17]表明HRMR-VWI可以用来诊断孤立性PICAD。PICAD在HRMR-VWI上多表现为壁间血肿、内膜瓣、扩张的血管外径、串珠征等。壁间血肿是动脉夹层在磁共振管壁成像上最常见的征象[18],表现为受累血管外径扩张,管壁增厚多呈新月形,且增厚管壁边缘光滑。壁间血肿的信号强度随时间变化[4],与顺磁性铁成分随时间的信号变化有关,亚急性期呈高信号,易于诊断;而到了慢性期(也有报道在亚急性晚期[19]),血肿在T1WI上呈等信号,与邻近组织分界不清,不易于诊断。本组病例中,5例可见壁间血肿,其中2例伴血管外径明显扩张。例4壁间血肿较小且呈等T1信号,HRMR-VWI难以确诊,但该例患者SWI上显示相应位置存在条状低信号,因SWI上动脉偏心或同心状低信号往往提示夹层壁间血肿[20],结合患者并无动脉粥样硬化的危险因素,因而做出了PICAD的诊断。
动脉夹层常导致管腔形态的改变,包括扩张、狭窄、不规则狭窄伴扩张(即串珠征)以及完全闭塞。若管腔完全闭塞或有血栓形成,管腔成像技术如DSA、CTA或MRA均不能有效显示管腔情况,HRMR-VWI不仅弥补了这一不足,还能够同时显示管壁和外膜周围组织的情况,是颅内动脉夹层的首选检查技术。本组病例中,MRA显示病变PICA管腔1例狭窄,1例扩张,2例未见明显异常,对应的HRMR-VWI上均可见壁间血肿形成;2例MRA未显影者,一例HRMR-VWI可见壁间血肿,一例血管呈串珠样改变并可见腔内血栓形成。2例管腔闭塞者HRMR-VWI上可见管腔增粗,腔内血栓填充,鉴于这2例患者基底动脉及椎动脉颅内段未见明确斑块形成,且斑块破溃引起的血栓往往不伴管腔的扩张,结合临床排除了心源性栓塞和凝血功能异常的因素,最终诊断结果考虑为PICAD。据此,若颅内动脉内血栓形成并伴有管腔的扩张时,应想到夹层的可能。
此外,由于管径细小且走行迂曲多变,常规的成像序列很难观察到PICA全貌。T1W-SPACE为大范围各项同性采集,可进行后续的多平面和曲面重建。通过三维重建,能够清晰观察到PICAD的病变范围。本组有2例累及范围较广,从PICA延髓前段延续至带帆扁桃体段多个血管节段均可清晰显示。曾有学者[21]通过三维曲面重建观察到PICAD的内膜瓣,但本组均未观察到内膜瓣,可能是因为病例数较少,且当夹层病变节段腔内形成血栓时,往往掩盖了内膜瓣及双腔等典型征象。
本研究的局限性在于样本量较小,且没有进行后续HRMR-VWI的随访。鉴于此,后续会纳入更多的PICAD患者进行前瞻性的研究。
综上,HRMR-VWI是诊断PICAD的有效手段,可以清晰显示壁间血肿、血管形态改变、腔内血栓等征象,推荐作为PICAD诊断和随访的首选检查方法。

