酵母糖蛋白工程的研究进展
李婉情,张 蕾
(天津大学生命科学学院,天津 300072)
使用生物系统生产生物药物这一理念于1982年提出[1],几十年来,大量生物药物的出现改变了许多疾病的治疗方法。在生物药物中,70%以上的是糖蛋白,这显示了生物表达系统对蛋白进行糖基化修饰的重要性,常见的糖基化修饰类型有N-糖基化和O-糖基化。能够进行糖基化修饰的生物系统有酵母、哺乳动物细胞、昆虫细胞和转基因动物等。其中酵母表达系统中,常用的生产重组蛋白的菌株有酿酒酵母(Saccharomyces cerevisiae)和毕赤酵母(Pi⁃chia pastoris),约有20%的生物药物是由酿酒酵母生产的。
酵母作为一种真核单细胞微生物,其培养方式简单、生长速度快,可在60 h 内到达平台期,与哺乳动物细胞培养相比,缩减了生产目的产品的时间和成本。1996、2009 年分别完成了酿酒酵母和毕赤酵母的基因组测序[2,3]。除作为第一个完成测序的真核生物之外,酵母也存在完整的单基因缺失文库[4],这进一步推进了对酵母基因功能的研究[5-7],目前,已经对约5 800 种蛋白质的生物学功能有基础的了解,约占总量的85%,这一比例远远高于其他真核生物。在酵母中可使用多种基因编辑系统,如同源重组,酿酒酵母拥有极强的同源重组能力,40 bp 的同源序列即可完成重组,但该系统无法回收筛选标记。Cre/loxP位点特异性重组系统[8]和CRISPR/Cas9 系统在酵母中成功构建并解决了这个问题,实现了筛选标记的回收与利用。Dicarlo 等[9]首次在酵母中以90 bp 的双链DNA 作为供体,使用CRISPR/Cas9 系统进行基因的破坏和插入,均可达到近100%的效率。为了进一步提高基因编辑的效率,衍生出CRISPR/Cas9 多基因编辑系统,Shi 等[10]使用CRISPR/Cas9 开发了1个Di-CRISPR平台,该平台实现了总长为24 kb的(R,R)-2,3-丁二醇途径的DNA 大片段的整合。这些高效的基因编辑系统的构建也进一步推动了酵母工程菌株的研究进程。
酵母能够对蛋白质进行翻译后修饰,如二硫键形成、亚基组装、乙酰化和糖基化等[11],但对外源蛋白独特的N-高甘露糖基化修饰方式可能会引起免疫反应,并导致血液中治疗性蛋白质被快速清除[12,13]等影响,限制了酵母系统的应用范围。为了进一步发挥酵母的应用价值,需要在酵母中引入人源糖蛋白修饰途径,改变糖蛋白的修饰类型。本研究介绍了酵母在蛋白生产方面的应用、N-糖基化修饰过程以及人源化改造的研究进展。
1 酵母在蛋白生产方面的应用
许多细菌和真核细胞被用作生产药物蛋白的平台,其中原核生物大肠杆菌是最常用的系统之一,1982 年使用该系统生产的第一个重组胰岛素的批准[1]开启生物药物研究的大门,目前使用该系统产生的重组蛋白占总产量的30%以上[14]。但由于原核系统无翻译后修饰进程,不能正确形成二硫键的局限性,使其只能生产无需修饰的小型重组蛋白。而真核表达系统可以突破这种限制,常用的真核系统包括仓鼠卵巢细胞[15]、昆虫细胞[16]和酵母[17]等。与其他的哺乳动物表达系统相比,酵母系统不仅培养成本低,而且酵母细胞壁的存在也增加了细胞的耐受性,使其不容易受到温度、pH 以及环境中其他物质的影响。除此之外,酵母中各种成熟高效基因编辑系统的使用,简化了基因编辑的过程,缩减了工程化酵母构建的时间,例如Horwitz 等[18]运用酵母天然的间隙修复能力[19],将具有同源序列的gRNA 片段在菌体内修复成完整质粒,进行正常CRISPR/Cas9 基因编辑进程,敲除3 个基因,效率可达到64%,且省去了体外构建gRNA 质粒的时间。这一系列优势使酵母成为热门的细胞工厂。
1987 年酿酒酵母生产的重组胰岛素被正式批准[1],此后以酵母为表达系统产生的一系列药物蛋白陆续投入使用。如表1 所示,使用酵母系统产生的药物蛋白主要包括激素(如胰岛素类似物和生长激素)、疫苗(如人乳头瘤病毒疫苗和乙肝疫苗)以及血液相关因子物质等[20]。然而,由于酿酒酵母本身特有的对蛋白的N-高甘露糖基化修饰[21]可能会减弱糖蛋白的活性、改变免疫原性并减少其半衰期。与酿酒酵母相比,毕赤酵母糖基化修饰程度和糖基化位点占有率有所减少,通常酿酒酵母中产生约50个甘露糖残基,而毕赤酵母中产生约30 个甘露糖残基。并且毕赤酵母可以进行高密度细胞培养的特性能够进一步提高产品产量。为了减少酵母的甘露糖基化修饰程度,敲除酵母中α-1,6 甘露糖基转移酶编码基因OCH1,负责添加α-1,6 甘露糖主链的的第一个α-1,6-Man,起始甘露糖主链的形成[22](图1)。在酿酒酵母中OCH1和MNN9基因的敲除使其细胞壁的完整性遭到破坏,进而造成缺失株严重的生长缺陷[23]。但将毕赤酵母中OCH1基因敲除之后,缺失株的生长状况没受到显著影响[24],并且在该菌株中引入哺乳动物糖基转移酶基因,成功产生复杂的唾液酸化糖蛋白[25,26],这使其在生产生物药物方面拥有更加广阔的前景。

表1 使用酿酒酵母和毕赤酵母生产的蛋白产品
2 酵母的N-糖基化过程
在酵母中,蛋白的糖基化修饰分为2 种类型:N-糖基化和O-糖基化,其中N-糖基化修饰对蛋白活性的维持,促进蛋白分泌以及维持蛋白热稳定性具有重要作用[26,27]。如图1 所示,酿酒酵母的N-糖基化修饰进程可以分为2 部分,前半部分进程发生在内质网中,以磷酸多萜醇(Dol-P)为载体,在糖基转移酶、甘露糖苷酶和寡糖基转移酶等的作用下,最终形成结构为Man8GlcNAc2寡糖链,并连接在蛋白质的天冬氨酸残基上,这一进程在真核生物中较为保守[21]。之后该寡糖肽进入高尔基体中,在糖基转移酶和糖苷酶等的作用下形成高甘露糖基化的糖链。这一进程与哺乳动物相比,产生了明显的差异。在哺乳动物中,该寡糖肽经过甘露糖苷酶修饰,形成糖链结构为Man5GlcNAc2寡糖肽,之后在岩藻糖基转移酶、半乳糖基转移酶等酶作用下,形成杂合性或者复杂型聚糖结构[28,29]。
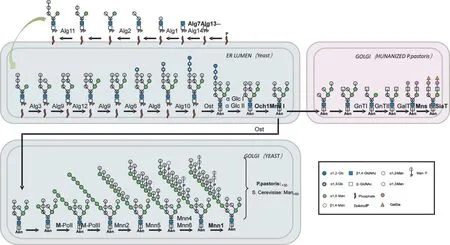
图1 酵母与人源化毕赤酵母的N-糖基化途径
2.1 酵母内质网中寡糖结构的组装
在Alg7 的作用下,将GlcNAc-1-P 转移Dol-P 载体 上 形 成Dol-PP-GlcNAc[30];在Alg13/Alg14、Alg1的作用下依次添加β-1,4-GlcNAc、β-1,4-Man 形成Dol-PP-GlcNAc2Man5;在Alg2 2 次连续作用下添加α-1,3-Man、α-1,6-Man,之后在Alg11 的作用下添加α-1,3-Man 形成Dol-PP-GlcNAc2Man5,完成寡糖链在内质网膜胞质一侧的组装。在翻转酶的作用下将与磷酸多萜醇连接的寡糖翻转到内质网膜内部[31],按照Alg3、Alg9、Alg12、Alg9、Alg6、Alg8、Alg10的顺序在寡糖上依次添加α-1,3-Man、α-1,2-Man、
α-1,6-Man、α-1,6-Man、α-1,3-Glc、α-1,3-Glc、α-1,2 -Glc,形成Dol-PP-Man9GlcNAc2Glc3。之后磷酸多萜醇上的寡糖链在寡糖基转移酶复合物的作用下(Oligosaccharyltransferase Complex,OST)与蛋白质上特定的天冬氨酸残基连接形成寡糖肽[32]。接下来,在葡糖苷酶(Gls2、Gls2/Gtb1)、甘露糖苷酶(Mns1)作用下依次去除3 个α-Glc 和1 个α-1,2-Man,形成糖链结构为Man8GlcNAc2的寡糖肽,并转移到高尔基体中[33]。
2.2 酵母高尔基体中寡糖结构的组装
寡糖肽进入高尔基体之后,甘露糖基转移酶(Och1)将α-1,6-Man 添加到寡糖的α-1,3-Man 上,启动甘露糖外链的延伸进程[21]。OCH1基因的敲除会导致酵母细胞壁的完整性被破坏,生长速度降低,代谢进程异常等影响[34]。寡糖肽在蛋白复合物Man-Pol I 和Man-Pol II 的依次作用下,在酿酒酵母中将糖链延伸至50 个甘露糖左右,在毕赤酵母中延伸至约30 个甘露糖残基形成甘露糖主链;由Mnn2添加主链上第一层α-1,2-Man 侧链,Mnn5 添加第二层α-1,2-Man,Mnn4 负责Mnn-P 结构的添加,最后Mnn1 可以在寡糖链的Mnn-P 上添加α-1,3-Man[35]。敲除MNN1未对酵母生长产生显著影响,也未显著降低蛋白的糖基化修饰程度[36]。
3 酵母糖基化修饰的人源化改造
酵母的糖基化修饰可以帮助蛋白折叠,但是酵母中这种独特的N-糖基化对蛋白具有负面影响,比如抑制蛋白酶的活性或改变蛋白免疫原性等[37],因此希望构建能够去除酵母糖特异性糖基化修饰并生成复合型糖基化的工程酵母菌株。近些年来,在酵母中进行人源糖基化改造,基本遵循2 种主要策略,一种是消除酵母糖基转移酶,另一种是干扰脂连接寡糖(Lipid-linked oligosaccharide,LLO)的组装降低蛋白的糖基化修饰程度,之后引入哺乳动物中的糖基转移酶实现人源化糖链的合成。
近些年对酵母进行改造及产生的糖链类型见表2。在酵母中进行人源化改造的第一步,需要通过敲除酵母中在N-高甘露糖链合成中的关键基因,来降低酵母中的糖基化修饰程度,如图1 所示,酵母中OCH1基因编码α-1,6-甘露糖基转移酶,是甘露糖外链形成的关键基因。在酿酒酵母中敲除OCH1基因 后,可 以 检 测 到 糖 链 结 构Man9-10GlcNAc2[36]。Mnn4 和Mnn1 分别负责Mnn-P 和最后1 个α-1,3-Man 的添加。在三重缺失酿酒酵母菌株Δoch1 Δmnn1 Δmnn4中引入来自海枣曲霉的α-1,3-甘露糖苷酶后,酵母中检测到更接近哺乳动物的糖链结构Man5GlcNAc2[38]。但是,由于酵母细胞壁中甘露糖残基约占细胞壁的10%~20%,该工程酵母菌株中甘露糖外链的缺失,导致酵母细胞壁完整性缺失,造成严重的生长缺陷。研究发现,酵母中BEM4和BEM4下游基因RHO1过表达可以在一定程度上恢复Δoch1缺失株的生长缺陷[39]。其中Bem4 蛋白可能与细胞信号转导途径相关,Rho1 蛋白调节蛋白激酶C(Pkc1p)和细胞壁合成酶(β-1,3-葡聚糖合酶)。推测由于BEM4和RHO1的过表达增加了β-葡聚糖的合成,修复OCH1缺失造成的细胞壁合成缺陷。因此,通过表达酵母中细胞壁合成相关的基因或与β-1,3-葡聚糖合成的相关基因,在一定程度上能够弥补菌株由于OCH1缺失造成的甘露糖链合成缺陷的问题。在毕赤酵母中破坏OCH1表达后,检测到酵母细胞中主要糖链类型为Man8-12GlcNAc2,并且该基因的敲除未对酵母生长产生显著影响[40]。造成这一差异的主要原因有2 点,一是由于与酿酒酵母相比,毕赤酵母中N-糖基化修饰位点减少,糖基化程度减弱,细胞壁中甘露糖含量低[11],所以糖蛋白中甘露糖含量的减少对毕赤酵母细胞壁完整性的影响较小,二是由于在Δoch1缺失菌株中检测到截短的Och1 蛋白活性,或许该蛋白的存在维持了缺失菌株正常生命活动[41]。之后,在该菌株中引入哺乳动物糖基转移酶基因,成功产生了复杂的唾液酸化糖蛋白[25],这使毕赤酵母菌株在生产生物药物方面拥有更大的潜力。

表2 有关酵母改造及产生的糖链类型
另外,也可以通过干扰LLO 的组装来影响高甘露糖链的形成,LLO 的组装在ER 中完成。如图1 所示,ALG3基因编码α-1,3-甘露糖基转移酶,负责在Dol-PP-GlcNAc2Man5的支链上添加1个α-1,3-Man,在酵母中该基因的敲除可以阻止PP-GlcNAc2Man6的合成,进而影响糖基转移酶对底物的识别。在Δoch1缺失菌株中敲除ALG3基因后,在双缺菌株中检测到Man5GlcNAc2糖链结构[42]。另外在多形汉逊酵母(Hansenula polymorpha)中,同样ALG11和ALG3敲除后检测到糖链结构主要为Man3GlcNAc2。这说明通过干扰LLO 组装的方法实现去糖基化具有可行性。
4 展望
1982 年,生物药物这一概念被正式提出[1],之后大量生物药物的出现改变了许多疾病的治疗方法。在众多原核和真核细胞表达系统中,由于对酵母的基因组有深入的了解,酵母中简便高效的基因编辑系统的构建[8]以及酵母可修饰蛋白质等优势的存在,促使工程化酵母研究进程加速前进。为了消除酵母对蛋白独特的N-高甘露糖修饰途径,引入人源化的N-糖基化修饰途径,已有学者展开了相关研究。目前,在毕赤酵母中已经可以表达唾液酸化的糖蛋白[48],这一成果使在酵母表达系统中产生人源化蛋白成为了现实。但是,在酵母中实现人源化类型的糖基化修饰仍然面临着许多问题:①酵母中糖蛋白也参与细胞壁的合成和酵母生长代谢进程,酵母中糖基转移酶的敲除破坏酵母细胞壁的完整性,影响酵母本身的正常生长发育,即难以平衡酵母生长状况和人源糖基化修饰之间的关系;②工程酵母中改变糖链结构,造成后续糖基转移酶、翻转酶或糖苷酶等对底物识别能力降低,造成目的糖蛋白产生效率低下;③酿酒酵母作为最常用的一种酵母,仍然不能产生含有半乳糖或者唾液酸残基的糖蛋白,限制了酵母表达系统的进一步发展。对酵母糖基化修饰进行人源化改造,使其产生更接近哺乳动物糖基化修饰结构,有望进一步提高酵母表达系统在生产治疗蛋白方面的价值,拓展酵母作为细胞工厂的应用范围。

