单羧酸转运蛋白(MCT)的功能调控及生理特性研究
张 维,严汉池
(天津大学生命科学学院,天津 300072)
单羧酸盐转运蛋白(MCT)属于溶质载体(SLC)转运蛋白家族,由溶质载体家族16 成员(SLC16A)编码。迄今为止,已在所有基因组测序的真核生物中鉴定出MCT。该蛋白家族由14 个成员组成,依次命名为MCT1~14,其命名方式与SLC16 的编号不一致,SLC16 是根据cDNA 序列的获得来命名,而MCT是按照功能的表征顺序来命名,本研究主要以MCT的命名方式为主。MCT 蛋白主要负责单羧酸类物质,如乳酸、丙酮酸和酮体等的跨膜转运,也可运输激素、氨基酸等,促进营养物质吸收,维持细胞内的代谢平衡,同时可以调节胞内pH 以及参与药物运送等。MCT 家族成员各亚型间具有组织分布特异性和底物差异性,它们也参与多种生理和病理过程,如肿瘤细胞的能量代谢、氧化磷酸化、糖异生、甲状腺激素代谢等[1]的发生过程。本研究主要对MCT 家族的结构功能、调控蛋白以及肿瘤代谢中的生理作用和作为肿瘤治疗潜在靶点的用途进行了总结,为以MCT 为靶点的抑制剂及药物的发现提供参考。
1 单羧酸转运蛋白家族的表达调控与结构功能
1.1 转录与表观遗传调控
人类MCT1 启动子在21 世纪初被鉴定和表征,并且在启动子区域内已经鉴定出一系列转录因子的潜在结合位点,包括USF1、USF2、AP1、AP2、SP1、MZF1 和活化B 细胞的核因子κ-轻链增强子(NFκB)[2,3]。人类MCT1 启动子包含USF1 和2 个结合位点,在功能上抑制人类结肠腺癌细胞Caco-2 中的MCT1 转 录,而远 端SP1 位点 刺激 启动 子活性[2]。NF-κB 抑制剂逆转丁酸对人类腺瘤衍生(AA/C1)细胞中MCT1 启动子活性的刺激作用,表明NF-κB 途径参与MCT1 转录调控[4]。对于MCT4 转录调控的研究很有限,且研究表明Nrf2 和c-Myc 转录调控MCT1,但不调控MCT4[5,6]。对MCT4 启动子进行定点突变后,缺氧诱导因子1α 亚单位(HIF1α)会结合启动子并诱导MCT4 mRNA 表达[7],表明启动子内的缺氧反应元件对HIF1α 介导的MCT4 转录激活至关重要[8]。NF-κB 途径会受到肿瘤坏死因子-α 的调控,使得人脐静脉内皮细胞中MCT9 mRNA 表达增加[9],但是没有进行启动子分析,以确定MCT9 启动子是否包含假定的转录因子结合位点。关于其他MCT 转录调控的信息非常有限。
MCT1基因的表达也可以通过表观遗传的方式调节,这取决于细胞、组织类型以及代谢需要。在骨骼肌中,由于慢性刺激或运动导致的Ca2+和一磷酸腺苷(AMP)水平的增加会增加MCT1 转录,并促进Ca2+依赖性蛋白磷酸酶-钙调神经磷酸酶(CaN)和AMP 活化蛋白激酶(AMPK)的活性[10,11],主要是因为CaN 负责活化T 细胞的核因子(NFAT)的去磷酸化和活化,而NFAT 是一种识别MCT1 启动子上几个NFAT 结合序列一致的转录因子[10]。因此,运动肌肉中MCT1 表达的控制可能依赖于NFAT 与基因启动子的结合。当AMP 水平升高时,AMPK 刺激转录共激活因子PGC1α,从而上调MCT1 的表达并促进高度氧化的肌纤维的形成,但不会提高MCT2 或MCT4 的表达[12]。在癌症中,MCT1 的表达被发现,通过基因启动子区域CpG 岛的高甲基化而在人类乳腺癌细胞中被抑制[13]。在癌症中,MCT1 蛋白的表达也被报道受缺氧的p53 依赖性调控[14]。p53 和MCT1基因启动子之间的直接相互作用可能降低MCT1 mRNA 的稳定性,对于其他MCT 成员表观遗传调控的报道很少。
1.2 MCT 蛋白的结构和转运底物功能
在结构上,MCT 家族成员共享保守的氨基酸同一性、预测的拓扑结构以及同源性[15]。所有的MCT亚型均有12 个跨膜(TM)结构域与细胞内C 末端和N 末端的存在,TM 螺旋6 和TM 螺旋7 之间有1 个大的细胞溶质环,TM1 和TM5 中有2 个高度保守的序列(图1)[15]。MCT 家族成员的1 个共同特征是TM区域比loops 和C 末端具有更好的序列保守性,且大多数成员在TM8 中共享1 个带正电的精氨酸(Arg)残基,这是转运活性所必需的,并且可能与底物的带负电的羧酸基团相互作用[16,17]。尽管MCT 表现出保守的序列基序,但它们的差异表达、调节和可变氨基酸残基允许每个亚型具有底物特异性和独特的生理影响。MCT1、MCT2、MCT3 和MCT4 负责一元羧酸在质膜上的双向质子连接转运,这些MCT 异构体显示出对短链单羧酸的偏好,包括在位置2 和3 上取代的单羧酸,例如丙酮酸、L-乳酸、D-β-羟基丁酸和乙酰乙酸,它们对不同底物有不同的亲和力(表1)。
与其他家族成员相比,MCT1 具有更广泛的分布和运输范围更广的底物。MCT1 转运的研究最初集中在乳酸,在包括脂肪生成、糖异生和氧化磷酸化的代谢途径中,乳酸可用作从细胞外空间摄取的底物。消耗乳酸的细胞可能表达MCT1、MCT2 或两者,具体取决于组织和物种[18,19]。而在许多具有氧化代谢途径的癌细胞中,主要表达MCT1,因为它促进了乳酸向细胞内的运输,从而为TCA 循环和氧化磷酸化提供燃料[20,21]。研究发现,MCT1 对乳酸具有中间亲和力(Km乳酸=3.50~10.00 mmol/L),并且在健康和癌症组织中广泛表达[22]。MCT2(Km乳酸=0.50~0.75 mmol/L)和MCT3(Km乳酸=5.00~6.00 mmol/L)对乳酸的亲和力最高,但其表达仅限于非常特殊的组织[23-25]。这些转运蛋白转运丙酮酸的差异更为明显,MCT1、MCT2 和MCT4 的 丙 酮 酸Km值 分 别 为1.00、0.10 和153.00 mmol/L[15]。MCT1 对β-羟基丁酸盐和乙酰乙酸的亲和力都比MCT2 低,说明MCT2是一种高亲和力的转运蛋白,对于MCT3 只知道其是乳酸转运蛋白,对于其他底物没有更详尽的报道,而MCT4 对底物的转运亲和力都很低,但其转运容量大,广泛表达在糖酵解型白肌纤维,人小肠、肾脏和胎盘中[26]。
MCT5 和MCT6 被发现在人类肠道中表达,其中MCT6 已被证明可转运布美他尼、那格列奈和丙磺舒等药物的质子连接转运,且许多糖苷类黄酮可以作为MCT6 的抑制剂[27]。MCT7 参与了肝脏细胞在禁食时以循环脂肪酸为燃料输出酮体,特别是β-羟基丁酸盐[28]。因此,在斑马鱼中MCT7 表达的缺失导致肝脂肪变性,而人MCT7 的引入可以阻止肝脂肪变性。另外,MCT8(大鼠亚型)和MCT10(小鼠亚型)分别以不依赖质子和钠的方式介导甲状腺激素[29]和芳香族氨基酸[30]的转运。MCT9 和MCT12 还可运输单羧酸盐,包括更疏水的分子,如肉碱和肌酸[31]。分析人类mRNA 表达数据时发现,MCT11 在甲状腺、唾液腺和肝脏中表达较高[32]。MCT14 在小鼠神经系统中和肾脏中被发现有表达[33],其他MCT家族成员的底物和功能目前尚不清楚。
2 MCT 蛋白活性的调控蛋白
2.1 跨膜糖蛋白
MCT 蛋白的正确表达、定位和活性取决于与辅助蛋白的相互作用,主要是跨膜糖蛋白Basigin/CD147[34]和Embigin/gp70[35]。这些蛋白质都包含细胞外结构域(EC)、跨膜结构域(TM)和胞内结构域(IC),且EC 域含有的免疫球蛋白域结构的数量不同,同时EC 域还有多个糖基化位点,Basigin 根据剪接变体也会有2 个或3 个免疫球蛋白域[36]。这种糖基化程度取决于不同的组织,相应的功能也有所差异。TM 域高度保守且有带电荷的谷氨酸残基和典型的亮氨酸拉链结构,有助于辅助蛋白质锚定在质膜上并与细胞内蛋白质相互作用。
一些研究人员已经利用多种不同技术,如免疫共沉淀、免疫荧光、交联和荧光共振能量转移证明了辅助蛋白对MCT 定位于质膜上并发挥活性起到了关键作用[37-40]。如果没有它们,MCT 就无法到达最终位置并在高尔基体中积累[35]。与Embigin 相比,Basigin 在组织中更广泛地表达,并且更频繁地作为MCT1、MCT3 和MCT4 的优先伴侣出现,在Basigin 敲除小鼠中,MCT1、MCT3 和MCT4 在视网膜色素上皮中不表达从而导致失明[41],进一步支持Basigin 作为MCT1、MCT3 和MCT4 膜表达伴侣的作用。MCT2 优先与Embigin 相互作用[37]。在没有Basigin 的时候,MCT1 也会与Embigin 相互作用[42],Embigin 还没有被证明是MCT3 和MCT4 的伴侣[43]。
此外,Basigin 调节MCT11 和MCT12 的膜转运。在MCT11 转染的HEK293 细胞中,质膜表达受Basi⁃gin 表达的调节,Basigin 的敲除导致质膜MCT11 显著减少,且MCT11 和Basigin 的直接相互作用通过共免疫沉淀得到证实[44]。在MCT12 转染的HEK293细胞中,Basigin 与MCT12 共定位,并利用共免疫沉淀法证明其有相互作用,且当Basigin 敲低后会降低MCT12 的细胞表面表达[45],表明MCT12 需要Basigin进行细胞表面表达。
除了MCT1-4 外,MCT8 的正确质膜定位和活性不需要这种相互作用,它似乎形成了同型二聚体[46],而MCT 家族其他成员(MCT5-7,MCT9、10、13和14)还没有被证明需要Basigin 或Embigin 来促进向质膜的转运,目前还没有发现调控其膜转运的辅助蛋白。
2.2 碳酸酐酶
还有一些其他蛋白质也被认为与MCT 结合,如细胞内的碳酸酐酶Ⅱ(CAII,胞质CA 亚型)被证明能通过其64 位的组氨酸(His)残基与MCT1 和MCT4C末端的谷氨酸(Glu)残基簇结合,从而增强转运蛋白的活性,但不会增强MCT2 的活性[47];CAIV(胞外CA亚型)[48]和CAIX[49](胞外CA 亚型)可以通过胞外侧的Basigin 和Embigin 的IgI 域与MCT/Basigin 或MCT/Embigin 复合物建立相互作用,增强转运蛋白的活性。最近的研究探讨了碳酸酐酶增强MCT 转运活性 的机制[50](图2)。碳 酸酐酶II 直 接与MCT1 和MCT4 的C 末端结合,转运体活性增加;然而,它不与MCT2 结合,这与其无法增强MCT2 活性一致。碳酸酐酶IX 通过其带负电荷的碳酸酐酶IX 蛋白多糖样结构域来转移质子,从而增强MCT4 转运活性。

图2 碳酸酐酶在MCT1/4 调控中的质子天线效应
2.3 透明质酸受体和乳酸脱氢酶
透明质酸CD44 受体可与肺癌和前列腺癌细胞中的MCT1 和MCT4 相互作用[51],从而稳定膜蛋白复合物,而且透明质酸和CD44 之间的结构性相互作用也有助于调节MCT 的定位和功能[52];有报道称MCT1 在L6 大鼠骨骼肌细胞的线粒体中与LDH 共定位,并在没有去垢剂的情况下在蛋白质提取物的线粒体部分MCT1 和LDH 共免疫沉淀,表明至少在这些细胞的线粒体水平上,2 种蛋白质之间存在相互作用[53]。同时有研究提出了细胞内乳酸穿梭/乳酸线粒体氧化复合物模型(图3),指出乳酸脱氢酶使丙酮酸中的乳酸减少,并通过MCT1 进一步导入线粒体间质进行氧化[54]。由于LDHB 和LDHA 对乳酸和丙酮酸具有不同的亲和力,而MCT 亚型的Km和Vmax值因底物而异,因此,LDHs 与MCT 的潜在相互作用可能是一种微调跨膜单羧酸转运方向的机制,然而这种机制还存在争议。
糖酵解型癌细胞通过葡萄糖转运蛋白(GLUT)摄取葡萄糖,然后使用糖酵解依次将葡萄糖转化为丙酮酸和ATP,接着丙酮酸用乳酸脱氢酶A(LDHA)将丙酮酸转化为乳酸。乳酸与质子一起通过MCT4转运到细胞外。氧化型癌细胞通过MCT1 摄取乳酸和质子,接着乳酸被乳酸脱氢酶B(LDHB)氧化为丙酮酸,产生副产物NADH,然后丙酮酸和NADH 都进入TCA循环通过氧化磷酸化促进ATP的产生(图3)。
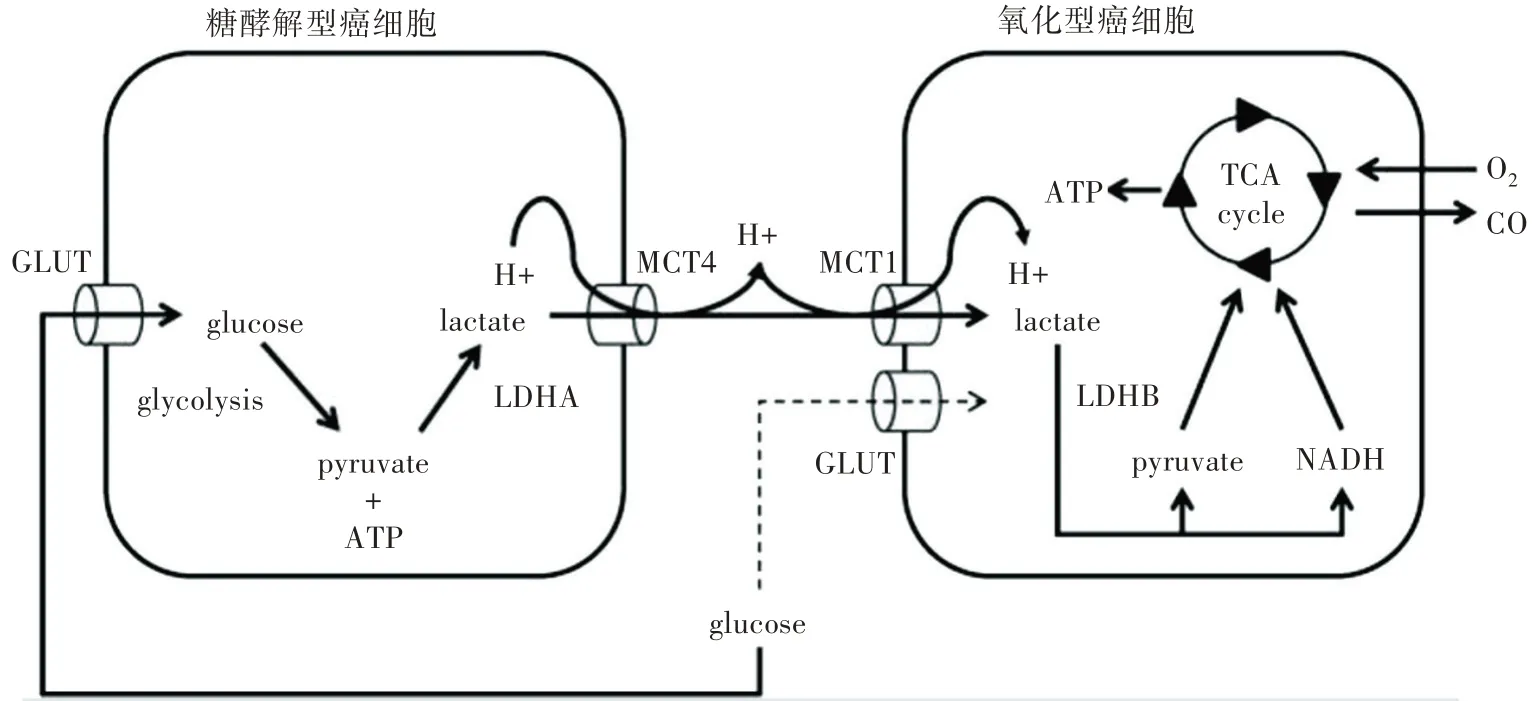
图3 基于氧化型癌细胞与糖酵解型癌细胞之间乳酸交换的代谢共生模型
3 MCT 蛋白在肿瘤中的生理特性
3.1 MCT 蛋白在肿瘤与癌症中的功能
MCT 在肿瘤微环境的代谢稳态中起重要作用,它们确保糖酵解和耐酸表型的维持,从而促进癌细胞的恶性行为。MCT 通过促进乳酸的输出使糖酵解能够快速进行,并且它们还通过质子的共转运参与pH 调节。在脑肿瘤中,细胞间乳酸穿梭为神经元提供燃料,从而破坏正常的细胞代谢相互作用,以维持肿瘤的生存和生长[55]。MCT1 和MCT4 是癌细胞中表达最广泛的MCT 亚型。MCT1 对乳酸的亲和力高,且优先在吸收乳酸的氧化癌细胞中表达[55]。相反,MCT4 对乳酸的亲和力低,但周转率高,特别适合促进糖酵解癌细胞输出乳酸,其表达因缺氧而上调,此过程受HIF-1α 调节[25]。据报道,MCT1 在多种人类癌症中表达,包括宫颈鳞癌细胞、结肠癌[20]、胃癌、肺癌、乳腺癌、膀胱癌和前列腺癌[56-60]。其中,MCT1 也被认为是膀胱癌、乳腺癌和卵巢癌中负责乳酸跨膜转运的最重要亚型[51,60]。MCT4 也广泛分布于不同的癌症类型中,如乳腺癌、结肠癌、膀胱癌和前列腺癌,以及在妇科肿瘤和胶质瘤等肿瘤细胞中也有表达[51,58-60]。相对于MCT1 和MCT4,MCT2和MCT3 在癌症中的研究较少。在非小细胞肺癌、乳腺癌、结肠癌等癌细胞的细胞质中发现了MCT2[51,61],据报道,MCT3 也在非小细胞肺癌的癌细胞和间质细胞内表达[61]。
除此之外,MCT 也促进肿瘤细胞的迁移和侵袭过程。Izumi 等[62]研究表明,MCT1 和MCT4 的表达与人类肺癌细胞的侵袭相关。有研究结果进一步证明MCT 抑制剂CHC 可以减少胶质瘤细胞的迁移和侵袭[59];在子宫颈鳞状癌细胞中,MCT1 可以独立其转运蛋白的活性,通过激活NF-κB 转录因子来促进肿瘤细胞的侵袭和转移[63];高表达的MCT1 可以通过摄取血液循环系统中的乳酸来抵御氧化压力,使黑色素瘤细胞获得更强的转移能力[64];在前列腺癌和三阴性乳腺癌细胞中,MCT1 通过下调c-Met受体来调节肝细胞生长因子(HGF)介导的上皮间质转化(EMT),使细胞间黏附力丧失和细胞运动性增强,从而导致肿瘤细胞的侵袭和转移[65];MCT4 的抑制和敲除可减少部分胰腺导管腺癌细胞的迁移[66]。在这种情况下,MCT1 和/或MCT4 被认为是癌症的潜在治疗靶点。对于其他MCT 同工型,还不清楚它们与肿瘤发生和发展的相关性。
3.2 MCT 蛋白作为肿瘤的潜在治疗靶点
如前所述,单羧酸转运蛋白与多种癌症发生以及肿瘤细胞的迁移过程紧密相关,故其可以作为癌症治疗靶点蛋白,抑制单羧酸转运蛋白活性,则可以达到治疗癌症的目的。已经鉴定出几种MCT 抑制剂,最早发现的抑制剂是根皮素、类黄酮(如槲皮素)、二苯乙烯二磺酸酯[包括DIDS 和4,4′-二苯甲酰胺二苯乙烯-2,2′-二磺酸酯(DBDS)]和α-氰基-4-羟基肉桂酸盐(CHC)及其类似物[15]。但没有一种对给定的MCT 亚型具有特异性,并且大多数对其他蛋白质也具有很高的亲和力。特别是CHC 缺乏效力和特异性,其具有抑制线粒体丙酮酸载体(MPC)的能力,因此,线粒体对丙酮酸的摄取比MCT1 更有效[67],也有其他对MCT 具有高亲和力的抑制剂,具体抑制选择性见表2。

表2 MCT1、MCT2 和MCT4 抑制剂选择性
AR-C155858 是一种双重MCT1/2 抑制剂,可通过阻断乳酸的排出抑制T 淋巴细胞活化,因此具有免疫抑制作用。AR-C155858 在细胞内可以与MCT1 的TM7-10 结合从而抑制MCT1 的活性[68]。有报道指出,在表达内源性MCT1 的大鼠红细胞中表现出对MCT1 的有效抑制,Ki值为2.3 nmol/L。ARC155858在转染MCT2的非洲爪蟾卵母细胞的研究中也被报道抑制MCT2,但程度较小(Ki>10 nmol/L)[37]。AR-C155858 对MCT2 的抑制作用具有选择性,当MCT2 与辅助蛋白质Basigin 蛋白结合时有抑制作用,但当它与优选的伴侣蛋白Embigin 结合时没有抑制作用[37]。AZD3965 是AR-C155858 的衍生物,也是一种双重MCT1 和MCT2 抑制剂,可有效抑制肿瘤细胞内乳酸的排出和肿瘤细胞的生长,并且可增加放射敏感性,其对MCT1 的效价比MCT2 高6 倍,并且在10 μmol/L 下对MCT3/MCT4 没有抑制作用[69]。AZD3965 已被证明能显著降低MCT1 过度表达的人小细胞肺癌和各种淋巴瘤异种移植模型的细胞和肿瘤生长[62,70,71]。目前正在英国进行针对晚期实体瘤和淋巴瘤的I 期临床试验(NCT01791595)[72],以后可能用于前列腺癌、胃癌和弥漫性大B 细胞淋巴瘤的治疗。
新型抑制剂BAY-8002 可以有效抑制乳酸的双向转运,显著增加肿瘤内乳酸水平和瞬时调节丙酮酸水平,从而使肿瘤细胞处于停滞状态。BAY-8002对MCT1 的选择性是MCT2 的5 倍,对MCT4 没有抑制作用。使用放射性标记法研究AZD3965 和BAY-8002 对MCT1 的竞争性抑制,结果表明,这2 种配体具有相似的结合位点,说明其具有相似的作用方式[73]。7-氨基羧基香豆素(7ACC)被开发用于选择性干扰富含乳酸的肿瘤微环境中的乳酸通量,7ACC2 抑制表达MCT1 和MCT4 的癌细胞中的乳酸内流,但不抑制外流,表明其作用模式不同于ARC155858[74]。表明7ACC 选择性地影响MCT 转运体转位周期的一个部分,导致严格抑制乳酸内流。这种独特的活性与抗肿瘤作用有关,不易产生耐药性和副作用。
Wang 等[75]解析了野生型(WT)人MCT1/Basi⁃gin-2 复合物,以及3 种原型MCT 抑制剂AZD3965、BAY-8002 和7ACC2 的冷冻电镜结构,揭示抑制剂的准确结合位点和抑制机制,其中MCT1-Basigin-2+乳酸的结构呈现向外开放的构象,而与抑制剂结合的3 种构象中,与BAY-8002 和AZD3965 结合的MCT1-Basigin-2 的复合物结构均具有向外开放的构象,而7ACC2 结合MCT1-Basigin-2 的结构则为向内开放状态(图4)。尽管如此,所有3 种抑制剂都直接占据底物结合位点,通过与底物结合的直接竞争和对转运体构象变化的抑制来实现对MCT1 的抑制。这些结果阐明了3 种抗癌候选药物的作用模式,为以MCT 为靶点的结构导向药物发现奠定了重要的框架。

图4 单羧酸转运体的抑制机制
4 小结与展望
近年来,MCT 家族蛋白在生理和病理条件下所起的作用越来越重要。由于其广泛的组织分布和底物,MCT 蛋白有可能影响许多内源性化合物和药物的药代动力学。尽管近年来对MCT 的研究有所增加,但需要进一步研究阐明14 种MCT 蛋白的功能,以了解这些转运蛋白在药物处置和内源性化合物稳态中的作用,以及它们作为疾病潜在靶点的作用。值得注意的是,MCT1 和MCT4 是癌细胞中表达最广泛的亚型,抑制它们的转运活性是目前癌症化疗策略的研究领域,例如将MCT1 和MCT4 抑制剂联合使用,保证肿瘤治疗的有效性,而且对于其他MCT 亚型的研究将大大增加目前对单羧酸转运蛋白家族的认识,相信随着对MCT 蛋白及其复合物在结构和作用机理等方面研究的不断深入,人们可以详细了解MCT 蛋白影响肿瘤细胞的途径及其作用机制,从而能够为肿瘤的治疗提供更多、更精确的思路和策略。

