浮萍(青萍)的室内人工培养方法
岳冬雪,杜孟盈,皮亚宁,徐赓鑫,邱念伟,王仁君
(曲阜师范大学 生命科学学院,山东曲阜273165)
0 引言
浮萍是一类最简单的单子叶水生漂浮植物,属于天南星科(Araceae)浮萍亚科(Lemnoideae),全世界共5 属,约36 种。各类浮萍植株均较小(约0.5~15 mm),结构简单,根茎叶退化,仅由叶状体和根系组成(或仅有叶状体),叶状体组织细胞内充满空气,使浮萍完全适应水面漂浮生活,广泛分布于各类淡水水体中[1-2]。浮萍富含淀粉、蛋白质、维生素和矿质元素,是重要的潜在食品源、饲料、生物能源[1],其中紫萍(Spirodela polyrhzia)和青萍(Lemna minor)还可入药,具有宣散风热、透疹止痒、利水消肿等药理作用[3]。此外,浮萍还具有快速吸附转移氮磷元素、有机污染物、重金属等有害物质的能力,是毒理检测和生态修复中常用的水生植物类群,具有很重要的生态价值[4]。
我国浮萍共有芜萍属(Wolffia)、紫萍属(Spirodela)、青萍属(Lemna)三个属,其中芜萍繁殖较快,但个体及其微小,不易实验操作;紫萍生长较慢,生长环境要求高;青萍最为常见,分布于我国南北各省,生于水田、池沼及其他静水水域,常与紫萍混生[5]。由于青萍繁殖较快,通常在浮萍群落中占绝对优势,最适于室内培养,因此科学研究中常把青萍作为研究水生植物的模式生物[6]。本文系统介绍了青萍的室内培养方法和经验,为青萍相关研究提供参考。
1 青萍的生物学特征
青萍植株结构简单,由叶状体和根组成。快速生长时期的青萍,通常每株附着3~4 个叶状体;叶状体对称,呈近圆形、倒卵形或椭圆形,全缘,长1.5~5 mm,宽2~3 mm;上表面呈绿色,稍凸起或沿中线隆起,叶脉不明显;背面浅黄色或浅绿色或紫色,每个叶状体垂生1 条丝状根,根白色,最长3~4 cm。青萍主要通过出芽生殖进行无性繁殖,叶状体背面两侧各具有一个向外开口的夹层囊(或仅一端具有开口)。成熟的叶状体会在两侧的囊中分生出新的叶状体,新叶状体以极短的细柄与母体相连,成熟后脱落形成一个新的植物体。在冬季死亡之前,其夹囊内产生椭圆形的冬芽,冬芽脱离母体后沉入水底越冬,第二年春天冬芽浮出水面,长出新株[5,7]。鸟类传播是浮萍(含青萍)传播到新地点的重要方式,浮萍能够附着在水鸟的羽毛或爪上,靠鸟类传播到不同的淡水水域中[4]。
2 青萍的室内人工培养条件
2.1 培养温度
青萍对温度的适应性较强,其生长繁殖温度范围为10~40℃;气温低于10℃青萍就会停止生长[8];当温度低于5~7℃,青萍逐渐白化死亡[9]。陈侠桦等人[8]在不同温度下人工培养青萍,发现在30℃条件下青萍生长速率最快,相对生长率和叶状体直径达到最大值。青萍属的稀脉浮萍(Lemna aequinoctialis)则在25 ℃条件下表现出最大的相对生长速率[10]。因此建议青萍的人工室内培养温度控制在25~30℃。
2.2 光照强度
青萍可在6 μmol/m2/s 弱光下存活,其生长速度随着光照强度的增加而加快,直到达到光合饱和点;超过饱和点,生长速率不再增大,甚至会对青萍产生光抑制损伤,降低其生长速率[11]。青萍室内生长的最适光照强度为5 000~10 000 Lux(约100~200 μmol/m2/s)。5 000 Lux 下青萍的生长速率约为2 000 Lux 光强下的2.5 倍,但5 000 Lux 和10 000 Lux 光强下青萍的生长速率差别不大[12];光强继续增加会降低青萍的叶绿素含量和光合效率[11,13]。我们实验过程中还发现,强光照射到培养溶液中,还会导致培养溶液内产生大量绿藻,附着于青萍根部,影响其生长。用黑色容器培养青萍可减少外部光源入射培养溶液,并能吸收透射入溶液中的光线,降低培养液中的光照强度,减少绿藻生长,有利于青萍生长。因此建议使用深色不透光容器培养青萍,或在透明容器外缠绕黑色胶带,尽量减少培养溶液中的光照强度[14-16]。室内培养光照达到5 000 Lux 青萍即可快速生长,且可以避免强光引起培养溶液的温度升高和绿藻繁殖,一般荧光灯或LED 光源均能达到此光照要求。
光周期也影响青萍生长,青萍在短日照条件下生长速率低于长日照[17]。通过不同光周期生长实验发现,青萍生长最适光周期为16 h:8 h,该光周期条件下有利于青萍叶状体中淀粉的积累,叶绿素含量最高;若继续延长光期反而会抑制叶绿素的合成,降低气孔导度,影响光合作用[18]。
2.3 培养溶液
2.3.1 营养液的筛选。浮萍喜氮、磷丰富的富养化水体,培养浮萍最常用的培养溶液有Hoagland 营养液和Hunter 营养液。钱晓晴等[14]以稀脉浮萍、紫萍、少根紫萍为研究对象,证明3 种浮萍在Hoagland 营养液中的长势均优于Hunter 营养液。Hoagland 营养液中的氮磷比约为Hunter 营养液中氮磷比的6.5 倍[16],说明浮萍更喜欢高氮磷比的富养化水体。程晓瑞[19]则证明在氮磷摩尔浓度比为5:1 的营养液中,浮萍长势最好。我们用完全Hoagland 营养液培养的青萍长势稍好于1/2浓度的Hoagland 营养液,因此建议用Hoagland 完全营养液培养青萍。
2.3.2 营养液的pH。青萍对水体pH 值适应范围较广,可以在pH 为5~9 的范围内正常生长,pH 低于5.0对青萍的生长有明显的抑制作用[20]。谢靖等[10]发现青萍在pH 为5.5 时相对生长速率最大;Mclay 等人[21]实验结果显示青萍最佳生长范围为4~6,这一结果不太可靠。因为我们测试结果显示青萍生长最适pH 为5.5~6.0,低于5.0 青萍生长速率显著下降。因此建议把营养液pH 值调整至5.5~6.0。
2.3.3 培养方法。孙源等[22]用盛有Hoagland 营养液六孔板、培养皿、烧杯等深度不同的三种容器培养青萍,发现溶液越深,青萍的长势越好,烧杯培养的青萍长势最快。我们用水体深度为25 cm 的黑色水桶(容积20 L)扩繁青萍(浮萍初始水面覆盖度约10%),无需更换培养液,青萍可在一周左右长满水面;水深太浅,水体会大量蒸发,若未能及时更换营养液,会显著影响青萍生长。实验处理时,为了节约营养液,节省实验空间,增大实验重复数,我们用水体深度为6 cm,表面积为65 cm2的圆柱形黑色塑料容器培养青萍,每3 天更换1 次营养液,保证营养液成分稳定。因此建议扩繁青萍时使用水体深度为20 cm 以上的深色不透光容器,实验处理时建议用水体深度为5 cm 以上(超过青萍根的长度,不影响青萍飘移和根系生长),表面积为1 dm2左右的黑色容器进行培养。另外,青萍喜静水,耐缺氧能力较强,无需进行通气培养或者搅拌,通气或搅拌反而会抑制青萍生长[23]。
3 室内培养青萍的生长规律
前人在初始实验时,每个培养容器中选用10 株青萍作为起始株数进行培养(该文献把每个明显伸出母体的叶状体记为1 株,全部选用两叶相连的青萍),培养一定时间后,统计每个培养容器的总株数,用总株数表示青萍的生长速率,发现起始株数为10 时误差最小[24]。理论上讲,起始株数越多,实验误差越小,上述实验未设置对照,实验结果不可靠。我们统计了室内培养条件下单叶青萍、两叶青萍和三叶青萍的比例,发现三叶青萍比例最高。我们取6 个相同的黑色培养盆,以10 个大小一致的三叶青萍(30 个叶状体)为起始生物量进行室内培养,保证培养盆的光照等环境条件完全一致,连续培养10 天,统计每天每个培养盆内青萍的叶状体总数,可以得到数据稳定可靠的青萍生长曲线数据,结果显示青萍的生长规律是极显著的指数生长曲线(图1);其他浮萍也具有类似生长规律[18]。超过一定的天数,由于生长和营养的限制,青萍的生长会逐渐受到抑制,生长曲线变成“S”形[22],青萍处理时间建议不要超过10 天。生长曲线也可以用每个培养容器内青萍总鲜重绘制,不过称量总鲜重时会对浮萍造成损伤,数据也不如叶状体数稳定。可以先求出总鲜重与总叶状体数的比例关系:每100 株三叶青萍的鲜重(300 个叶状体)大约0.60 g,然后将叶状体数生长曲线换算成鲜重生长曲线,二者的规律基本一致[16]。对青萍进行逆境处理后,会抑制青萍生长,单叶青萍和两叶青萍的比例大大增加,这时用株数绘制生长曲线是不合理的,这种情况用鲜重生长曲线最为合适。实验者应根据浮萍生长情况选择合适的生长曲线。
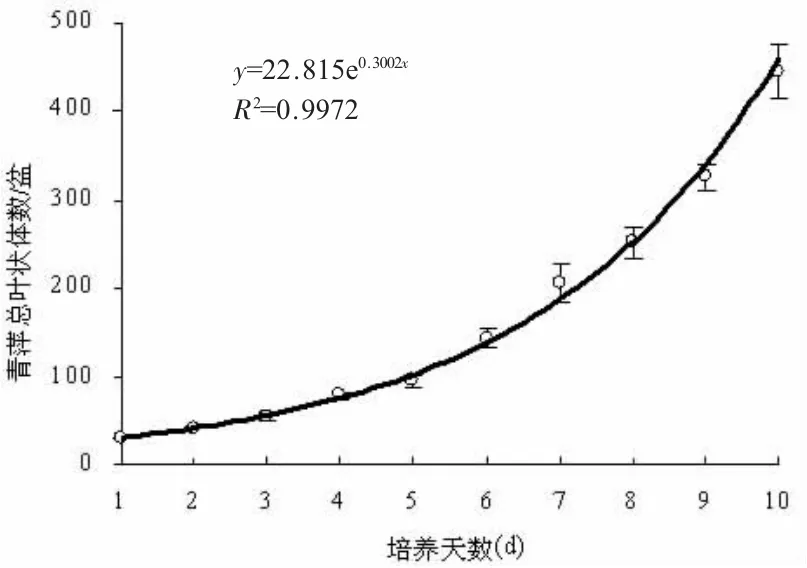
图1 青萍室内培养的生长曲线
科学实验中往往只需统计处理后每个培养容器内青萍的最终总生物量(叶状体总数或总鲜重),统计叶状体总数比较费力,总鲜重更为可行。具体方法是:用小网捞出所有青萍,控去水滴,然后平铺在两层吸水纸上,上面盖一层吸水纸,自然吸水5 分钟后(不要挤压),用精密天平称量青萍总重量[25]。在适宜的室内培养条件下,青萍约2~3 天繁殖一代[6],繁殖6 代之后母体逐渐衰老死亡[2]。所以建议青萍的处理周期控制在10天左右,不要超过15 天,避免有大量衰亡的母体出现。大量扩繁或生产时,也要定期采收青萍,避免生长密度过高加快青萍的老化死亡,污染青萍产品。要注意的是,如果青萍采收过多,会导致青萍水体覆盖度过低,水中藻类过量滋生,青萍的生长环境也会恶化,影响青萍的总产量与质量[23]。了解青萍的生长规律对于科学研究及生产都至关重要。
青萍生长状况还可用自然分开的株数、总干重、根长、叶状体直径表示。青萍新生叶状体与母体相连的细柄极易断裂,很难数清自然分开的青萍株数,该指标的稳定性较差。青萍的发育阶段不同,其叶状体大小及根的长短变化较大,因此也不宜用全部植株的平均大小或平均根长表示。测量每个培养容器内青萍的总鲜重是最简单可靠的生长指标。若需准确测量叶状体直径,可在显微镜下用显微标尺测量成熟叶状体的直径表示叶状体大小。叶状体面积则可用精度较高的叶面积仪扫描一定数量的成熟叶状体总面积,然后计算每个成熟叶状体的平均面积。如果环境对根系生长影响较为明显,可以只测量成熟叶状体的平均根长来量化青萍的生长状况。
4 室内培养青萍的注意事项
野外采集的青萍需要用自来水轻轻冲洗几遍,选择生长状态良好、叶片肥硕、干净完整的青萍用上述方法进行扩繁。用扩繁后的已经适应了室内环境的青萍进行科研实验。
实验处理或者更换营养液时,捞取叶状体需注意保护细根和叶状体,建议用弯头镊子从青萍叶状体下方挑起单个青萍,逐一进行移取,以免对青萍造成伤害。
在野外采集或室内培养时,若获得优异单株,可用此单株进行扩繁,然后进行科学实验,保证遗传背景一致,并为青萍的生产提供优良种质。
为了保证科学研究数据的可靠性,除处理因素外,要确保每个培养容器的其他环境条件尽可能一致。为防止因位置造成光照不均,样本设计可采用拉丁方设计,并每天进行前后、左右平移,减小因行效应或列效应导致的实验误差。
每隔3 天左右更换一次营养液,保证培养溶液营养成分稳定。可将青萍捞入更换了营养液的新容器内,原来的容器清洗后备用,以洗去滋生的绿藻。
称量总鲜重时,用滤水小网将青萍从溶液中捞起,轻轻掂掉水滴,然后再用卫生纸吸水5 分钟。吸水后尽快用精密天平(≤0.001 g)称量总鲜重,避免水分蒸发会使鲜重不断下降。统计叶状体数时最好由同一人进行统计,保证统计标准一致。

