榆林三边地区荞麦麸粉中铝残留量的分析研究
◎ 邵华华,米林锋,赵慧明,侯磊磊,贺亚如,柴梅梅,毛 敏
(榆林市食品检验检测中心,陕西 榆林 719000)
荞麦又名乌麦、三角麦、花麦等,有4个栽培种,分别为甜荞、苦荞、翅荞和米荞。其中,甜荞和苦荞(鞑靼荞麦)为主要栽培种[1]。荞麦药用价值高,含有丰富的蛋白质、维生素、矿物质等各种营养素[2-3]。以荞麦为主要原料的食品达数十种,次生的荞面加工副产品若能合理利用,可进一步提高荞麦的经济价值[4]。本文研究的荞麦加工副产品是指在荞麦籽粒经脱壳后,通过石磨、机制加工制米或制粉过程中产生的皮、渣、糁和面筛余物,俗称箩头子,也称麸粉副产品。
铝元素是人体必需的微量元素之一,人体铝暴露的主要途径来自膳食摄入[5]。人体摄入铝后仅有10%左右会排出体外,剩余铝则残留体内,若积累过多便会危害患者的消化系统、免疫系统及神经系统等[6-7]。荞麦中铝的来源主要有土壤、酸铝浸泡种子、生长过程中种皮和叶子的铝富集。《食品安全国家标准 食品中污染物限量》(GB 2762—2017)取消了面制食品中铝的残留限量,在铝的监测中只考虑人为添加,不考虑天然富集。在荞麦制品及其副产品加工中,有必要考虑铝本底残留[8-9]。本文采集了36种样品并采用《食品安全国家标准 食品中铝的测定》(GB 5009.182—2017)中电感耦合等离子体质谱法(Inductively Coupled Plasma Mass Spectrometry, ICP-MS)开展了铝残留量检测,为荞麦制品食品安全风险监测提供了有力保障。
1 材料与方法
1.1 试剂
65%硝酸(优级纯,德国默克);铝标准储备液 (1 000 μg·mL-1,GSB04-1713-2004,国家有色金属及电子材料分析测试中心);GB/T 6682—2008[10]规定的二级水(超纯水仪制备)。
1.2 仪器与设备
电感耦合等离子体质谱仪(美国安捷伦7900);微波消解仪(配聚四氟乙烯消解内罐,莱伯泰科);智能样品处理器(兰博VB24Plus);恒温干燥箱;万分之一电子精密天平(瑞士梅特勒Me204);超纯水仪(德国密理博)。
1.3 实验方法
1.3.1 样品处理
将样品粉碎均匀后,取约30 g置恒温干燥箱中 85 ℃干燥4 h。于微波消解罐中称取干样品0.2~0.5 g, 分别加入5 mL硝酸,严格按照微波消解程序和微波消解仪的操作规程(表1)进行处理,消解至样品溶液透明。冷却后取出消解罐,在智能样品处理器上于140 ℃赶酸至1 mL左右。消解罐冷却后,将消化液转移至50 mL容量瓶中,用少量水洗涤消解罐 2~3次,合并洗涤液于容量瓶中并用水定容至刻度,混匀备用。同时做试剂空白实验。
1.3.2 ICP-MS工作参数
选用浓度为1 μg·L-1的调谐液(含元素Li、Y、Co、Tl、Ge和Mg)对不同的反应气体进行方法调谐。仪器调谐模式为He,方法中氧化物/双电荷比:氧化物156/140,0.382%;双电荷70/140,1.000%。选择45Sc 为内标元素,内标标准溶液浓度为50 μg·L-1,由2%的硝酸为介质稀释制得。ICP-MS工作参数见表2。

表1 微波消解程序表

表2 ICP-MS工作参数表
1.3.3 标准曲线的绘制
准确吸取铝标准储备液(1 000 mg·L-1)5.0 mL于50 mL容量瓶中,加硝酸溶液(2+98)至刻度,混匀,得到100 mg·L-1铝标准中间液。分别吸取铝标准中间液(100 mg·L-1)0 mL、0.5 mL、1.0 mL、2.0 mL、 4.0 mL和8.0 mL于100 mL容量瓶中,加硝酸溶液(2+98)至刻度,混匀,得到铝标准系列溶液的质量浓度分别为0 mg·L-1、0.5 mg·L-1、1.0 mg·L-1、2.0 mg·L-1、 4.0 mg·L-1和8.0 mg·L-1。采用电感耦合等离子体质谱仪测定,以铝浓度为横坐标,以分析谱线强度响应值为纵坐标,绘制标准曲线。
1.3.4 样品测定
用电感耦合等离子体质谱仪对空白溶液和试样溶液进样分析,根据标准曲线得到消解液中铝的浓度。
1.3.5 数学模型
根据GB 5009.182-2017第二法建立荞麦麸粉中铝含量计算公式为:

式中:X为试样中待测元素含量铝,mg·kg-1;ρ和ρ0分别为试样和试样空白液中铝的质量浓度,mg·L-1;V为试样定容体积,mL;f为试样稀释倍数;m为试样称取质量,g。
2 结果与分析
2.1 方法学验证
2.1.1 线性关系、检出限与定量限
铝含量在0~8.0 mg·L-1线性关系良好,r=0.999 8,标准曲线方程y=1.255 3x+0.022 7,检出限为0.001 705 mg·L-1, 定量限为0.005 mg·L-1。
2.1.2 加标回收实验
在3个麸粉副产品样品中分别加入0.2 mg·L-1、 0.5 mg·L-1、1.0 mg·L-1铝标准溶液,进行加标回收实验,每个样品测定3次,测定结果见表3。相同本底值下不同低、中、高加标铝的平均回收率为96.5%~102.8%,内标回收率为95.5%~101.0%,均符合检测要求,表明采用该方法测定样品中铝含量,结果准确、可靠。

表3 加标回收实验结果表
2.1.3 方法精密度
应用该方法对3个荞麦加工副产品样品各取0.4 g,消解后定容至50 mL容量瓶,重复测定6次,测定结果见表4。测定结果的相对标准偏差为0.47%~0.84%,表明测量精密度较高。
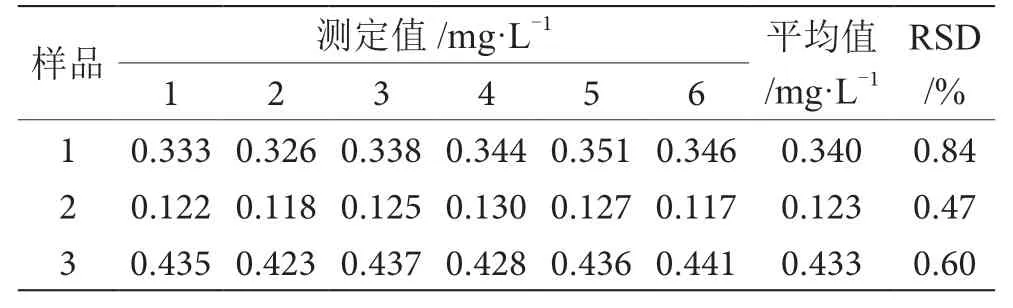
表4 精密度检测结果表
2.2 麸粉副产品中铝含量分析
2.2.1 麸粉副产品成分创新定义
麸粉副产品成分内容定义为课题组首创,具体标识如下。
(1)荞麦麸皮。存在于荞麦外壳的内侧,包裹荞麦胚乳的薄皮部分,以果皮为主的筛余物(制米选筛下物,制粉选筛上物)。
(2)荞麦麸渣。以荞麦胚芽和颗粒物为主的筛余物(制米选筛下物,制粉选筛上物)。
(3)荞麦麸糁。以荞麦糁粒为主的筛余物(制米选筛下物,制粉选筛上物)。
(4)荞麦麸面。以荞麦芯粉为主的筛余物(制米选筛下物,制粉选筛上物)。
(5)麸粒级配。荞麦麸粉副产品按形态分为皮(P)、渣(Z)、糁(S)和面(M)4种麸粒形态,再按麸粒筛余物粗细度分为7种麸粒粒径,麸粒级配是由不同麸粒形态和麸粒粒径按比例进行复配的过程。
(6)麸粉互混。选用荞麦麸粉为基质原料,添加或不添加甜、苦荞麦粉为调配辅料,应用麸粒级配技术,标准化调整品种与比例,创新荞麦麸粉从皮面到芯粉的成分重构,响应荞麦麸质的混合组合和特征变化过程。
(7)荞麦麸粉。将荞麦加工副产品(除壳、粉、米外)进行麸粒级配、麸粉互混,二次加工制取麸粉,制成质量指标和功能特色相对固定的荞麦麸粉产品。
2.2.2 麸粉副产品铝含量测定结果
本文采集了36份麸粉副产品进行铝含量测定,以我国1994年提出的面制食品中铝的限量卫生标准(≤100 mg·kg-1)的80%(即≤80 mg·kg-1)作为荞麦加工副产品安全食用的参考值。
由表5可知,除ST16外,荞麦麸皮、渣、糁和面任意麸粒级配的麸粉,其铝含量均小于80 mg·kg-1,可安全食用。对比ST14、ST15、ST16样品形态有所不同,样品制备的工艺有所差别,ST16为浆渣麸微粉,浆渣内铝残留的富集,可能是铝超标的原因,在工艺选择时应慎重考虑。
由表6可知,CK12为烤熟粉,其他为未烤熟粉,CK12铝含量小于80 mg·kg-1,烤熟粉对铝残留无明显影响,工艺上可以忽略。CK2-机为机器制粉,CK3-石为石磨制粉,对比铝残留量可发现CK2-机大于CK3-石,工艺上若有条件,应优选石磨制粉。样品成分对比,除CK9-1、CK9-2外,芯粉、皮任意组合麸粒级配的麸粉,其铝含量均小于80 mg·kg-1,可安全食用。CK9-1、CK9-2样品形态为糠,在荞麦原料中属于糟粕,其样品成分中含有花托,花托可能是铝超标的源头,选择样品时应考虑花托对安全食用的影响。
对比表6、表7甜荞麦麸粉副产品CK系列,带壳麸粒级配的麸粉的铝含量远高于不带壳的麸粉,带壳麸粉铝含量最低为93.3 mg·kg-1,最高达512.9 mg·kg-1,平均值为304.8 mg·kg-1。数据表明,铝残留主要富集在荞麦壳,麸粉中若掺杂荞麦壳将严重影响食品安全。
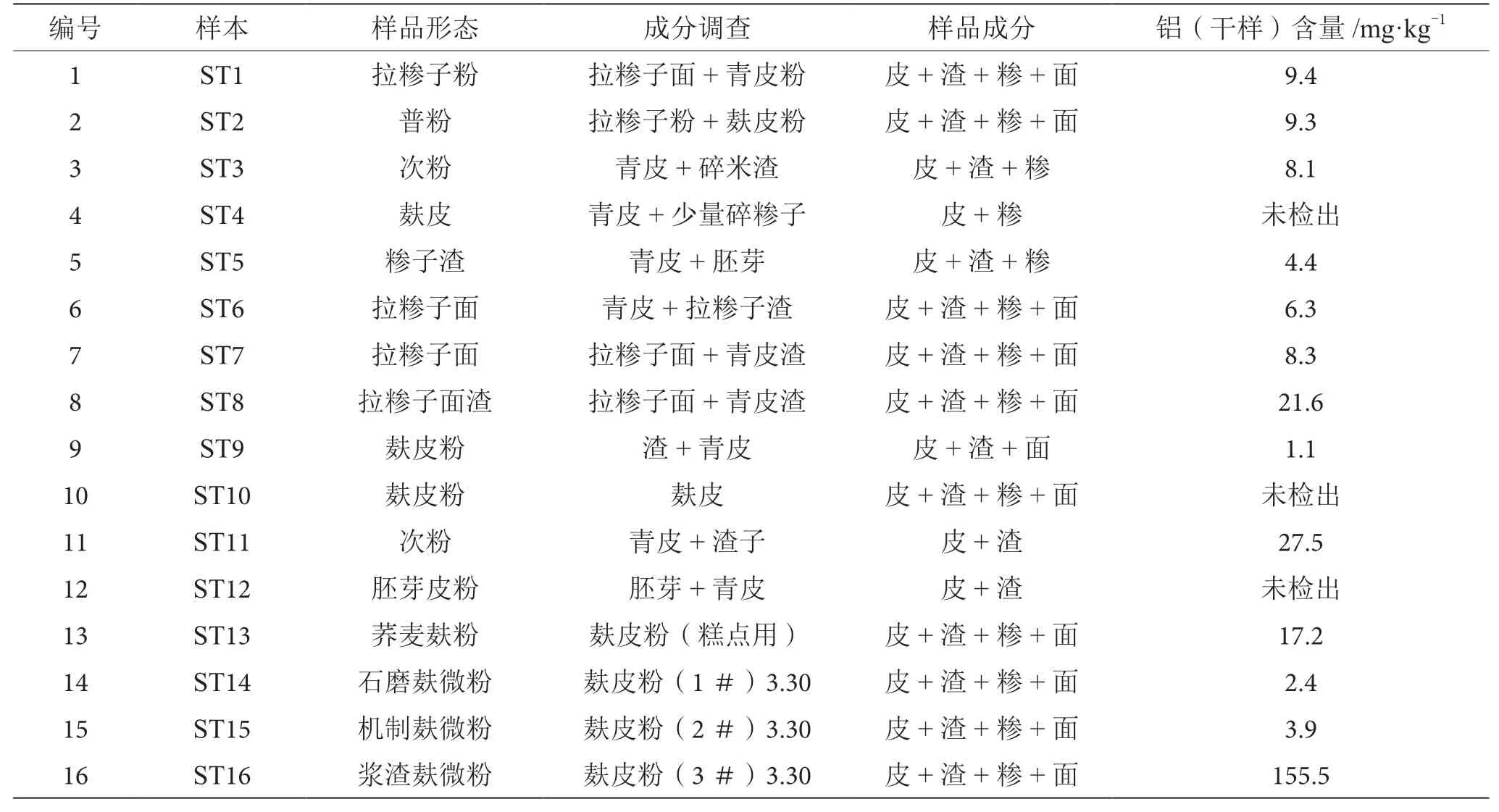
表5 甜荞麸粉副产品ST系列铝含量分析表

表6 甜荞麸粉副产品不带壳CK系列铝含量分析表

表7 甜荞麸粉副产品带壳CK系列铝含量分析表
由表8可知,苦荞带壳的麸粉铝含量高于不带壳麸粉,这与表6、表7甜荞带壳麸粉铝含量高于不带壳麸粉的结论一致,麸粉中若掺杂荞麦壳将严重影响食品安全。SK5为烤熟粉,对比表6中CK12,麸粉是否烤熟对甜荞与苦荞铝含量均无明显影响。表8与表5、表6对比分析,除ST16、CK9-1、CK9-2外,苦荞麸粉中铝含量要高于甜荞麸粉。

表8 苦荞麸粉副产品SK系列铝含量分析表
3 结论
本文建立了基于电感耦合等离子体质谱法测定荞麦麸粉中铝含量的分析方法。该方法铝含量在0~8.0 mg·L-1线性关系良好(r=0.999 8),检出限为0.001 705 mg·L-1, 定量限为0.005 mg·L-1,加标回收率为96.5%~102.8%, 相对标准偏差≤0.84%,方法具有灵敏度和准确度高的特点。
本文首创定义了7个麸粉副产品成分,甜荞浆渣麸微粉中铝含量高,机制粉铝含量大于石磨粉,工艺需要优选。荞麦糠在原料中属于糟粕,其样品成分中含有花托,花托可能是铝超标的源头。同等条件下,苦荞麸粉中铝含量高于甜荞麸粉。无论是甜荞还是苦荞,麸粉是否烤熟对铝含量无明显影响,铝残留主要富集在荞麦壳,麸粉中若掺杂荞麦壳将严重影响食品安全。对荞麦副产品铝含量的检测研究为荞麦副产品食用安全提供了理论基础,提高了荞麦的剩余经济价值,为合理膳食及市场监管提供了有力的技术保障。
——彗星猎手的副产品

