circZNF292靶向miR-23b-3p/SIRT1轴调节人晶状体上皮细胞氧化应激损伤的机制分析△
邢 媛 鲍 宁
年龄相关性白内障(ARC)是我国45岁以上人群发生视力障碍和可逆性失明的重要原因[1]。虽然手术干预是最有效的手段,但是一系列并发症和手术需求急剧增长给社会医疗带来沉重负担,使得寻求预防和治疗ARC的新方法成为亟待解决的重点问题[2]。氧化应激诱导晶状体上皮细胞(LECs)的通透性及蛋白构象发生改变,从而导致晶状体混浊,被认为是引起ARC的早期事件[3]。基于此机制,寻找潜在的治疗靶点成为临床研究的热点。随着高通量测序技术的快速发展,环状RNA(circRNA)作为各种疾病的重要调节因子,其作用越来越受到关注[4]。circRNA富含miRNA反应元件,可以与目标基因通过竞争来约束彼此共享的miRNA,从而上调目标基因表达水平[5]。因此,作为具有调控功能的非编码RNA,circRNA能拮抗microRNA(miRNA),从而参与宿主基因的转录后调控[6-7]。深入探索基因调控网络,如circRNA/miRNA/mRNA,使我们对ARC的发展有了更深入的了解[8-10]。故本研究基于单纯ARC患者的晶状体前囊膜组织转录组学数据,选择差异性表达最典型的circRNA,探究其在抗人LECs氧化损伤过程中的潜在机制,以期为ARC的发病机制研究及临床治疗提供新的思路。
1 材料与方法
1.1 临床标本采集晶状体前囊膜组织样本分别取自3例捐赠眼球[供者年龄50~64(48.5±2.9)岁,排除眼部疾病,依据白内障LOCS III分级,晶状体混浊度为1~2级]和行超声乳化白内障吸除术的3例单纯ARC患者[患者年龄45~70(50.2±3.7)岁,无其他眼部疾病,依据白内障LOCS III分级,晶状体混浊度为4~6级],分别作为对照组和ARC组。对照组在捐赠者死后8 h内由我课题组成员采集患者晶状体前囊膜组织,ARC组晶状体前囊膜组织样本则是由同一位经验丰富的眼科医生在ARC患者的白内障手术中连续环形撕囊时获得。1个样本含有的RNA不足以完成circRNA测序和qRT-PCR分析,因此,需将3例样本放在一起以获得足够的RNA。所收集受试者的年龄、性别(全部为男性)相匹配。每位参与者都提供了书面同意资料,经安徽医科大学第二附属医院伦理审查委员会批准后用于涉及人体的组织学研究和生物信息学分析。
1.2 主要材料TRIzol试剂(美国Life Technologies公司);HiSeq PE 聚类试剂盒v4 cBot(美国Illumina公司);PrimeScriptTMRT逆转录试剂盒和SYBR Premix Ex TaqTM试剂盒(日本Takara Bio公司);双荧光素酶检测试剂盒(美国Promega公司);DMEM培养基(美国Gibco公司);转染试剂LipofectamineTM2000(美国Invitrogen公司);人永生化LECs细胞系(HLE-B3)购自中国科学院上海细胞库。NanoDrop 2000C超微量分光光度计(美国Thermo Fisher Scientific公司);LightCycler 480II实时 PCR系统(瑞士Roche公司)。
1.3 方法
1.3.1 RNA提取及转录组分析按照说明使用 TRIzol 试剂处理晶状体前囊膜组织。总 RNA 浓度通过 NanoDrop仪测定,D260/D280的比率为1.8~2.1为 RNA 纯度的符合标准。根据琼脂糖凝胶电泳上 28 S rRNA和 18 S rRNA条带的形态检测RNA的完整性,构建测序文库。去除总 RNA 中的 rRNA,将纯化的 RNA 逆转录为cDNA。利用HiSeq PE 聚类试剂盒v4 cBot进行聚类分析后,在HiSeq 2500平台上测序,产生约1亿个读码。并利用STAR软件将其定位至人类参考基因组(UCSC hg19)中。使用DCC软件和转录组GTF文件对circRNA进行识别。根据各组织circRNA表达水平绘制circRNA的差异表达基因热图。
1.3.2 qRT-PCR检测TRIzol提取两组受试者晶状体前囊膜组织总RNA,琼脂糖凝胶电泳验证提取RNA的完整性。取等量(500 ng)总RNA按照逆转录试剂盒说明书进行cDNA合成,用Oligo (dt)和随机引物反向转录circRNA和mRNA,用特异性的茎环引物反向转录miRNA。使用SYBR检测试剂盒在LightCycler 480II实时荧光定量PCR系统上进行PCR反应。将GAPDH或小分子U6作为内源性对照。反应条件为:95 ℃预变性10 min,95 ℃ 10 s,60 ℃ 50 s,重复40个循环。每个基因设置3个复孔,实验重复3次。
1.3.3 双荧光素酶报告基因检测为了进一步研究circZNF292下游靶点和调控通路,利用靶区预测算法(miRwalk 3.0)预测circZNF292与miRNA的相互作用。用PCR扩增circZNF292的片段,将PCR产物克隆至紧靠荧光素酶基因序列下游的psicHECK-2载体中,构建含有miR-23b-3p突变种子序列的circZNF292的psicHECK-2。所有结构均经DNA测序验证。将HLE-B3细胞接种至96孔板中,然后与100 ng构建物共转染48 h,使用双荧光素酶报告基因检测系统检测荧光素酶活性。同样的方法验证miR-23b-3p和SIRT1的靶向结合关系。
1.3.4 细胞培养和分组处理将HLE-B3细胞培养于含体积分数10%胎牛血清的DMEM培养基中,置于37 ℃、体积分数5%CO2、饱和湿度的培养箱中培养。将HLE-B3细胞分为空白对照组、NC siRNA组、circZNF292 siRNA组、ZNF292 siRNA组、circZNF292+ZNF292 siRNA组、NC inhibitor组、miR-23b inhibitor组、NC mimics组、miR-23b mimics组、circZNF292 siRNA+miR-23b inhibitor组。空白对照组不做任何特殊处理;其余各组分别用脂质体介导法将阴性对照序列、circZNF292 siRNA(50 nmol·L-1)、线性ZNF292 siRNA(50 nmol·L-1)、circZNF292和线性ZNF292 siRNA(均为50 nmol·L-1)、阴性对照抑制剂序列、miR-23b-3p抑制剂(100 nmol·L-1)、阴性对照模拟序列、miR-23b-3p模拟剂(50 nmol·L-1)、circZNF292 siRNA和miR-23b-3p抑制剂(均为50 nmol·L-1)用转染试剂Lipo2000转染至HLE-B3细胞中。转染48 h后,检测HLE-B3功能和基因表达。
1.3.5 氧化应激指标检测收集各组HLE-B3细胞,用细胞裂解液裂解后取上清,按照试剂盒说明书检测丙二醛(MDA)、超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)的含量。用2’,7’一二氯荧光素二乙酸酯(DCFH-DA)探针检测HLE-B3细胞内源性活性氧(ROS)荧光强度,具体为:将HLE-B3细胞接种于96孔板,分组处理48 h后,加入荧光探针DCFH-DA,在37 ℃培养箱中孵育20 min,洗涤后用流式细胞仪检测细胞的荧光强度(激发波长488 nm,发射波长525 nm)。
1.3.6 MTT法检测细胞活力将HLE-B3细胞接种于96孔板(每孔1×103个),分组处理48 h后,加入MTT试剂(5 g·L-1),37 ℃反应4 h,去除培养基后加入100 mmol·L-1二甲基亚砜终止反应。用酶标仪于490 nm处测量光密度。
1.3.7 流式细胞术检测细胞凋亡收集各组HLE-B3细胞悬浮于500 μL的1×结合缓冲液中,加入5 μL Annexin V-异硫氰酸荧光素(V-FITC)和5 μL碘化丙啶(PI),室温下黑暗培养15 min。用A60-Micro流式细胞仪分析细胞凋亡情况。
1.3.8 Western blot法检测SIRT蛋白表达收集各组HLE-B3细胞,在含有苯基甲烷磺酰氟的培养液中4 ℃反应30 min,用BCA试剂盒对样本蛋白进行定量。蛋白质用120 g·L-1聚丙烯酰胺凝胶电泳分离,然后转移到聚偏二氟乙烯膜上。用体积分数5%脱脂乳缓冲液封闭,阻断非特异性蛋白与膜的结合。然后与一抗SIRT1(11000)在4 ℃孵育12 h,与二抗孵育2 h,ECL试剂盒显影。

2 结果
2.1 circRNA的差异基因在所有晶状体前囊膜组织中,共检测到21 659个可能的circRNA(ARC组17 038个和对照组11 380个)。circRNA的长度分布中位数为560 nt。设定的倍数变化>2.0,鉴定469个下调circRNA和1231个上调circRNA(图1A),然后通过热图进行层次聚类分析展示差异表达的circRNA(图1B),得到前10位下调和上调最明显的circRNA。经qRT-PCR检测,其中7个circRNA在对照组和ARC组晶状体前囊膜组织中有明显差异表达(图1C)。通过计算机分析和文献研究,确定了一个丰富而高度保守的基因circZNF292。
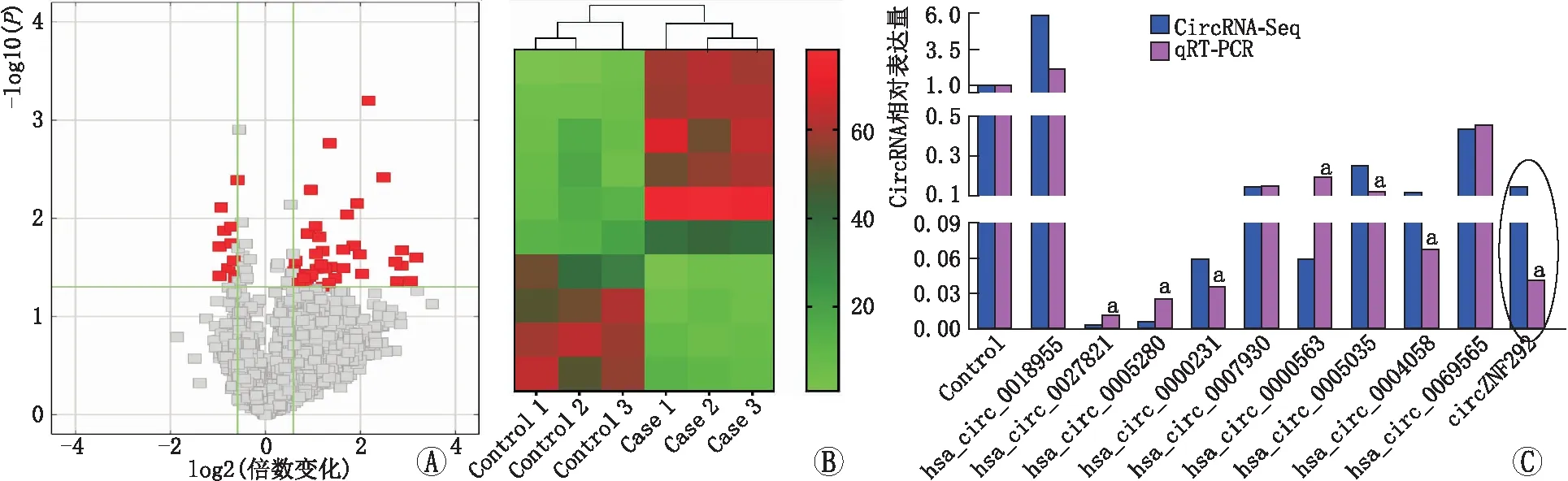
图1 对照组和ARC组晶状体前囊膜组织中差异表达的circRNA比较分析 A:火山图,红点代表有统计学意义的差异表达;B:circRNA差异倍数前10位的差异基因热图;C:qRT-PCR验证10个差异性表达最明显的circRNA在对照组和ARC组晶状体前囊膜组织中的表达情况(与对照组相比,aP<0.05)。
2.2 qRT-PCR验证circZNF292、miR-23b-3p和SIRT1在晶状体前囊膜组织中的表达使用TargetScan 和 StarBase 在线软件预测 miRNA 的 mRNA 靶标。基于前期工作基础选择氧化应激、细胞凋亡相关基因分析。qRT-PCR检测结果显示,与对照组相比,circZNF292和SIRT1 mRNA在ARC组晶状体前囊膜组织中均呈低表达(均为P<0.05),而miR-23b-3p则呈高表达(P<0.05)(图2)。经双变量Pearson相关分析,circZNF292与miR-23b-3p表达、miR-23b-3p与SIRT1 mRNA表达均呈负相关(r=-0.935,-0.951,均为P<0.05)。

图2 qRT-PCR检测各基因在晶状体前囊膜组织中的表达
2.3 circZNF292与miR-23b-3p、miR-23b-3p与SIRT1靶向关系双荧光素酶报告基因检测系统检测结果显示,circZNF292与miR-23b-3p、miR-23b-3p与SIRT1均具有结合性(图3)。
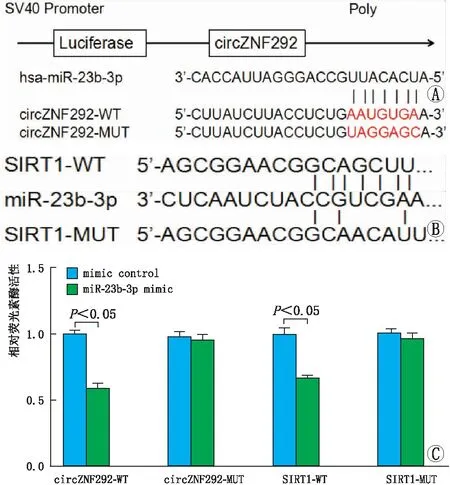
图3 双荧光素酶报告基因检测系统检测circZNF292与miR-23b-3p、miR-23b-3p与SIRT1靶向关系 A:circZNF292与miR-23b-3p的靶向关系;B:miR-23b-3p与SIRT1的靶向关系;C:双荧光素酶报告分析。
2.4 沉默circZNF292而非线性ZNF292介导了HLE-B3细胞存活力降低circZNF292位于ZNF292宿主基因第二和第四个外显子之间。circZNF292 siRNA组HLE-B3细胞中circRNA表达水平较NC siRNA组降低(0.35±0.06vs.1.00±0.07;t=23.041,P<0.001),circZNF292+ZNF292 siRNA组circZNF292相对表达量也降低至0.32±0.05,但并不影响线性ZNF292的表达(0.96±0.13vs.1.00±0.09;t=0.935,P=0.359)。MTT法检测结果显示,NC siRNA组细胞D490为0.871±0.078,circZNF292 siRNA组细胞D490则降低至0.492±0.065(t=10.561,P<0.001);而ZNF292 siRNA组细胞D490(0.859±0.084)与NC siRNA组相比几乎一致(t=0.296,P=0.772)。此外,敲低circZNF292和线性ZNF292后,HLE-B3细胞D490则降低至0.503±0.058(t=10.706,P<0.001),且与circZNF292 siRNA组比较差异无统计学意义(t=0.357,P=0.726)。说明下调circZNF292表达而非线性ZNF292表达显著降低了HLE-B3细胞活力,因此在后续实验中,选择性敲低circZNF292。
2.5 敲低circZNF292对H2O2诱导的HLE-B3细胞中ROS、MDA、SOD、GSH-Px含量的影响NC siRNA组和空白对照组HLE-B3细胞中ROS、MDA、SOD、GSH-Px含量比较,差异均无统计学意义(均为P>0.05)。应用H2O2刺激后,与NC siRNA组相比,NC siRNA组+H2O2HLE-B3细胞中ROS、MDA含量均明显升高(均为P<0.05),SOD、GSH-Px含量均明显降低(均为P<0.05);而与NC siRNA组+H2O2相比,circZNF292 siRNA组+H2O2HLE-B3细胞中ROS、MDA含量则进一步升高(均为P<0.05),SOD、GSH-Px含量则进一步降低(均为P<0.05)(表1)。

表1 敲低circZNF292对H2O2诱导的HLE-B3细胞中ROS、MDA、SOD、GSH-Px含量的影响
2.6 circZNF292/miR-23b-3p/SIRT1轴参与了HLE-B3细胞功能的调控与空白对照组相比,NC siRNA组、NC inhibitor组、NC mimics组HLE-B3细胞中SIRT1蛋白表达几乎一致(均为P>0.05)。与NC siRNA组相比,circZNF292 siRNA组HLE-B3细胞SIRT1蛋白表达水平降低(P<0.05);与NC inhibitor组相比,miR-23b inhibitor组HLE-B3细胞SIRT1蛋白表达水平升高(P<0.05);与NC mimics组相比,miR-23b mimics组细胞SIRT1蛋白表达水平降低(P<0.05);与circZNF292 siRNA组相比,circZNF292 siRNA+miR-23b inhibitor组细胞SIRT1蛋白表达降低被逆转(P<0.05)(图4)。

图4 Western blot法检测各组细胞SIRT1蛋白表达 A:空白对照组;B:NC siRNA组;C:circZNF292 siRNA组;D:NC inhibitor组;E:miR-23b inhibitor组;F:NC mimics组;G:miR-23b mimics组;H:circZNF292 siRNA+miR-23b inhibitor组。
NC siRNA组和空白对照组细胞活力(D490:0.86±0.04vs.0.87±0.06;t=0.392,P=0.701)、凋亡率[(6.71±1.79)%vs.(7.18±2.30)%;t=0.456,P=0.655]差异均无统计学意义。经H2O2刺激后,与NC siRNA组相比,NC siRNA组+H2O2HLE-B3细胞D490降低至0.34±0.02(t=23.698,P<0.001),凋亡率增加至(38.95±3.48)%(t=21.541,P<0.001);与NC siRNA组+H2O2相比,circZNF292 siRNA组+H2O2HLE-B3细胞D490进一步降低至0.24±0.01(t=39.867,P<0.001),凋亡率进一步增加至(60.08±7.31)%(t=45.782,P<0.001);与NC inhibitor组相比,miR-23b inhibitor组HLE-B3细胞活力增加(D490:0.54±0.05vs.0.35±0.03;t=9.216,P<0.001),凋亡率降低[(18.94±2.30)%vs.(40.11±4.98)%;t=10.921,P<0.001];circZNF292 siRNA+miR-23b inhibitor组细胞活力(D490:0.43±0.07vs.0.24±0.01,t=7.600,P<0.001)和凋亡率[(38.95±4.46)%vs.(60.08±7.31)%;t=6.979,P<0.001]较circZNF292 siRNA组均被逆转。
3 讨论
晶状体是人眼最重要的屈光介质之一,正常生理状态下为透明、无血管的组织;然而多种风险因素,如暴露于紫外线、吸烟、衰老、代谢紊乱、营养不良等都会导致LECs发生氧化应激损伤[11-12]。从分子学角度分析,氧化应激可诱导细胞内核酸、脂类、晶状体蛋白质和多糖的过氧化,激活信号转导通路和转录因子,导致眼晶状体混浊,这被认为是ARC发病的早期事件[9,13-15]。最近的研究表明,circRNA在白内障中广泛表达并对ARC的发展起一定作用[16-17],但circRNA在氧化应激中的作用仍不清楚,其可能通过靶向miRNA/mRNA通路影响LECs的凋亡[18-19]。因此,对circRNA/miRNA/mRNA网络的研究对于开发预防或治疗ARC的药物具有重要的临床意义。
本研究利用二代测序技术详细检测了ARC患眼晶状体中的circRNA表达谱,筛选得到circZNF292在ARC患者晶状体前囊膜组织中显著下调。circZNF292位于ZNF292宿主基因第二和第四个外显子之间,在不同细胞系和组织中高度保守。为了确定是circZNF292还是线性ZNF292在体外调节HLE-B3细胞的功能,我们采用了三个小干扰RNA(siRNA)进行实验:circZNF292 siRNA是直接针对circZNF292的反剪接序列,ZNF292 siRNA则直接针对线性ZNF292的序列,以及针对线性和circRNA共享的外显子序列设计的siRNA。结果显示,沉默circZNF292而非线性ZNF292能够显著抑制HLE-B3细胞活力。长期以来,氧化应激一直被认为是ARC的一个主要诱发因素。氧化应激增加了LECs的凋亡,而敲除circZNF292则进一步增加了细胞凋亡率,并降低了细胞活性,这意味着晶状体组织中,circZNF292低表达介导的LECs功能障碍可能是促进ARC形成和进展的主要因素之一。
此外,通过一个包括mRNA、miRNA和蛋白质的复杂网络,circRNA已经成为有前途的基因表达调节因子。在以往的研究中,circZNF292被证实可吸附多种miRNA,其中包括miR-23b-3p。本研究我们也证实,敲除circZNF292能显著提高miR-23b-5p的表达水平。据报道,miR-23b-3p能够通过调节SIRT1依赖的信号转导通路促进高葡萄糖诱导的LECs代谢记忆,进而促进糖尿病视网膜病变[20];此外miR-23b-3p可以通过靶向Sprouty2促进卵磷脂的上皮-间充质转化[21]。本研究我们发现,在晶状体前膜囊组织中,miR-23b-3p表达与SIRT1呈负相关,而且双荧光素酶报告基因检测结果也支持circZNF292可作为miR-23b-3p的分子海绵直接与 miR-23b-3p结合,减轻miR-23b-3p对下游靶基因SIRT1的抑制作用。
综上,我们通过对ARC患者晶状体前囊膜组织中circRNA的差异表达分析和功能预测,筛选出与miR-23b-3p表达相关的基因circZNF292,而circZNF292则可通过miR-23b-3p/SIRT1轴来调节人LECs的氧化应激损伤,被证实在ARC发病机制中具有潜在的抗氧化作用。然而,我们的临床样本只是基于透明和混浊晶状体前囊膜的circRNA表达谱分析。circZNF292在不同类型白内障发病机制中的具体作用尚不清楚,需要在各种白内障和不同程度氧化损伤模型中使用与年龄匹配的人类晶状体进一步研究circZNF292变化与ARC形成之间的关系。

