毛菊苣子-毛菊苣根配伍的体外抗肝纤维化作用研究
阿达来提·木合塔尔,臧薇,李茜,赵耀,王杨静楠,杨建华,胡君萍*(. 新疆医科大学药学院,乌鲁木齐 83007;. 河北廊坊市药品检验所,河北 廊坊 065000;3. 新疆医科大学第一附属医院,乌鲁木齐 830054)
《中国药典》2020年版收载的菊苣是指菊科菊苣属植物菊苣(Cichorium intybus)或者毛菊苣(Cichorium glandulosum)的干燥地上部分或根,具有清肝利胆、健胃消食、利尿消肿作用[1]。毛菊苣广泛分布于中国新疆,在新疆地区其根、种子、全草都可入药[2]。毛菊苣根具有保肝、降血糖和降血脂等作用,毛菊苣种子主治湿热性疾病,如肝脏阻塞、湿热性肾炎、小便不利和全身性水肿等,其黄酮类成分还具有保肝、抗氧化和抗菌作用[3]。毛菊苣根和种子在许多成方制剂中也有应用,其用药配伍也有独特之处,如毛菊苣子-根在护肝布祖热方、炎消迪娜尔方、复方木尼孜其方中的比例分别为2∶1、1∶2 和1∶1,这种同一植物不同药用部位以不同比例配伍使用在维吾方剂中较为常见[4]。研究显示,毛菊苣子-毛菊苣根配伍后的保肝护肝作用优于单一药材,不同配伍比例的肝保护作用亦不同[5-7];课题组进一步研究发现,毛菊苣根和种子中所含化学成分及微量元素存在较大差异[8-9],但两者配伍组方治疗肝病的规律和机制尚不明确。因此本文探讨了毛菊苣子-毛菊苣根配伍前后体外抗肝纤维化活性及其机制,以期为揭示毛菊苣在护肝方剂中配伍规律提供数据。
1 材料
1.1 药材
毛菊苣种子(批号:20171201)、毛菊苣根(批号:20170704)(新疆和田县中医院)由新疆医科大学药学院胡君萍教授鉴定为毛菊苣Cichorium glandulosum的干燥种子和根。
1.2 细胞
大鼠肝星状细胞(HSC-T6 细胞)(新疆医科大学第一附属医院临床研究院惠赠)。
1.3 试药
1640 培养基(批号:0013819)、胎牛血清(批号:1922693)、0.25%胰酶-EDTA 消化液(批号:0052419)(BI 公司);磷酸缓冲盐溶液(PBS,北京全式金生物技术有限公司,批号:N50807);双抗(青霉素-链霉素)(北京全式金生物技术有限公司,批号:N20401);CCK-8 试剂盒(北京博奥森生物技术有限公司,批号:AI08014117);碘化丙啶/核糖核酸酶染色溶液(批号:9183478)、FITC 偶联Annexin-V 凋亡检测试剂盒(批号:9154818)(比欧联科供应链管理有限公司);PDGF-BB(PeproTech,批号:101704);大鼠透明质酸检测试剂盒(批号:05/2019)、大鼠Ⅳ型胶原检测试剂盒、大鼠层粘连蛋白检测试剂盒(上海酶联);大鼠Ⅲ型前胶原检测试剂盒(上海将来实业股份有限公司);RIPA 细胞裂解液、BCA 蛋白测定试剂盒、蛋白上样缓冲液、SDSPAGE 凝胶制备试剂盒(北京索莱宝科技有限公司);甘氨酸(批号:56-40-6)、SDS(批号:151-21-3)、Tris(批号:77-86-1)、琼脂糖(批号:1183GR500)(德国Biofroxx 公司);脱脂奶粉(美国BD 公司,批号:N/A);一抗稀释液(Biosharp 生物科技有限公司,批号:210217);溴化乙锭(批号:D0129)、焦炭酸二乙酯(批号:D1135)、Loading buffer(批号:D0214)、DNA marker DL2000(批号:D0237)(碧云天生物技术研究所);荧光定量试剂盒[TB Green RT-PCR Kit II 宝生物工程(大连)有限公司];辣根过氧化酶标记二抗、JNK(美国CST 公司);彩色蛋白预染marker(10 ~180 kDa)(赛默飞世尔科技有限公司);PVDF 膜(美国Milipore 公司);ECL 试剂盒(Biosharp 生物科技有限公司);DAB 显色试剂盒、通用SP 试剂盒、柠檬酸盐、PBS 缓冲盐、中性树胶(北京中杉金桥生物技术有限公司)。
1.4 仪器
DMI6000B 型倒置显微镜(德国Leica 公司);Galaxy-170R 型CO2培养箱(英国New Brunswick 公司);KS18 型超净工作台、MuLtiskan-G0 型全波长酶标仪(美国Thermo 公司);KG-SX-500 型高压蒸汽灭菌锅(日本TOMY 公司);EPICS-XL/XL-MCL流式细胞仪(美国Beckmann 公司);MuLtiskan全波长酶标仪(美国Thermo Fisher 公司);化学发光成像系统(美国ProteinSimple 公司);Mini-PROTEAN Tetra Cell 系统(美国Bio-Rad 公司);BCD-238WF 型超低温冰箱(中国海尔集团)。
2 方法
2.1 样品制备
取毛菊苣种子(S 组)、根(R 组)以及两者配伍1∶1(S1R1 组)、1∶2(S1R2 组)和2∶1(S2R1 组)药材分别以10 倍量蒸馏水煎煮2 次,每次1.5 h,合并煎煮液,减压浓缩,得到干燥浸膏,具体信息见表1。将浸膏研磨成细粉,分别称取0.25 g,用3 mL 的1640 完全培养基溶解,再用0.22 µm 的微孔滤膜过滤除菌,使其成为终浓度为83 mg·mL-1的样品母液,置于-4 ℃冰箱保存备用。

表1 毛菊苣样品分组Tab 1 Samples of Cichorium glandulosum at different compatibilities seed and root
2.2 细胞培养及体外肝纤维化细胞模型的建立
将HSC-T6 细胞用1640 完全培养基(含10%胎牛血清、1%双抗)于37℃、5%CO2、饱和湿度的培养箱内培养。取对数生长期的HSC-T6 细胞,以5×104个·mL-1接种于96 孔板内,待细胞24 h 贴壁后,吸弃上清液,设空白组(完全培养基),对照组(含细胞以及1640 完全培养基),不同浓度PDGF-BB 干预组(将PDGF-BB 用1640 完全培养基进行溶解使其终质量浓度为5、25、125、250 ng·mL-1),每孔加入100 µL 的PDGF-BB。每组设3 个复孔。置于37℃、5%CO2饱和湿度的培养箱内培养24 h 和48 h 后,吸弃旧的培养基,加入新鲜的1640 完全培养基,每孔加入10 µL 的CCK-8 试剂,放回培养箱避光孵育1 h 后,在酶标仪于450 nm 下测定各孔OD值,取其平均值计算细胞存活率。细胞存活率(%)=[(OD给药组-OD空白组)/(OD对照组-OD空白组)]×100%。
2.3 不同配比药材对HSC-T6 细胞增殖的影响
取对数生长期的HSC-T6 细胞,以5×104个·mL-1接种于96 孔板内,设空白组(1640 完全培养基)、对照组(不加任何药物的HSC-T6 细胞组)、模型组(含25 ng·mL-1的PDGF-BB 培养液)、不同比例药材水提液组(含25 ng·mL-1的PDGF-BB 培养液和不同配比药材),每组设3个复孔,置于37℃、体积分数5%CO2饱和湿度的培养箱内培养48 h,每孔加入10 µL 的CCK-8试剂,放回培养箱避光孵育1 h 后,在全波长酶标仪上于450 nm 波长处测定每孔OD值,计算细胞的生长抑制率。抑制率(%)=[(OD对照组-OD加药组)/(OD对照组-OD空白组)]×100%。
2.4 不同配比药材对HSC-T6 细胞肝纤维化的影响
取对数生长期的HSC-T6 细胞以5×104个·mL-1的密度接种于96 孔培养板内,设空白组(1640 完全培养基)、对照组(不加任何药物的HSC-T6 细胞组)、模型组(含25 ng·mL-1的PDGF-BB 培养液)、不同比例药材水提液组(含25 ng·mL-1的PDGF-BB 培养液和不同配比药材),每组设3 个复孔,放入5%CO2培养箱内培养48 h 后,取出96 孔板,吸出上清液,用试剂盒测定细胞上清液中透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(Ⅳ-C)等肝纤维化指标。
2.5 不同配比药材对HSC-T6 细胞凋亡的影响
将对数生长期的HSC-T6 细胞,调整浓度为5×105个·mL-1,接种于6 孔板内,待细胞贴壁后,吸弃上清液,实验组分别加入含25 ng·mL-1的PDGF-BB 的不同配伍比例药材培养液2 mL,对照组加入不含药物的完全培养液2 mL,放入培养箱内培养48 h 后,收集细胞,实验组细胞加入100 μL Binding Buffer 和FITC 标记的Annexin-V 和PI 各5 μL,室温避光反应5 min后加入400 μL Binding Buffer,滤膜过滤,上流式细胞仪检测。
2.6 不同配比药材对HSC-T6 细胞相关蛋白表达的影响
采用Western blot 法检测各组细胞上清液中Ras、ERK1、ERK2、C-fos、JNK 蛋白的表达。将细胞蛋白裂解后,BCA 法进行蛋白定量。待测样品蛋白上样总量为30 μg,上样体积控制在4 ~8 μL,预染蛋白marker 的上样量为2 μL,用于分辨蛋白分子量条带。样品经过SDS-PAGE 垂直电泳后进行PVDF 膜凝胶转移,转膜成功后浸入5%脱脂奶粉的封闭液中60 min,1×TBST 清洗3 次,每次5 min,加入一抗孵育过夜。次日用1×TBST 清洗3 次,每次15 min,加入辣根酶标记二抗(1∶2000 稀释),室温孵育60 min。二抗孵育结束后,放入化学发光凝胶成像系统中曝光,使用Image J 软件对扫描后的图像进行分析,通过对目标条带积分来计算积分下面积,并与内参β-actin 进行比较,结果以相对表达值表示。
2.7 统计学方法
采用SPSS21.0 统计软件进行数据分析,计量资料以均数±标准差表示,先经方差齐性检验,若方差齐再进行单因素方差分析,P<0.05表示差异有统计学意义。
3 结果
3.1 模型建立的浓度和时间筛选
PDGF-BB 对HSC-T6 细胞干预之后,采用CCK-8 法分别于24 h 和48 h 检测细胞增殖情况。结果显示,加入PDGF-BB 24 h 后,各组细胞存活率随着PDGF-BB 浓度增加而增加;干预48 h 后,各组细胞虽然呈现增殖,但增殖率较低,且无剂量依赖性。故选择体外PDGF-BB 诱导HSC-T6 细胞肝纤维化模型建立的剂量和时间分别为25 ng·mL-1和24 h。结果见图1。

图1 不同造模浓度和时间下HSC-T6 的细胞存活率( ±s,n =3)Fig 1 Survival rate of HSC-T6 cells induced by different PDGF-BB concentrations and time( ±s,n =3)
3.2 不同配比药材对HSC-T6 细胞增殖的影响
由图2可知,与模型组相比,给予不同配比药物水提液干预对细胞增殖均有不同程度的抑制作用(P<0.01),R 组的抑制率高于S 组(P<0.01),说明毛菊苣根对HSC-T6 细胞增殖的抑制活性强于种子。与S 组相比,S1R1 组、S1R2 组、S2R1 组的抑制率也较高(P<0.01),说明配伍后药物的细胞增殖抑制作用强于单味药种子。与R 组相比,S1R2 组和S2R1 组对细胞增殖抑制率较高(P<0.01)。

图2 不同配伍比例药材对HSC-T6 细胞增殖的影响( ±s,n =3)Fig 2 Effect of different compatibility drug ratios on the proliferation of HSC-T6 cells( ±s,n =3)
3.3 不同配比药材对HSC-T6 细胞肝纤维化指标的影响
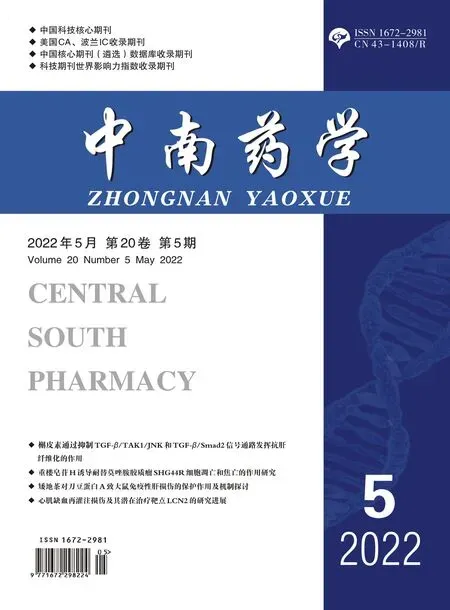
与对照组比较,模型组细胞上清液中透明质酸(HA)、层粘连蛋白(LN)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(Ⅳ-C)等肝纤维化指标均显著增高(P<0.01)。与模型组相比,各给药组肝纤维化指标均有显著性降低(P<0.01),其中,S1R2 组和S2R1 组降幅更大,说明毛菊苣种子、根以及两者配伍后均具有体外抗肝纤维化作用,且配伍后作用更强。结果见图3。
图3 不同配伍比例药材对HSC-T6 细胞肝纤维化指标的影响(x ±s,n =3)Fig 3 Effect of different compatibility drug ratios on the liver fibrosis indexes for HSC-T6 cells(x ±s,n =3)
3.4 不同配比药材对HSC-T6 细胞凋亡的影响
与对照组相比,模型组给予PDGF-BB 干预后,其凋亡率降低(P<0.01)。与模型组相比,给予不同配伍比例药材水提液后,其凋亡率均有所增加,其中,S1R2 组的凋亡率最高[(46.8±0.15)%],其次为S2R1 组,S 组的凋亡率最低[(14.8±0.35)%]。结果图4。

图4 不同配伍比例药材对HSC-T6 细胞增殖凋亡的影响Fig 4 Apoptosis Effect of different compatibility drug ratios on the proliferation and apoptosis of HSC-T6 cells
3.5 不同配比药材对Ras、ERK1、ERK2、C-fos、JNK 蛋白表达的影响
与对照组相比,模型组Ras、ERK1、ERK2、C-fos、JNK 的表达较强(P<0.05)。与模型组相比,各给药组Ras、ERK1、ERK2、C-fos、JNK表达均有所下降(P<0.05);其中,S1R2 组和S2R1 组下降更明显;R 组比S 组下调蛋白表达更为明显,说明毛菊苣种子抑制蛋白表达的能力弱于毛菊苣根。结果见图5。
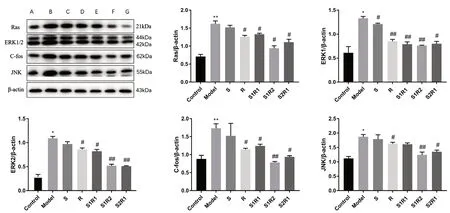
图5 不同配伍比例药材水提液对ERK/Ras 信号通路中关键蛋白表达量的影响Fig 5 Effect of different compatibility of drug water extract on the protein expression in the ERK/Ras signaling pathway of HSC-T6 cells
4 讨论
HSCs 是位于肝间质的肝特异性细胞,也是肝纤维化的主要细胞类型[10]。各种病因(如酒精性脂肪肝、非酒精性脂肪肝、病毒性肝炎等)导致肝脏发生损伤时,静息态的HSC 活化并转分化为促进瘢痕形成的肌成纤维细胞,并分泌细胞外基质(extracellular matrix,ECM)促进损伤修复,但过度的ECM 累积会导致肝脏纤维化[11]。血小板衍生生长因子(platelet derived growth factor,PDGF)是一种促进HSC 活化的较强的有丝分裂因子,A 链和B 链组成PDGF 的3 种形式, 即PDGF-AA、PDGF-BB 和PDGF-AB。 有研究表明,PDGF-BB 是最强的刺激HSC 活化增殖的因子[12]。故本实验中采用PDGF-BB 诱导大鼠HSC-T6 细胞活化增殖建立体外肝纤维化模型。
ECM 主要由HSC 活化产生,该活化过程以及肝纤维化的形成由多种细胞信号转导通路参与形成[13]。PDGF-BB 在肝纤维化过程中刺激Ras/Raf-1/MEK/ERK 级联反应。在MAPK 信号转导途径中,ERK 通路是较为经典的一条,该途径对细胞形态、迁移、代谢、增殖、分化和存活具有重要的调控作用,ERK1/2 可以通过磷酸化被一系列细胞生长因子激活[14-15]。激活的激酶有助于调节HSC 的增殖和ECM 的产生。此外,在静止的或激活的HSC 中抑制JNK 活性可以阻止HSC激活。故本研究采用免疫印迹法检测不同配伍比例毛菊苣子-毛菊苣根对PDGF-BB 诱导增殖的HSC-T6 细胞ERK/Ras 通路中Ras、ERK1/2、C-fos、JNK 相关蛋白的表达情况,结果显示毛菊苣子-毛菊苣根在配伍前后抗肝纤维化作用机制与下调Ras、ERK1/2、C-fos、JNK 相关蛋白的表达和抑制MAPK 激活有关,并且配伍后对蛋白表达的影响也更为显著。
在中医药领域,经过长期的临床实践和循证医学研究,已逐步建立起以辨证论治为特征的抗肝纤维化治疗方案,并产生了许多抗肝纤维化中成药和经验方,如扶正化瘀片(胶囊)、复方鳖甲软肝片、安络化纤丸、养血柔肝丸(汤)等[16]。在一些新疆地产民族药方中,主药均包含不同比例的毛菊苣子和毛菊苣根,但其功效不尽相同,如护肝布祖热颗粒和炎消迪娜尔糖浆临床用于治疗肝病,而复方木尼孜其颗粒则用于调节体液及气质[4]。毛菊苣子和根不同配伍比例与临床适应证是否存在相关性值得关注。本研究结合肝纤维化四项指标和细胞增殖、凋亡实验结果综合分析发现,毛菊苣子-毛菊苣根以1∶2 和2∶1 配伍后的抗肝纤维化活性强于单味药材,推测配伍后药材中的化学成分发生了变化,故其配伍的化学机制值得进一步研究。