绿茶、橘皮、大豆中酚类物质体外消化前后稳定性及抗氧化活性的研究
谢乐怡,张 兵,李红艳
(南昌大学食品科学与技术国家重点实验室,江西南昌 330047)
酚类化合物广泛存在于水果、蔬菜、谷物以及茶叶中。研究表明,酚类化合物具有抗癌、抗肿瘤、清除自由基、降血脂等多种生物活性[1]。酚类化合物结构复杂、种类繁多,主要包括黄烷醇类、黄烷酮类、异黄酮类、花色素类等。其中,异黄酮类化合物包括染料木素、大豆苷等;黄烷醇类化合物包括(+)-儿茶素、表没食子儿茶素等;黄烷酮类化合物包括柚皮素、橙皮苷等[2]。
酚类化合物发挥其生物活性作用的重要途径是经过人体口胃肠的消化,因此,研究酚类化合物消化稳定性成为食品相关领域的热点之一。模拟体外消化是通过模拟人体口腔、胃和小肠的消化环境来还原人体实际消化的过程,相对于体内研究更加快速、简易、易于控制,成为研究食物在模拟体外消化中变化的重要途径。朱秀灵等[3]研究发现,经模拟胃消化后,苹果提取物中儿茶素、表儿茶素、咖啡酸含量大幅度降解,仅有绿原酸经肠道消化后被检测到,说明经胃肠消化提取物中的酚类物质发生降解或转化。Su 等[4]研究发现,胃蛋白酶和胰蛋白酶处理对柑橘果皮的TPC 和TFC 没有显著提高效果,但模拟体外消化提高了柑橘皮FRAP 和ABTS 的抗氧化能力。Guo 等[5]研究发现,体外模拟胃肠消化(包括透析)后,未消化豆浆的TPC、FRAP 和DPPH 自由基清除活性显著低于胃消化后的豆浆,而高于透析部位的豆浆。胃消化显著增加了豆浆中生物活性物质的释放。
黄烷醇、黄烷酮、异黄酮类化合物广泛存在日常膳食中,是三类具有代表性的酚类化合物。其中,茶叶中单体黄烷醇含量最高,柑橘皮中黄烷酮类化合物含量丰富,豆科植物尤其是大豆中异黄酮含量特别丰富。目前,少有研究比较黄烷醇、黄烷酮、异黄酮类化合物经过体外消化前后稳定性的变化及抗氧化活性的变化,因此,本研究选择绿茶、橘皮、大豆作为黄烷醇、黄烷酮、异黄酮类化合物的食物代表,模拟体外消化过程,运用高效液相色谱-二极管阵列检测器/电喷雾-四极杆-飞行时间串联质谱检测器(HPLCDAD/ESI-Q-TOF-MS)检测消化前后绿茶、橘皮、大豆三种提取物酚类物质变化,采用福林酚法、比色法、ABTS、DPPH、FRAP、ORAC 等方法检测总酚、总黄酮含量以及抗氧化活性的变化。通过研究绿茶、橘皮、大豆中酚类物质体外消化前后稳定性及抗氧化活性的变化,为功能性食品研制及综合开发活性物质提供一定的理论依据和科学指导。
1 材料与方法
1.1 材料与仪器
庐山云雾茶、云南蜜橘、南昌大豆 南昌市天虹超市;福林酚试剂、没食子酸(纯度≥98.0%,HPLC级)、芦丁(纯度≥98.0%,HPLC 级)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、α-淀粉酶(酶活为1500 U/mL)、胃蛋白酶(酶活为25000 U/mL)、胰蛋白酶(酶活为1500 U/mL)、水溶性维生素E(6-羟基-2,5,7,8-四甲基色烷-2-羧酸(6-hydroxy-2,5,7,8-tetramethylchroman-2-carboxylic acid,Trolox)、2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、2,2-偶氮双(2-甲基丙脒)二盐酸盐(AAPH)、荧光素钠、2’,7’-二氯荧光素二乙酸酯(DCFH-DA) 美国阿拉丁公司;猪胆盐(160 mmol/L)北京索莱宝科技有限公司。
SHZ-A 型水浴恒温振荡器 上海博迅实业有限公司;ELX800 型全自动酶标仪 Biotek 仪器股份有限公司;SK3310HP 型超声波清洗器 上海科导超声仪器有限公司;FD-1 型冷冻干燥机 北京德天佑科技发展有限公司;RE-85Z 型旋转蒸发仪 巩义市英峪予华仪器厂;1200N 高效液相色谱(high performance liquid chromatography,HPLC)仪、UPLC-ESIQ-TOF-MS 6538 型三重串联四极杆飞行时间质谱(mass spectrometry,MS)仪 美国安捷伦公司。
1.2 实验方法
1.2.1 3 种物质中酚类物质的提取 取绿茶适量,粉碎,过60 目筛。称取1 g 粉末于离心管中,加入20 mL的沸水,置于85 ℃恒温水浴锅中以60 r/min 转速磁力搅拌避光提取10 min。提取完后冷却至室温,以5000 r/min 转速4 ℃离心10 min,上清液浓缩后定容到10 mL。置于−20 ℃冰箱,密封避光保存。
柑橘去肉留皮,45 ℃烘干24 h,粉碎,过60 目筛。称取1 g 橘皮粉末,加入20 mL 80%甲醇于40 ℃下,功率为60 W 超声波清洗器中提取30 min,以4500 r/min 离心10 min,残渣再加20 mL 相同提取剂重复提取两次,合并上清液,浓缩后定容到50 mL。置于−20 ℃冰箱,密封避光保存。
大豆研磨成粉后过60 目筛,称取1 g 大豆粉末,加入20 mL 的80%甲醇于功率为60 W 的超声波清洗器中60 ℃提取30 min,以4500 r/min 离心10 min,残渣再加20 mL 相同的提取剂重复提取两次,合并上清液并转移至旋转蒸发器60 ℃下浓缩,再定容到50 mL。置于−20 ℃冰箱,密封避光保存。
1.2.2 模拟体外消化 采用Minekus 等[6]所描述的标准化模拟体外消化模型,并稍作修改。提前配制模拟唾液(SSF)、模拟胃液(SGF)和模拟肠液(SIF)。模拟唾液(SSF)、模拟胃液(SGF)和模拟肠液(SIF)由相应的电解质储备液(如表1 所示)、酶、CaCl2和水组成,用6 mol/L HCl 和1 mol/L NaOH 调节SSF、SGF、SIF 的pH 分别为7、3、7。

表1 模拟消化液储备液的制备Table 1 Preparation of stock solutions of simulated digestion fluids
在模拟口腔消化阶段,吸取1.2.1 制成的三种提取物溶液各1 mL 与0.7 mL 模拟口腔消化电解质储备液混合。加入0.1 mLα-淀粉酶溶液(1500 U/mL),再加入5 μL 0.3 mol/L CaCl2和195 μL H2O。涡旋混合后置于恒温水浴摇床中,在100 r/min 和37 ℃中避光振荡2 min。
在模拟胃消化阶段,将口腔阶段的2 mL 混合物溶液不灭酶处理,与1.5 mL 模拟胃液消化电解质储备液混合,再添加0.32 mL 胃蛋白酶(25000 U/mL),1 μL CaCl2(0.3 mol/L),139 μL H2O,通过加入40 μL HCl(1 mol/L)使pH 达到3.0。将混合物涡旋后置于37 ℃水浴摇床(100 r/min)中避光振荡2 h。
在模拟肠消化阶段,将胃阶段的4 mL 混合物不灭酶处理,加入模拟肠液消化电解质储备液(2.2 mL)、胰蛋白酶(800 U/mL)1 mL、胆汁盐(160 mmol/L)0.5 mL、CaCl2(0.3 mol/L)8 μL、0.262 mL H2O、NaOH(1 mol/L)30 μL 混合至pH 7.0。将混合物混合均匀后在37 ℃、100 r/min 的水浴摇床中避光震荡2 h。
每个消化阶段结束后,用1 mol/L HCl 将消化样品迅速酸化至pH2.0,以确保酶的失活和酚类化合物的稳定性。收集各阶段消化液,冷冻干燥置于−80℃冰箱避光保存备用。
1.2.3 HPLC-DAD/ESI-Q-TOF-MS 对三种提取物消化前后酚类物质的成分分析 取方法1.2.1 和1.2.2制成的样品溶液及各阶段消化液经0.22 μm 有机相滤膜过滤,按以下色谱和质谱条件,通过HPLCDAD/ESI-Q-TOF-MS 根据保留时间及扫描光谱对样品中的酚类物质进行定性分析。根据色谱图峰面积对样品模拟体外消化过程中的酚类物质进行定量分析。
色谱条件(如表2 所示):色谱柱:C18(4.6 mm×250 mm,5 μm),流动相:流动相A(0.1%甲酸水溶液)、流动相B(0.1%甲酸乙腈溶液)。

表2 绿茶、橘皮、大豆高效液相色谱条件Table 2 High performance liquid chromatography of green tea,citrus peel and soybean
质谱条件:全扫描模式:负离子,正离子;离子源:电喷雾离子源;离子源温度:350 ℃;全质谱数据的质量范围:(m/z)0~2000;ESI 喷雾电压:5 kV;光电倍增器电压:−1030 V。
消化过程中各阶段酚类物质的损失率(%)

1.2.4 总酚和总黄酮含量的测定 总酚含量测定:采用福林酚[7−8]法。25 μL 质量浓度为31.25、62.5、125、250、500 μg/mL 的没食子酸(Gallic acid,GAE)标品或三种样品提取液中加入125 μL 福林酚试剂于室温条件在96 孔板中反应10 min,再加入125 μL 饱和碳酸钠溶液,室温反应30 min 后用酶标仪于波长765 nm 处测定吸光度。以吸光值为纵坐标,没食子酸质量浓度为横坐标,绘制标准曲线,根据标准曲线y=0.006x+0.1737(R2=0.9945)计算样品中总酚含量。总酚含量以GAE 毫克数等量每克干质量样品原料(mg GAE/g DW)表示。所有样品均测定3 次。
总黄酮含量的测定:采用王丽丽等[9]改良的比色法。25 μL 质量浓度为12.5、25、50、100、125、250 和500 μg/mL 的芦丁(Rutin,RT)标品或三种样品提取液与110 μL 0.066 mmol/L NaNO2溶液在96 孔板中混合反应5 min,再加入15 μL 0.75 mmol/L AlCl3·6H2O 溶液混合反应6 min,最后加入100 μL 0.5 mmol/L NaOH 溶液混匀充分,15 min 后于波长510 nm 处测定吸光度。以吸光值为纵坐标,芦丁质量浓度为横坐标,绘制标准曲线,根据标准曲线y=0.0005x+0.0071(R2=0.9990)计算样品中总黄酮含量。总黄酮含量以RT 当量毫克数等量每克干质量样品原料(mg RT/g DW)表示。所有样品均测定3 次。
1.2.5 抗氧化活性测定 取方法1.2.1 和1.2.2 制成的样品溶液及各阶段消化液。用无水甲醇溶液配制成不同质量浓度的Trolox 标准品溶液。
1.2.5.1 DPPH 自由基清除能力测定 称取一定量DPPH 粉末,用无水甲醇配成0.26 mmol/L DPPH 溶液,超声使粉末完全溶解。取20 μL 样品提取液或Trolox 标准品溶液加入96 孔板中,加入100 μL DPPH 溶液,室温避光震荡反应30 min 后,用酶标仪在517 nm 下测定吸光值[10]。

式中,Ai为样品溶液加DPPH 溶液的样品吸光值;Aj为样品溶液加甲醇的底板吸光值;A0为样品的溶剂加DPPH 溶液的空白吸光值;测定结果以Trolox 为参考标准,结果表示为μmol Trolox(TE)/g干重(μmol Trolox(TE)/g DW)。
1.2.5.2 ABTS 自由基清除能力测定 取7.4 mmol/L ABTS 储备液5 mL 和88 μL 140 mmol/L K2S2O8储备液混匀,避光静置12~14 h,制成ABTS+·工作液。测定前,80%乙醇稀释ABTS+·工作液到吸光值在734 nm 下为0.7 左右,配成ABTS+·稀释液。取20 μL样品提取液或Trolox 标准品溶液在96 孔板中与200 μL ABTS+·稀释液避光震荡反应6 min,用酶标仪在734 nm 下测定吸光值[11−12]。
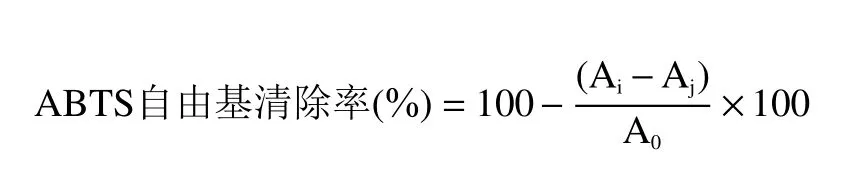
式中,Ai为样品溶液加ABTS+·稀释液的样品吸光值;Aj为样品溶液加80%乙醇的底板吸光值;A0为样品的溶剂加ABTS+·稀释液的空白吸光值。
1.2.5.3 FRAP 铁离子还原能力测定 将300 mmol/L醋酸缓冲液、10 mmol/L TPTZ 在40 mmol/L HCl 溶液和20 mmol/L FeCl3·6H2O 中按10:1:1(v/v/v)比例混合制成FRAP 工作液。向96 孔板中加入10 μL样品提取液或Trolox 标准品溶液与300 μL FRAP工作液室温避光反应6 min。然后在波长593 nm 处测定吸光度[13]。测定结果以Trolox 为标准,结果表示同上。
1.2.5.4 ORAC 氧化自由基吸收能力测定 25 μL 样品提取液或Trolox 标准品溶液置于黑色96 孔板中,加入150 μL FL(Fluorescein sodium,荧光素钠)溶液(8×10−5mmol/L)震荡5 min 后,在37 ℃下孵育30 min,全程避光。孵育完成后迅速加入25 μL AAPH 溶液(153 mmol/L)启动反应。用酶标仪在37 ℃下以激发波长485 nm,发射波长528 nm 记录荧光值,持续120 min,每分钟记录1 次,直到荧光值达到零。将测得的荧光强度折合成初始荧光强度的相对值,把荧光曲线下的面积积分,用样品荧光面积减去空白荧光面积得到净面积,将样品溶液的净面积同Trolox 参照的净面积做比较来评价抗氧化活性[14]。
1.3 数据处理
采用SPSS 17.0 统计分析软件的单因素方差分析(ANOVA)和Duncan 多重比较法进行数据统计(P<0.05),Origin 9.1 软件作图,所有测定重复3 次,结果以平均值±标准差(n=3)表示。
2 结果与分析
2.1 HPLC-DAD/ESI-Q-TOF-MS 对三种提取物消化前后酚类物质的组成成分分析
利用HPLC-DAD/ESI-Q-TOF-MS 方法对体外消化前后绿茶提取物中含量较高的酚类化合物进行分析。根据图1 和表3,确定了表没食子儿茶素(EGC)、(+)-儿茶素、表没食子儿茶素没食子酸酯(EGCG)以及表儿茶素没食子酸酯(ECG)共4 种酚类化合物。化合物1(保留时间17.859 min)的母离子[M-H]-m/z 305.0670 分子式推定为C15H14O7,特征碎片离子包括m/z 167.0947[M-H-C7H6O3]-、m/z 125.0246[M-HC9H10O4]-,根据文献[15]判断为EGC。化合物2(保留时间18.558 min)的母离子[M-H]-m/z 289.0725 分子式推定为C15H14O6,特征碎片离子为m/z 205.0500[M-H-C4H2O2]-,根据文献[15]鉴定为(+)-儿茶素。化合物3(保留时间20.639 min)的母离子[M-H]-m/z 457.0786 分子式推定为C22H18O11,特征碎片离子有m/z 306.0201[M-H-C7H4O4]-、m/z 169.0146[M-HC15H12O6]-、m/z 193.0141[M-H-C13H12O6]-,该化合物为EGCG[15]。化合物4(保留时间23.156 min)的母离子[M-H]-m/z 441.0837 分子式推定为C22H18O10,特征碎片离子有m/z 289.0714[M-H-C7H4O4]-、m/z 125.0240[M-H-C16H12O7]-,该化合物为ECG。

图1 模拟体外消化过程中绿茶提取物中酚类物质的HPLC 图谱变化Fig.1 HPLC chromatogram changes of polyphenols in green tea extract during simulated in vitro digestion

表3 模拟体外消化过程中绿茶提取物中酚类物质的组分变化Table 3 Component changes of polyphenols in green tea extract during simulated in vitro digestion
根据色谱图峰面积对绿茶提取物模拟体外消化过程中的酚类物质进行定量分析,从而得到模拟体外消化中多酚类化合物含量的变化。模拟体外消化过程中各阶段损失率的计算公式见1.2.3。其中,口消化损失率是指经过口腔模拟消化后,酚类物质的损失率,胃消化损失率是指经过口腔和胃模拟消化后,酚类物质的损失率,肠消化损失率是指经过口腔、胃和小肠模拟消化后,酚类物质的损失率。
由表3 可知,与未消化相比,4 种酚类物质在模拟口腔消化阶段含量均降低,损失率大小为:EGCG(52.87%)>ECG(52.33%)>EGC(21.43%)>(+)-儿茶素(7.75%);经过胃消化阶段,相比消化前,4 个酚类物质含量有所降低,其中,EGC 和(+)-儿茶素的损失率相较于其它两个酚类物质较低,这与Wu 等[16]研究绿茶多酚在体外消化过程儿茶素含量的变化结果一致。说明EGC 和(+)-儿茶素比EGCG、ECG 更稳定,Neilson 等[17]也得出相似的结论。在模拟肠液消化阶段,(+)-儿茶素损失率达89.11%,其余三种酚类物质几乎完全降解,这是因为肠道的碱性条件使茶多酚降解,pH 升高、残余溶解氧以及正常消化功能中可能存在的活性氧可能会促进多种反应,包括肠腔中的差向异构化和自氧化。但由于(+)-儿茶素不具有酯基,酚羟基较少,故较其余三种酚类物质更稳定[18]。
由图2 和表4 可知,对橘皮提取物中含量较高的酚类物质进行结构鉴定,确定了柚皮苷、橙皮苷2 种酚类物质。化合物1(保留时间8.926 min)母离子[M-H]-m/z 579.1753 分子式推定为C27H32O14,特征碎片离子有[M-H]-m/z 272.0654,丢失了分子量为308 Da(鼠李糖-葡萄糖苷)的碎片。根据文献[19]判断该化合物为柚皮苷。化合物2(保留时间10.106 min)母离子[M-H]-m/z 609.1863 分子式推定为C28H34O15,特征碎片离子有[M-H]-m/z 302.0760,在二级质谱中丢失了鼠李糖-葡萄糖苷双糖部分。根据文献[17]判断该化合物为橙皮苷。

图2 模拟体外消化过程中橘皮提取物中酚类物质的HPLC 图谱变化Fig.2 HPLC chromatogram changes of polyphenols in citrus peel extract during simulated in vitro digestion
由表4 可知,与未经消化阶段相比,橘皮提取物中柚皮苷和橙皮苷在模拟口腔消化阶段含量降低,损失率分别为5.39%和15.05%。与口腔消化阶段相比,柚皮苷和橙皮苷在经过胃液模拟消化阶段后,损失率降低,峰面积增大,含量升高。这可能是因为在酸性环境和消化酶的作用下酚类物质从基质中释放出来。在肠液消化阶段,柚皮苷肠液消化阶段损失率比口腔阶段损失率增加1 倍,橙皮苷经过口腔、胃、肠消化后稳定性比柚皮苷更差[20]。有研究表明,橘子果汁在体外肠道消化的碱性条件下,55%~65%的黄烷酮会转化成另一种具有不同化学和物理性质的化合物,如查尔酮[20]。
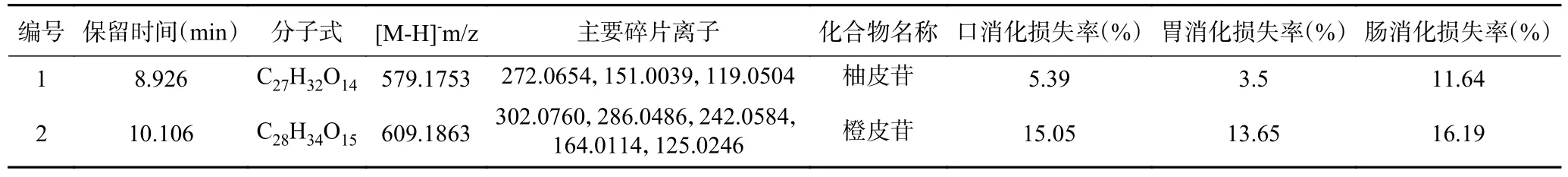
表4 模拟体外消化过程中橘皮提取物中酚类物质的组分变化Table 4 Component changes of polyphenols in citrus peel extract during simulated in vitro digestion
由图3 和表5 可知,参考文献[21]和数据库等,对大豆提取物中含量较高的酚类物质进行结构鉴定,确定了大豆苷、染料木苷、大豆苷元、染料木素。

图3 模拟体外消化过程中大豆提取物中酚类物质的 HPLC图谱变化Fig.3 HPLC chromatogram changes of polyphenols in soybean extract during simulated in vitro digestion
化合物1(保留时间7.137 min)的母离子[M+HCOO]-为461.1116,分子式推定C21H20O9。母离子失去葡萄糖分子产生m/z 为[M-H-glc]-253.0503的碎片离子,结合保留时间、数据库及文献[21]等信息,该化合物鉴定为大豆苷。化合物2(保留时间11.863 min)的母离子[M-H]-为431.0997,分子式推定为C21H20O10,特征碎片离子m/z 为269.0463 为染料木素的结构,根据文献[22],该化合物鉴定为染料木苷。化合物3 保留时间为13.368 min,母离子[M-H]-为253.0518,分子式推定为C15H10O4,特征碎片离子为m/z 180.0585[M-H-C7H4O2]-、m/z 133.0296[M-H-C2H1O1]-,根据文献[22],化合物3 为大豆苷元。化合物4 保留时间为18.940 min,m/z 269.0466[M-H]-,分子式C15H10O5,碎裂分别产生2 个主要的二级离子m/z 133.0300[M-H-C8H6O2]-和107.0141[M-H-C9H6O3]-,根据文献[22],化合物4 为染料木素。
由表5 可知,与未经消化阶段相比,4 个酚类物质的含量经过体外消化均发生不同程度的降低。经过口腔消化阶段,大豆苷元损失率最低(5.45%),染料木苷损失率最高(29.79%),经过胃液消化后,大豆苷元和染料木素较口消化阶段损失率降低,而大豆苷和染料木苷较口消化阶段损失率增加,说明可能在消化过程中大豆苷和染料木苷糖苷键断裂转化为相应的苷元[23]。在模拟肠液消化阶段,4 个酚类物质含量均有所降低,损失率大小:大豆苷元(59.74%)>染料木苷(49.13%)>染料木素(44.94%)>大豆苷(31.22%)。由于异黄酮苷元在水基质中的溶解性差,在肠消化阶段,一部分异黄酮化合物在消化液的水部分胶束化,形成沉淀,导致含量降低。经过模拟体外消化,大豆苷与其余3 个异黄酮相比损失更少,更稳定。这与Walsh 等[24]得到的结论一致。

表5 模拟体外消化过程中大豆提取物中酚类物质的组分变化Table 5 Component changes of polyphenols in soybean extract during simulated in vitro digestion
2.2 模拟体外消化对三种提取物总酚含量的影响
体外消化前后,三种样品总酚含量变化如图4所示。由图4 可知,三种提取物的总酚含量在口腔、胃、肠道消化阶段呈现先降低再升高再降低的趋势。在消化前绿茶提取物总酚含量为(81.84±1.62)mg GAE/g DW;口腔消化后,总酚含量降低为(69.45±2.78)mg GAE/g DW;经胃消化后,总酚含量显著增加(P<0.05),含量达到(96.31±1.37)mg GAE/g DW,较消化前提高了17.68%。在肠消化阶段,总酚含量显著降低(P<0.05),为(33.25±0.55)mg GAE/g DW,较胃消化阶段降低了65.48%(P<0.05),较未消化时降低了59.37%(P<0.05)。茶叶中的主要多酚物质是茶多酚,胃的酸性环境有利于茶多酚的稳定,Record等[25]研究消化对不同品种茶叶的变化发现,在胃消化的酸性条件下,茶叶中儿茶素稳定,而小肠碱性环境下儿茶素含量快速下降。橘皮的总酚含量变化趋势与绿茶一致,在口腔消化阶段下降,经胃肠消化阶段呈现先增加后降低的趋势,徐洪宇等[26]研究石榴皮提取物在体外消化过程中总酚释放量也呈现与本研究相似的趋势。与未消化组相比,大豆提取物经口腔消化后总酚含量显著降低(P<0.05),经胃消化后,大豆提取物的总酚含量显著增加(P<0.05),相比口腔消化阶段升高了1.64 倍。肠消化后总酚含量显著降低(P<0.05)。这与刘国艳等[27]研究芹菜汁在体外消化过程中总酚含量的变化结果一致。

图4 大豆、绿茶、橘皮三种提取物体外消化前后总酚含量变化Fig.4 Changes of total phenolic content of soybean,green tea and citrus peel extracts during simulated in vitro digestion
在胃消化过程中酚类化合物显著增加(P<0.05),主要是由于胃消化过程中的酸性条件和相关的酶导致酚类物质的水解,从而导致酚类含量升高。此外,酸性pH 可能会促进一些多酚-蛋白质络合物从食物中释放出来,从而释放更多的游离多酚。大豆在口、肠消化阶段中总酚含量降低可能是由于异黄酮的溶解度较低,在消化过程中与某些成分结合,形成分子量较大的络合物。这些络合物形成沉淀经离心步骤后弃去,因此酚类含量降低[20]。
2.3 模拟体外消化对三种提取物总黄酮含量的影响
如图5 所示,三种提取物总黄酮含量均在胃消化阶段显著增加(P<0.05),除橘皮在肠消化阶段没有显著变化外,绿茶、大豆在肠消化阶段总黄酮含量显著降低(P<0.05),与总酚含量变化规律一致。经过口腔、胃消化,绿茶总黄酮含量分别增加了14.40%、70.55%;与口腔消化阶段相比,橘皮提取物经过胃消化后,总黄酮含量增加了28.73%;与口腔消化阶段相比,大豆提取物经过胃消化中总黄酮含量增加了1.48 倍;在胃消化过程黄酮含量增加,一方面可能是低pH 降低了分子间的作用力,结合型黄酮发生水解,水解过程中增大物质的溶解性[28]。另一方面,酸性pH 会促进一些与蛋白质络合的黄酮化合物释放出来,黄酮含量增加。在肠消化过程黄酮含量减少是由于大部分黄酮在水解过程中易与O2结合,发生氧化反应。肠道中pH 较高,酚类物质会发生降解,且异黄酮的溶解度较低,与酶等其他成分形成胶束体沉淀后被离心过滤掉,也可能是含量降低的原因之一。

图5 大豆、绿茶、橘皮三种提取物体外消化前后总黄酮含量变化Fig.5 Changes of total flavonoids content of soybean,green tea and citrus peel extracts during simulated in vitro digestion
Neilson 等[17]发现,在体外消化实验中,酸性环境对儿茶素几乎没影响,而中性或碱性环境下极不稳定,在小肠环境中,儿茶素类衍生物发生降解,损失量是胃环境中的10~20 倍。柑橘黄酮多以糖苷的形式存在在肠消化阶段,糖苷中的酯键可能在肠消化阶段被胰酶水解,因而黄酮含量在肠消化过程中降低。经过肠消化,三种提取物的总黄酮含量显著降低,黄酮物质的含量降幅达70%以上,这与从彦丽等[29]研究体外模拟胃肠消化过程中柑橘总黄酮含量变化的结果一致。
2.4 模拟体外消化对三种提取物抗氧化活性的影响
本研究选择ABTS、DPPH、FRAP、ORAC 四种基于不同机理的抗氧化能力分析方法,通过不同评价方法全面地评估三种提取物的抗氧化能力水平。
如表6 所示,在四种抗氧化评价方法中,绿茶表现出较高的抗氧化活性。ABTS+·的清除能力表现为未消化>胃>口腔>小肠。FRAP 抗氧化方法和ORAC抗氧化方法与ABTS+·的清除能力规律一致。Rusak等[30]在研究抹茶和绿茶提取物在体外消化过程中的抗氧化活性变化时,也发现与本实验一致的规律。绿茶的抗氧化能力与其总酚含量之间强相关,说明绿茶中的酚类物质是影响其抗氧化能力的主要成分。从大豆提取物消化前后抗氧化能力的变化可见,除了ABTS+·清除能力和FRAP 抗氧化能力在口腔阶段显著降低(P<0.05)外,其DPPH、ORAC 抗氧化能力在口腔和胃消化阶段显著升高(P<0.05),在肠消化阶段显著降低(P<0.05)。这可能是因为大豆中的游离酚在口腔消化过程中溶出而释放,所以在口腔消化阶段抗氧化活性升高。结合酚经胃消化酶的作用后释放,导致抗氧化能力升高。此外,在消化过程中,带有糖苷的酚类物质会水解为苷元部分,后者抗氧化能力更高,这也可能是经消化后抗氧化能力提高的原因之一[31]。从橘皮提取液消化前后抗氧化能力变化可见,除在肠消化阶段ORAC 值显著升高(P<0.05),ABTS、FRAP 值在体外消化阶段和总酚含量变化一致。有研究发现[32],柚皮苷和橙皮苷的结构会随pH 变化发生改变,导致肠消化阶段抗氧化能力下降。

表6 三种提取物体外消化前后的抗氧化活性变化Table 6 Changes of antioxidant activities of three extracts during simulated in vitro digestion
化合物的抗氧化能力与其所含酚类物质结构的稳定性是密切相关的。绿茶多酚的抗氧化活性主要归功于芳香环和羟基的结合,这些羟基组成了它们的化学结构,并通过这些羟基与脂质自由基结合和中和。一般情况下,直接连接到苯环碳原子(3,5,7 和3',4'-二羟基取代形式)的-OH 基团的存在决定了酚类物质的抗氧化作用。羟基基团在黄酮化合物中的数量和位置对其抗氧化活性会产生较大影响[33]。黄烷醇类化合物中C 环上的3-OH 在抗氧化活性中起着重要的作用,3-OH 的存在显著提高了抗氧化活性,这是黄烷醇抗氧化活性强的重要原因之一。异黄酮由于C 环2,3 双键及B 环上缺乏邻苯二酚结构降低了抗氧化活性[34]。此外,低溶解度也是影响其抗氧化活性的原因之一。
3 结论
本实验采用模拟体外消化模型,研究了黄烷醇、黄酮醇、异黄酮类化合物中具有代表性的食物(绿茶、橘皮、大豆)在口腔、胃、小肠消化过程中主要酚类物质含量、总酚含量、总黄酮含量及抗氧化活性的变化规律。发现绿茶提取物中酚类化合物经过模拟体外消化后最不稳定,除了 (+)-儿茶素之外其余酚类物质几乎降解完全。橘皮提取物中酚类化合物相较于绿茶和大豆提取物更稳定,大豆提取物中酚类化合物稳定性较差。在抗氧化能力方面,绿茶的抗氧化能力最强,其次是柑橘皮,大豆的抗氧化能力最弱。本研究结果为研究富含黄烷醇、黄酮醇、异黄酮类化合物的食品研究提供一定的理论依据和科学指导。同时也为绿茶、橘皮、大豆提取物在保健食品等领域的开发及综合开发活性物质应用提供了科学依据。但绿茶、橘皮、大豆提取物中的化学成分因其自身性质差异在模拟口胃肠道环境中表现出不同的稳定性,其结构变化、降解途径、代谢产物及各成分之间是否存在相互作用仍值得进一步探究。

