HPLC 法分别测定大苞荆芥中2 种黄酮及其糖苷的含量
帕尔哈提·多力坤,买买提江·阿布都瓦克,朱金芳, ,刘 烨,买尔当·艾尼瓦尔
(1.新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052;2.新疆维吾尔医学专科学校药学系,新疆和田 848000)
大苞荆芥为唇形科(Labiatae)荆芥属大苞荆芥(Nepeta bracteataBenth)的干燥全草,维吾尔名为“祖发印地”,收载于《阿力卡农》《依合提亚拉提拜地依》《买克散艾地维》等古籍中,其生干生热、温肺平喘、祛寒止咳、燥湿祛痰、发汗解毒、消炎退肿[1−2]。《维吾尔药志》中记载大苞荆芥全草具有止咳平喘、清热利湿的作用,用于治疗气管炎、咳嗽气喘、感冒发烧等症[3]。由于荆芥属植物营养丰富、气味独特,常被用作食品调味剂和保鲜剂使用[4−5]。但目前尚无专门针对大苞荆芥的质量研究报道,大多数文章都是将大苞荆芥作为神香草或硬尖神香草的混淆品进行性状鉴别[6]、薄层色谱鉴别[7]、HPLC 法测定齐墩果酸与熊果酸含量及指纹图谱的对比研究[8]。因此,建立大苞荆芥的含量测定方法,进而制定其质量标准,对于大苞荆芥原料质量的控制及其在保健食品中的应用具有重要的现实意义。
虽然大苞荆芥在民间使用较为广泛,但国内外有关大苞荆芥的研究报道较少,张萌等[9]报道大苞荆芥总多糖对哮喘大鼠有明显的干预效果,其作用主要表现在大苞荆芥总多糖对Th1/Th2 细胞相关细胞因子(IFN-γ和IL-4)失衡等免疫学改变的逆转作用以及对IL-6 和IL-17 等炎症细胞因子表达的抑制;阿不都热依木·玉苏甫等[2]研究发现,大苞荆芥总黄酮具有抗菌消炎、止咳、祛痰、平喘作用。由文献可知,大苞荆芥的活性成分应该为多糖和黄酮类成分,但大苞荆芥总多糖与大多数植物多糖一样,主要通过调节机体免疫系统而发挥作用,其特征性不强。而黄酮类化合物大多数具有显著的消炎、抗过敏、抗菌、抗病毒、止咳、祛痰、抗自由基氧化等作用,并广泛应用于食品药品中[10−11],与大苞荆芥的功能作用吻合。故本实验选择黄酮类成分作为大苞荆芥含量测定的指标成分。ABDUWAKI 等[12]从大苞荆芥总黄酮中分离得到木犀草素、芹菜素、芹菜素-7-O-葡萄糖醛酸苷(Apigenin-7-O-glucuronide,AGCRP)、木犀草素-7-O-β-D-葡萄糖醛酸苷(Luteolin-7-O-β-Dglucuronide,LGCRP)、木犀草素-7-0-β-半乳糖苷、香叶木素-7-0-β-D-葡萄糖苷等多种黄酮及黄酮苷类成分。本课题组通过前期预实验发现大苞荆芥中木犀草素、芹菜素、LGCRP、AGCRP 含量相对较高且分离度较好,故选择定量测定以上黄酮及其糖苷类成分。另外,由于大苞荆芥中木犀草素、芹菜素与其糖苷的性质、含量相差较为悬殊,且出峰时间间隔较远,若在一个条件下同时测定四个成分,则会导致有效成分提取不充分、单次测定耗时较长、峰形及分离度不好等问题,故采用两套方法分别测定木犀草素、芹菜素及LGCRP、AGCRP 的含量。
1 材料与方法
1.1 材料与仪器
15 批大苞荆芥药材生产批号分别为S1(20151029)、S2(20170830)、S3(20171030)、S4(20181211)、S5(20190117)、S6(20190207)、S7(20190523)、S8(20191119)、S9(20191209)、S10(20200507)、S11(20200526)、S12(20200530)、S13(20200601)、S14(20200715)、S15(20200826)S3~S9 购自新疆新绿宝药业有限公司,其他均购自新疆麦迪森维药有限公司。15 批药材经新疆维吾尔自治区药品检验研究院艾买提江·阿依甫别克副主任药师鉴定为唇形科荆芥属大苞荆芥的干燥全草。木犀草素 中国食品药品鉴定研究院,批号:111520-200504,纯度≥98%;芹菜素 上海源叶生物科技有限公司,批号:TO4S8F43072,纯度≥98%;LGCRP中国食品药品鉴定研究院,批号:111968-201602,纯度97.7%;AGCRP 广州隽沐生物科技股份有限公司,批号:DM21032005,纯度99.48%;乙腈 色谱纯,Sigma 公司;所有试剂如未特殊标明均为分析纯;水为纯净水。
AL204-IC 型电子天平 梅特勒-托利多仪器上海有限公司;KQ5200 型超声波清洗仪 昆山市超声仪器有限公司;TG16B 型高速离心机 盐城市凯特实验仪器有限公司;LC-16 高效液相色谱仪 苏州市岛津仪器有限公司。
1.2 木犀草素、芹菜素含量测定方法学研究
1.2.1 对照品溶液的制备 精密称取木犀草素11.1 mg、芹菜素10.9 mg,分别置于10 mL 量瓶中,加甲醇定容至刻度,分别配成浓度为1.11、1.09 mg/mL的对照品储备液。
1.2.2 供试品溶液的制备 称取大苞荆芥药材(粉粹,过20 目筛,制成粗粉)约2.00 g,置于50 mL 具塞锥形瓶中,加70%乙醇,摇匀,称定重量,固定超声波功率为300 W,超声提取30 min,用70%乙醇补足减失重量,摇匀,过滤,离心10 min(14000 r/min),上清液作为供试品溶液待测。
1.2.3 色谱条件 色谱柱:InertSustion C18柱(250 mm×4.6 mm,5 μm);流动相A:乙腈溶液,流动相B:0.1%磷酸水溶液(0.1:99.9,v/v)[13−14];流速:1.0 mL/min;检测波长:347 nm;柱温30 ℃;进样量20 μL,按表1 洗脱程序进行洗脱[15−16]。
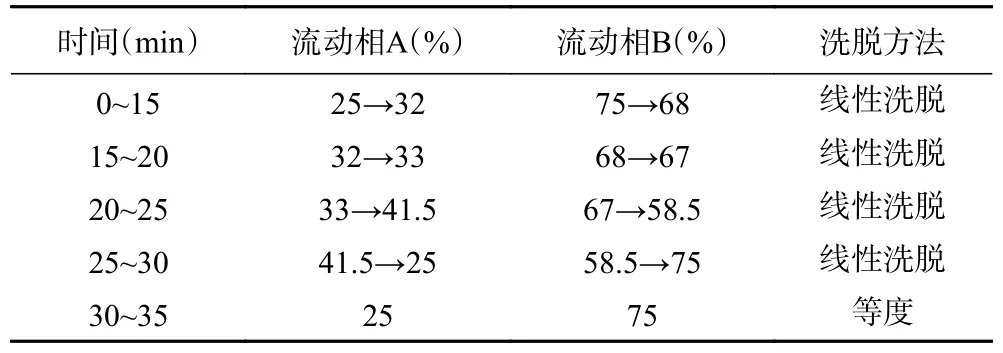
表1 洗脱程序Table 1 Elution program
1.2.4 样品前处理方法的考察
1.2.4.1 提取溶剂的考察 称取同一批大苞荆芥药材粉末,分为6 组,每组3 份,每份约2.00 g,按“1.2.2”项下方法制备供试品溶液,每组分别加入甲醇、70%甲醇、50%甲醇、无水乙醇、70%乙醇、50%乙醇溶剂[17−19],使用液相色谱仪测定,并按公式(1)计算木犀草素、芹菜素含量。

式中:C 表示供试品浓度,μg/mL,由峰面积代入标准曲线计算得出;D 表示溶液稀释体积,mL;m 表示药材取样量,g。
1.2.4.2 溶剂加入量的考察 称取同一批大苞荆芥药材粉末,分为5 组,每组3 份,每份约2.00 g,按“1.2.2”项下方法制备供试品溶液,每组分别加入70%乙醇20、30、40、50、60 mL,使用液相色谱仪测定[20],并按公式(1)计算木犀草素、芹菜素含量。
1.2.4.3 提取时间的考察 称取同一批大苞荆芥药材粉末,分为5 组,每组3 份,每份约2.00 g,按“1.2.2”项下方法制备供试品溶液,每组分别超声提取10、20、30、40、50 min,使用液相色谱仪测定[21−23],并按公式(1)计算木犀草素、芹菜素含量。
1.2.5 方法学考察
1.2.5.1 系统适用性试验 在上述色谱条件下,取各对照品、供试品及溶剂空白溶剂依次进样,检测HPLC 条件是否符合要求。
1.2.5.2 线性关系、检出限及定量限 分别精密吸取对照品储备液用70%乙醇制成含木犀草素3.080~12.321 μg/mL,芹菜素4.753~19.010 μg/mL 的混合对照品溶液,以对照品浓度X(μg/mL)为横坐标,峰面积Y 为纵坐标,分别计算对照品木犀草素、芹菜素的线性回归方程和线性范围,按信噪比(S/N)约为3 计算检出限(LOD),以S/N 约为10 计算定量限(LOQ)。
1.2.5.3 精密度试验 吸取同一对照品连续进样5 次,在“1.2.3”色谱条件下测定峰面积并计算RSD 值。
1.2.5.4 稳定性试验 称取同一批大苞荆芥药材粉末参照“1.2.2”的方法进行制备,于0、2、4、6、8、12、18、24 h 进样并测定峰面积,计算RSD 值。
1.2.5.5 重复性试验 称取同一批大苞荆芥药材粉末6 份照参“1.2.2”的方法进行制备,于“1.2.3”色谱条件进样检测,确定峰面积并计算含量与RSD 值。
1.2.5.6 加标回收率试验 精密称取已知含量样品约1.00 g,按低、中、高浓度分别加入木犀草素、芹菜素对照品储备液,置于50 mL 具塞锥形瓶中,加70%乙醇,摇匀,称定重量,固定超声波功率为300 W,超声提取30 min,用70%乙醇补足减失重量,摇匀,过滤,离心10 min(14000 r/min),进样测定,按供试品处理方法得溶液,记录峰面积,并按公式(2)计算加标回收率。

1.2.5.7 大苞荆芥药材中木犀草素、芹菜素含量测定称取15 批大苞荆芥药材粉末制成供试品溶液,并按“1.2.3”色谱条件进样检测,并按公式(1)计算各批次大苞荆芥中木犀草素、芹菜素的含量。
1.3 LGCRP、AGCRP 含量测定方法学研究
1.3.1 对照品溶液的制备 精密称取LGCRP 11.5 mg、AGCRP 11.6 mg,分别置于10 mL 量瓶中,加甲醇定容至刻度,分别配成浓度为1.15、1.16 mg/mL的对照品储备液。
1.3.2 供试品溶液的制备 称取同一批大苞荆芥药材粉末0.25 g,置于50 mL 具塞锥形瓶中,加50%甲醇,摇匀,称定重量,固定超声波功率为300 W,超声提取20 min,用50%甲醇补足减失重量,摇匀,过滤,离心10 min(14000 r/min)上清液作为供试品溶液待测。
1.3.3 色谱条件 按照“1.2.3”项的方法,按表2 洗脱程序进行洗脱[24−27]。
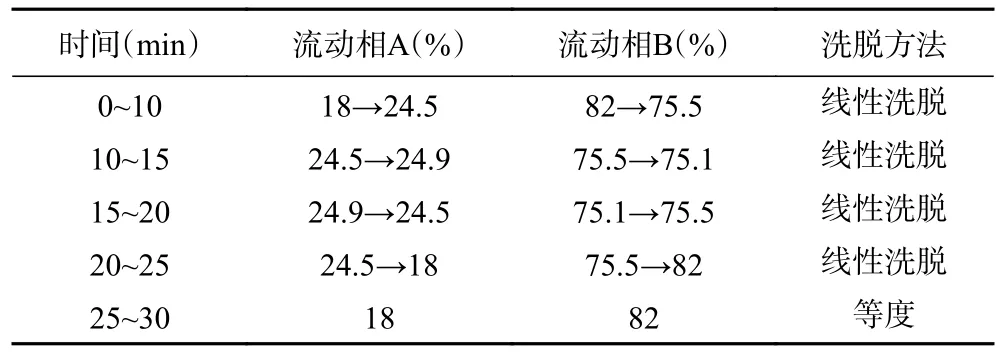
表2 洗脱程序Table 2 Elution program
1.3.4 样品前处理方法的考察
1.3.4.1 提取溶剂的考察 称取同一批大苞荆芥药材粉末,分为6 组,每组3 份,每份约0.25 g,同“1.2.4.1”的方法制备供试品溶液,并按1.2.4.1 方法,注入液相色谱仪测定,并按公式(1)计算LGCRP、AGCRP 含量。
1.3.4.2 溶剂加入量的考察 称取同一批大苞荆芥药材粉末,分为5 组,每组3 份,每份约0.25 g,同“1.2.4.2”的方法制备并注入液相色谱仪测定,并按公式(1)计算LGCRP、AGCRP 含量。
1.3.4.3 提取时间的考察 称取同一批大苞荆芥药材粉末,分为5 组,每组3 份,每份约0.25 g,同“1.2.4.3”的方法制备并注入液相色谱仪测定,并按公式(1)计算LGCRP、AGCRP 含量。
1.3.5 方法学考察
1.3.5.1 系统适用性试验 在上述色谱条件下,取各对照品、供试品及溶剂空白溶剂依次进样,检测HPLC 条件是否符合要求。
1.3.5.2 线性关系、检出限及定量限 分别精密吸取对照品储备液用50%甲醇制成含LGCRP 5.67~22.68 μg/mL,AGCRP 9.97~39.86 μg/mL 的混合对照品溶液二,以对照品浓度X(μg/mL)为横坐标,峰面积Y 为纵坐标,分计算到对照品LGCRP、AGCRP的线性回归方程和线性范围,按信噪比(S/N)约为3 计算检测限(LOD),以S/N 约为10 计算定量限(LOQ)。
1.3.5.3 精密度试验、稳定性试验、重复性试验 方法同“1.2.5”。
1.3.5.4 加标回收率试验 分别精密称取已知含量样品约0.125 g,按低、中、高浓度分别加入LGCRP、AGCRP 对照品储备液,置于50 mL 具塞锥形瓶中,加50%甲醇,摇匀,称定重量,固定超声波功率为300 W,超声提取20 min,用50%甲醇补足减失重量,摇匀,过滤,离心10 min(14000 r/min),进样测定,按供试品处理方法得溶液,记录峰面积,并按公式(2)计算加样回收率。
1.3.5.5 大苞荆芥药材中LGCRP、AGCRP 含量测定 称取15 批大苞荆芥药材粉末制成供试品溶液,采用“1.3.3”色谱条件进样检测,并按公式(1)计算各批次大苞荆芥中LGCRP、AGCRP 的含量。
1.4 数据处理
通过与SHIMADZU LC-16 仪器配套的LabSolutions 色谱处理软件完成数据采集分析,采用Excel、Origin 2018 软件进行图形绘制及处理,每组重复3 次,结果用±SD 表示。
2 结果与分析
2.1 木犀草素、芹菜素含量测定结果
2.1.1 样品前处理方法的考察 考虑木犀草素、芹菜素具有易溶于甲醇及乙醇的水溶液的特点[28]。本实验对6 种提取溶剂进行考察。结果显示,随着甲醇或乙醇在水中比例的增加,木犀草素、芹菜素的含量呈上升趋势,用70%乙醇提取时木犀草素、芹菜素含量均最高,但用纯甲醇及无水乙醇提取时木犀草素、芹菜素含量均最低,因木犀草素、芹菜素属于极性化合物,根据中药化学成分与溶剂间“极性相似相容”的原理,选择对有效成分溶解度大的溶剂作为提取溶剂[29],因此,选择70%乙醇作为提取溶剂,结果见图1a。
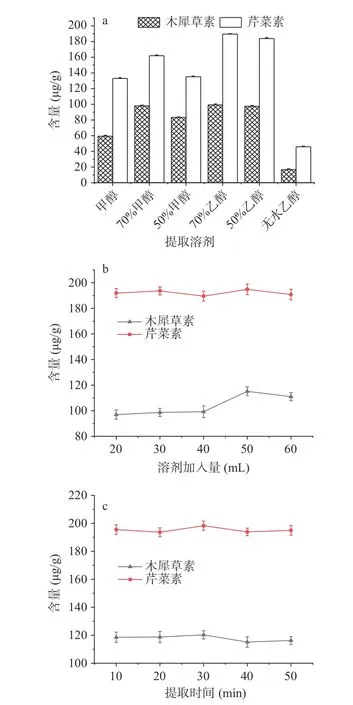
图1 不同提取条件对大苞荆芥中木犀草素、芹菜素含量的影响(n=3)Fig.1 Effects of different extraction conditions on the content of luteolin and apigenin in Nepeta bracteata (n=3)
图1b 中可以看出,随着溶剂加入量的增加,木犀草素、芹菜素的含量呈上升趋势,当加入量为50 mL时,木犀草素、芹菜素的含量均达到最高,但再增加到60 mL 时,其含量略有下降,因为溶剂的溶解性能、溶解能力,通过溶剂的溶解度来确定,合适的溶剂用量能提高有效成分的溶解度,而溶解度达到全溶解状态后,再增加溶剂用量时会降解有效成成分的含量。说明加入50 mL 溶剂就能充分提取药材中2 种黄酮,故确定溶剂加入量为50 mL。
由于超声提取比常规提取效率高并节省时间,通常药材进行超声处理20~45 min 即可获得较好的提取效果,图1c 显示,提取时间从10 min 增加到20 min 时,木犀草素、芹菜素含量未发生明显变化,到30 min 时其含量有所提高,而提取时间增加到40 min 之后其含量开始下降,这是因为超声提取可使生物分子解聚,使细胞壁上的有效成分更快地溶解于溶剂中,一般提取时间在20~40 min 即可获得最佳提取效率,而提取时间过长影响提取效率会降低有效成分的含量,故选择超声提取时间为30 min。
2.1.2 方法学考察
2.1.2.1 系统适应性试验 确定色谱条件时参考了多篇测定木犀草素、芹菜素含量的文献[30−34]。最终确定色谱条件为乙腈溶液:0.1%磷酸水溶液为流动相,流速1.0 mL/min,检测波长347 nm。此条件下色谱峰出峰时间快且对称性好,分离度>1.5,理论塔板数>5000,空白溶剂无干扰,符合实验要求。结果见图2。

图2 木犀草素和芹菜素系统适用性试验HPLC 图谱Fig.2 System suitability test HPLC pattern of luteolin and apigenin
2.1.2.2 线性关系、检出限及定量限 结果表明,木犀草素和芹菜素浓度分别在3.080~12.321、4.753~19.010 μg/mL 范围内与峰面积具有良好的线性关系,相关系数达到0.9993 以上。木犀草素和芹菜素的LOD 分别为0.11 和0.08 μg/mL,木犀草素和芹菜素的LOQ 分别为0.35 和0.23 μg/mL。结果见表3。

表3 木犀草素和芹菜素的回归方程、相关系数、线性范围、检出限及定量限Table 3 Regression equation,correlation coefficient,linear range,limit of detection and limit of quantification of luteolin and apigenin
2.1.2.3 精密度试验 取混合对照品溶液按色谱条件连续进样6 次,记录峰面积。求得木犀草素、芹菜素峰面积的RSD 值分别为0.62%、0.73%,表明仪器的精密度良好。
2.1.2.4 稳定性试验 取同一供试品溶液,分别于0、2、4、6、8、12、18、24 h 按色谱条件进样检测峰面积。求得木犀草素、芹菜素含量的RSD 值分别为0.90%、1.33%,表明制备的供试品溶液在24 h 之内较为稳定。
2.1.2.5 重复性试验 取同一大苞荆芥药材,平行制备6 份供试品溶液,进样测定峰面积。求得木犀草素、芹菜素平均含量分别为109.825、170.621 μg/g,RSD值分别为1.39%、1.39%,说明该方法重复性良好。
2.1.2.6 加标回收率试验 木犀草素、芹菜素加标回收率范围分别为98.8%~102.8%、92.9%~98.1%,RSD值范围分别为0.97%~2.25%、0.24%~2.94%,表明方法准确度高,结果见表4。
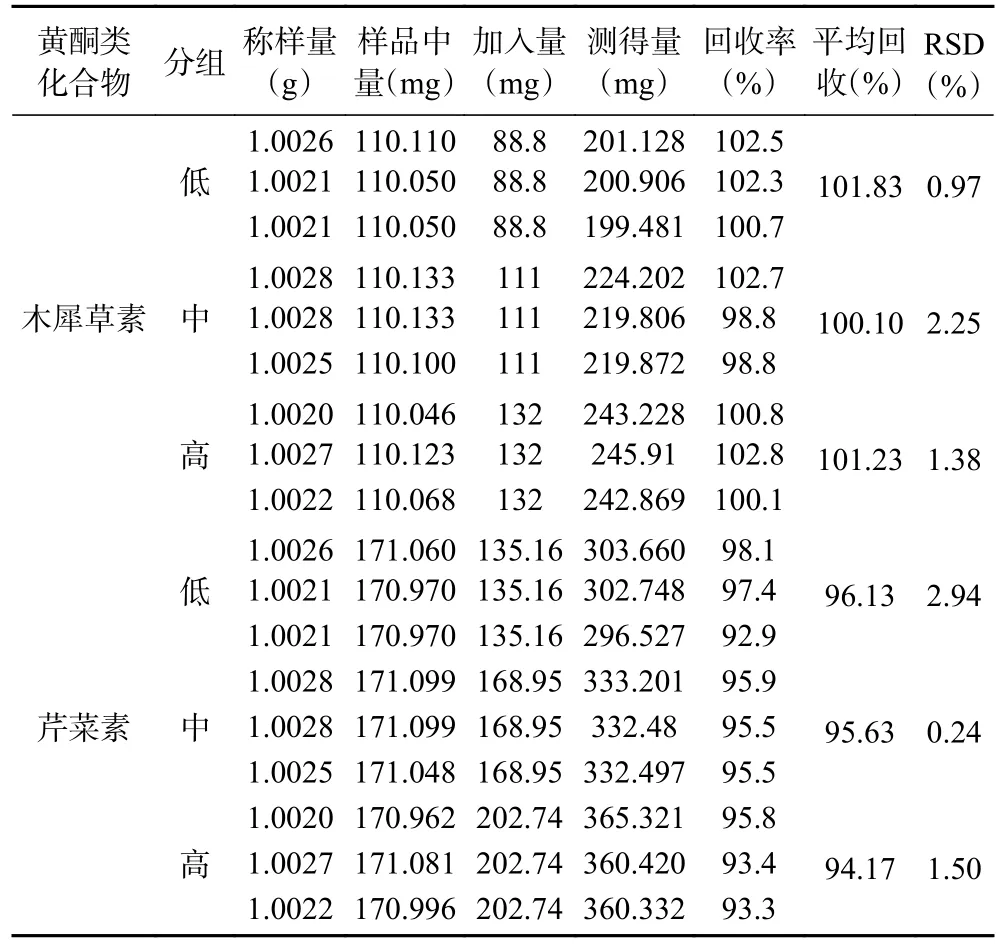
表4 加标回收率试验结果(n=3)Table 4 Standard recovery test results (n=3)
2.2 LGCRP、AGCRP 含量测定结果
2.2.1 样品前处理方法的考察 本实验对6 种提取溶剂进行考察。结果显示,使用50%甲醇或70%乙醇提取时,LGCRP、AGCRP 的含量均较高,且用50%甲醇提取LGCRP、AGCRP 含量均最高,但用纯甲醇及无水乙醇提取时LGCRP、AGCRP 含量均最低,因此,选择50%甲醇作为提取溶剂,结果见图3a。
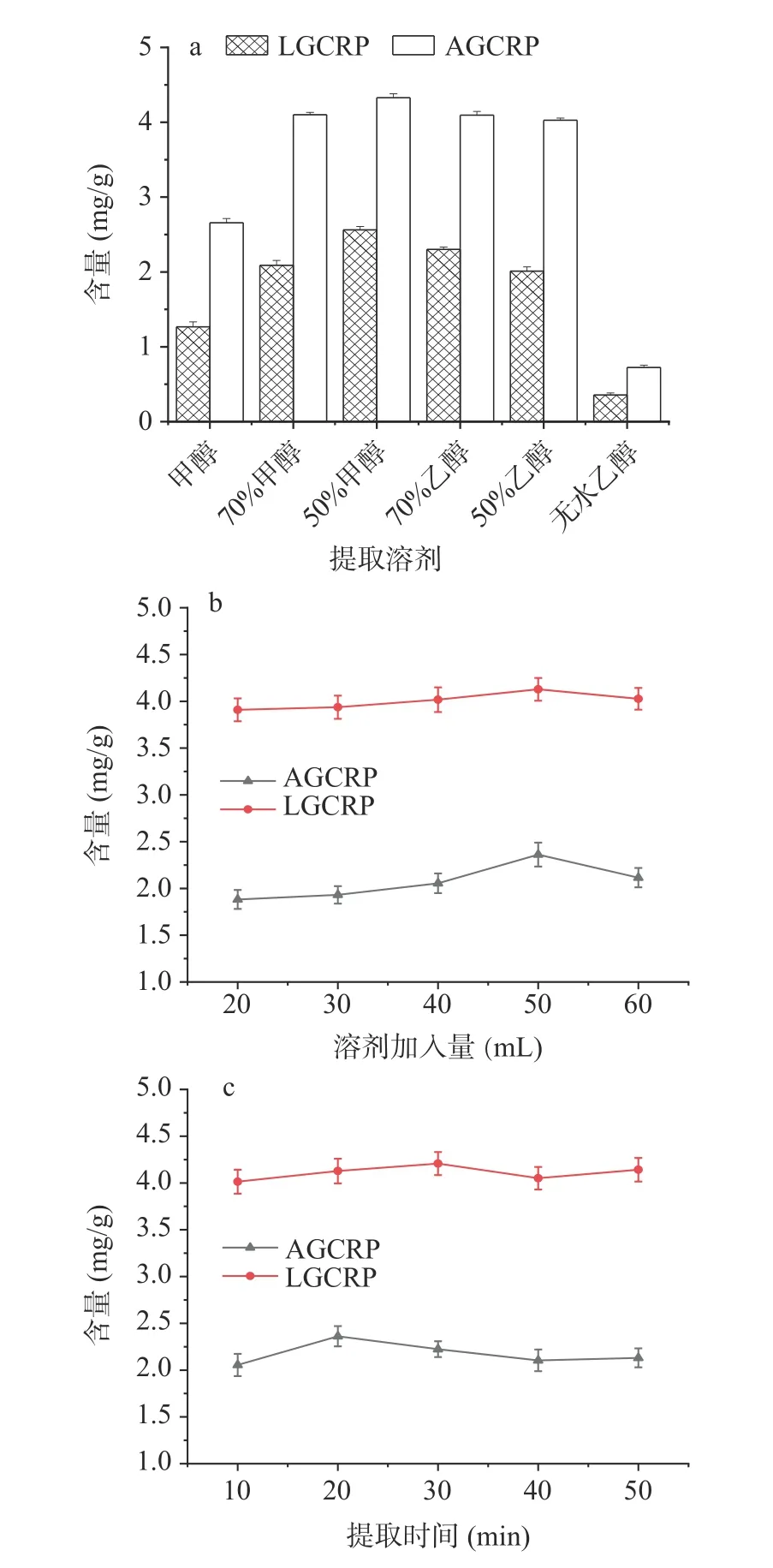
图3 不同提取条件对大苞荆芥中LGCRP、AGCRP 含量的影响(n=3)Fig.3 Effects of different extraction conditions on the content of LGCRP and AGCRP in Nepeta bracteata (n=3)
图3b 中可以看出,随着溶剂加入量的增加,LGCRP、AGCRP 的含量呈上升趋势,当加入量为50 mL 时,LGCRP、AGCRP 的含量均达到最高,但再增加到60 mL 时,其含量明显下降,说明加入50 mL溶剂能充分提取药材中2 种黄酮苷,故确定溶剂加入量为50 mL。
图3c 显示,与提取10 min 相比,提取时间为20 min 时LGCRP、AGCRP 含量均明显提高,而提取时间增加到30 min 之后其含量明显下降,故选择超声提取时间为20 min。
2.2.2 方法学考察
2.2.2.1 系统适用性试验 最终确定色谱条件为乙腈溶液:0.1%磷酸水溶液为流动相,流速1.0 mL/min,检测波长347 nm。此条件下色谱峰出峰时间快且对称性好,分离度>1.5,理论塔板数>5000,空白溶剂无干扰,符合实验要求。结果见图4。

图4 LGCRP、AGCRP 系统适用性试验HPLC 图谱Fig.4 System suitability test HPLC pattern of LGCRP and AGCRP
2.2.2.2 线性关系、检出限及定量限 结果表明,LGCRP 和AGCRP 浓度分别在5.67~22.68、9.97~39.86 μg/mL 范围内与峰面积具有良好的线性关系,相关系数达到0.9997 以上。LGCRP 和AGCRP 的LOD 均为0.03 μg/mL,LGCRP 和AGCRP 的LOQ分别为0.09 和0.10 μg/mL。结果见表5。

表5 LGCRP、AGCRP 的回归方程、相关系数、线性范围、检出限及定量限Table 5 Regression equation,correlation coefficient,linear range,limit of detection and limit of quantification of LGCRP,AGCRP
2.2.2.3 精密度试验取 混合对照品溶液按色谱条件连续进样6 次,记录峰面积。求得LGCRP、AGCRP峰面积的RSD 值分别为0.67%、0.83%,表明该方法精密度良好。
2.2.2.4 稳定性试验 取同一供试品溶液,分别于0、2、4、6、8、12、18、24 h 按色谱条件进样检测峰面积。求得LGCRP、AGCRP 含量的RSD 值分别为1.23%、1.07%,表明制备的供试品溶液在24 h 之内较为稳定。
2.2.2.5 重复性试验 取同一大苞荆芥药材,平行制备6 份供试品溶液,进样测定峰面积。求得LGCRP、AGCRP 含量分别为2.147、4.194 mg/g 的RSD 值分别为1.10%、0.79%,说明该方法重复性良好。
2.2.2.6 加标回收率试验 LGCRP、AGCRP 加标回收率范围分别为93.9%~97.9%、93.7%~97.3%,RSD值范围分别为1.01%~1.65%、1.12%~1.74%,表明方法准确度高,结果见表6。
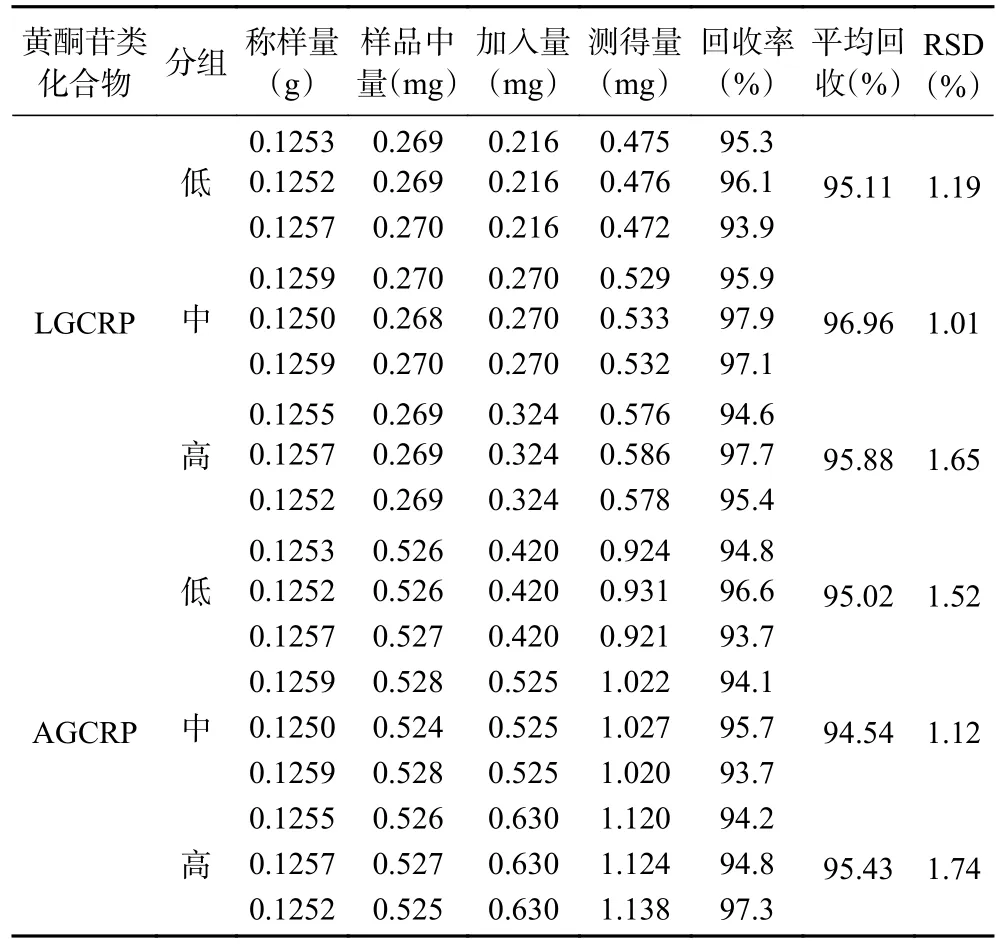
表6 加标回收率试验结果(n=3)Table 6 Standard recovery test results (n=3)
2.2.3 样品含量测定 检测15 批大苞荆芥中的木犀草素、芹菜素、LGCRP、AGCRP 含量,结果见表7,15 批样品木犀草素含量为63.501~126.337 μg/g,芹菜素含量为44.964~321.198 μg/g,LGCRP 含量为1.556~3.051 mg/g,AGCRP 含量为2.533~7.154 mg/g。建议大苞荆芥药材中木犀草素、芹菜素、LGCRP、AGCRP 的含量限度分别不得少于60.00 μg/g、40.00 μg/g、1.50 mg/g、2.50 mg/g。
表7 样品含量测定结果(n=3,±SD)Table 7 Sample content determination results (n=3,±SD)
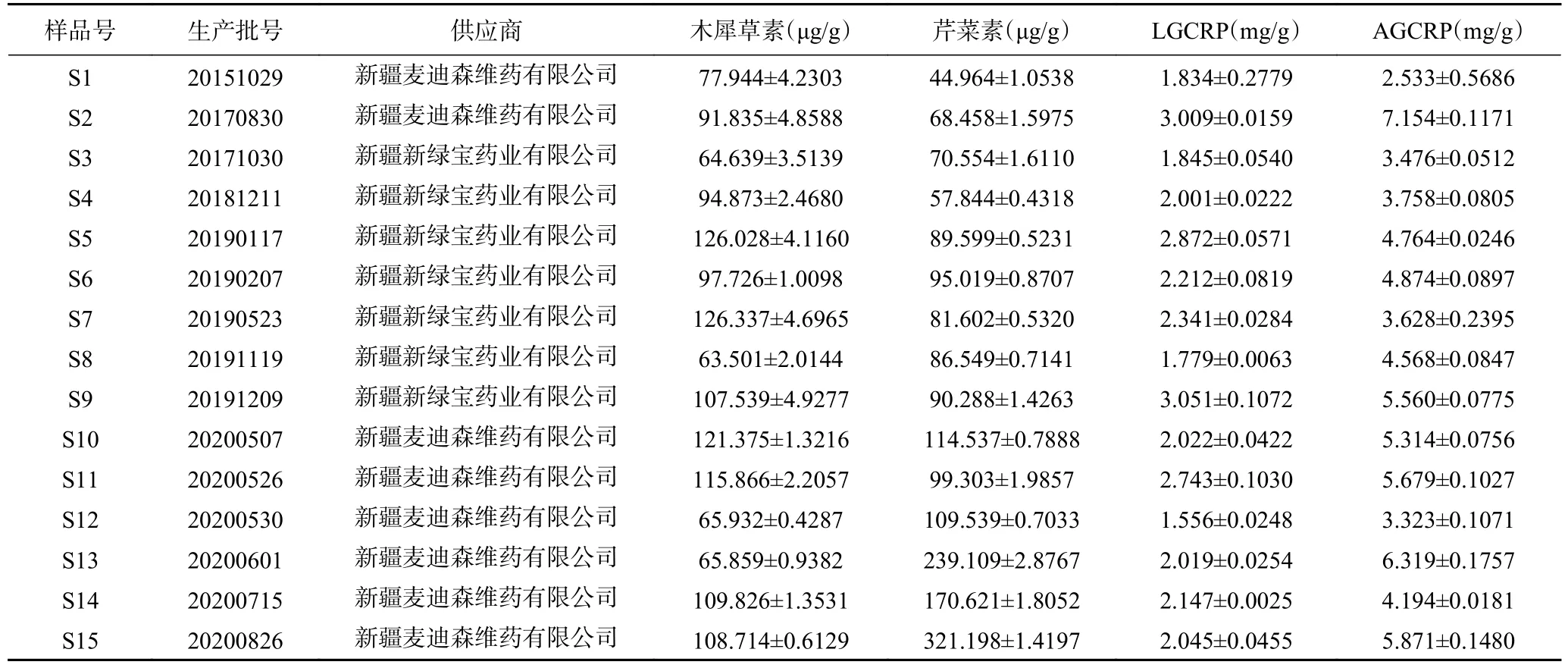
表7 样品含量测定结果(n=3,±SD)Table 7 Sample content determination results (n=3,±SD)
不同生产批号大苞荆芥中芹菜素含量差异较大,最高含量与最低含量相差近7 倍。且大苞荆芥中芹菜素含量随储藏时间的延长存在降低的趋势,与文献报道一致。丁春光等[35]认为不同储藏年限广陈皮黄酮类化合物含量随储藏时间延长而降低。含量降低的原因比较复杂,既可能与药材储藏过程中相关酶的活性变化有关[36],也可能与药材挥发性成分的散失有关[37]。
3 结论
本实验优化了提取溶剂、溶剂加入量、提取时间等药材前处理方法,并通过系统适用性试验,线性关系、检出限及定量限考察,精密度、重复性、稳定性及加标回收率试验进行了含量测定方法学验证,建立了HPLC 法分别定量测定大苞荆芥中木犀草素、芹菜素及其糖苷木犀草素-7-O-β-D-葡萄糖醛酸苷(LGCRP)、芹菜素-7-O-葡萄糖醛酸苷(AGCRP)的方法。结果显示木犀草素、芹菜素和LGCRP、AGCRP分别在3.080~12.321、4.753~19.010、5.67~22.68、9.97~39.86 μg/mL 范围内与各自峰面积呈良好的线性关系,r值均大于0.9993;检出限分别为0.11、0.08、0.03、0.03 μg/mL,定量限分别为0.35、0.23、0.09、0.10 μg/mL,精密度、稳定性和重复性均良好,加标回收率范围分别为98.8%~102.8%、92.9%~98.1%、93.9%~97.9%、93.7%~97.3%。表明两套方法操作简便、灵敏度高、稳定性好、准确度高、适用性强,可用于大苞荆芥中2 个黄酮及其糖苷类成分的定量测定,为大苞荆芥药材质量的控制及其在成方制剂中的应用奠定了基础。

