FIB、FAR和血清肿瘤标记物联合检测在ESCC患者诊断及其临床进展中的意义
崔雯瑄,焦文静,赵 薇,杜彦艳,田 国,张金艳,马 鸣,
(1.河北医科大学第四医院检验科,河北石家庄 050011;2.河北医科大学第四医院病案室,河北 石家庄 050011)
食管癌是世界范围内常见的消化系统恶性肿瘤之一,发病率居恶性肿瘤第7位、死亡率居第6位、总体5年生存率不足20%。我国是食管癌高发区,食管癌患者中大部分病理类型为食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC),其发病率和死亡率均远高于世界平均水平,防控形势较为严峻[1-2]。
ESCC 诊断方法主要有胃镜检查、组织病理学检查、影像学检查及实验室检测(如肿瘤标记物检测)等,其中组织病理学检查是ESCC 诊断的“金标准”。由于实验室检测具有方便快捷等优点,近年来,其在ESCC 筛查诊断和临床进展评估方面发挥越来越重要的作用。有报道显示,机体各项炎症相关指标在多种恶性肿瘤的临床进展评估中具有一定意义。同时,血清肿瘤标记物检测和凝血功能检测也是评估ESCC 患者临床进展的重要指标[3-4]。基于此,本文分析了河北医科大学第四医院66 例ESCC 患者的临床各项实验室检测指标,发现患者纤维蛋白原(fibrinogen,FIB)、纤维蛋白原与白蛋白比值(fibrinogen to albumin ratio,FAR)、癌胚抗原(carcino-embryonic antigen,CEA)和鳞状细胞癌抗原(squamous-cell carcinoma antigen,SCC-Ag)联合检测在ESCC诊断和临床进展评估中具有较高的价值,现报道如下。
1 材料与方法
1.1 病例资料
选取2018年4月—2021年10月河北医科大学第四医院收治的66例ESCC 患者为研究对象。其中男性43名,女性23 名,中位年龄63 岁。纳入标准:①胃镜、胸腹部CT和组织病理学检测等结果符合ESCC诊断标准;②患者首次就诊,未接受介入手术、生物治疗及放化疗等干预措施;③临床及病理资料完整者;④无其他影响血液检查结果的疾病。患者临床(或病理)TNM 分期参考2017 年国际抗癌联盟/美国癌症联合委员会TNM 分期(第八版)标准。排除标准:①病理分型为食管腺癌、鳞腺癌患者;②合并其他器官恶性肿瘤者;③临床及病理资料不完整者。对照组来自河北医科大学第四医院就诊的无良恶性肿瘤、心血管疾病等影响血液检测指标的相对健康志愿者,随机选取30名,其中男性17 名,女性13 名,中位年龄59 岁。两组观察对象性别及年龄差异均无统计学意义(P>0.05)。本研究经河北医科大学第四医院伦理委员会批准(批准号:2021KS037)。
1.2 实验室检测指标及临床病理数据收集
ESCC 组患者于清晨空腹采血,进行血常规、凝血功能、生化及血清肿瘤标记物等检测,包括FIB、凝血酶原时间(prothrombin time,PT)、活化部分凝血酶原时间(activated partial prothrombin time,APTT)、抗凝血酶-III(antithrombin,AT-III)、中性粒细胞计数(neutrophil,NE)、淋巴细胞计数(lymphocyte,LY)、单核细胞计数(monocyte,MO)、血小板计数(platelet,PLT)、前白蛋白(prealbumin,PAB)、白蛋白(albumin,ALB)、CEA 和SCC-Ag。对照组只进行血常规、凝血功能和生化检测。计算纤维蛋白原与前白蛋白比值(ratio of fibrinogen to prealbumin,FPR)、FAR、中性粒细胞与淋巴细胞比值(ratio of neutrophil to lymphocyte,NLR)、血小板与淋巴细胞比值(ratio of platelet to lymphocyte,PLR)及全身炎症反应指数(systemic inflammatory response index,SIRI)。SIRI 计算公式为:

各项实验室检测结果正常值参考区间均按照该项目卫生行业标准或检测试剂盒说明书。同时,通过河北医科大学第四医院电子病历系统收集ESCC 患者初诊时年龄、性别、肿瘤最大直径和临床(或病理)TNM分期等资料。
1.3 统计学方法
运用SPSS 26.0 软件进行统计分析,计量资料不符合正态分布,采用中位数(M)[四分位数间距(P25-P75)]表示,两组观察指标比较采用两独立样本Wilcoxon 秩和检验。绘制受试者工作特征(receiver operating characteristic curve,ROC) 分 析FIB、FAR、FPR、NLR、PLR、CEA 和SCC-Ag 对ESCC 临床进展的预测能力。计数资料以例数表示,组间比较采用χ2检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 ESCC组患者实验室指标异常检出率及与对照组各项指标的比较
结果发现,ESCC 患者各项检测指标均存在一定异常比率(见表1)。ESCC 组FIB、FPR、FAR、NLR、PLR的中位值均明显高于对照组,LY、PAB水平中位值均低于对照组,差异均具有统计学意义(P<0.05)。两组PT、APTT、AT-III、ALB、NE、MO、PLT 和SIRI中位值无明显差异(P>0.05)。见表2~表4。

表1 ESCC组实验室检测指标异常率(n=66)
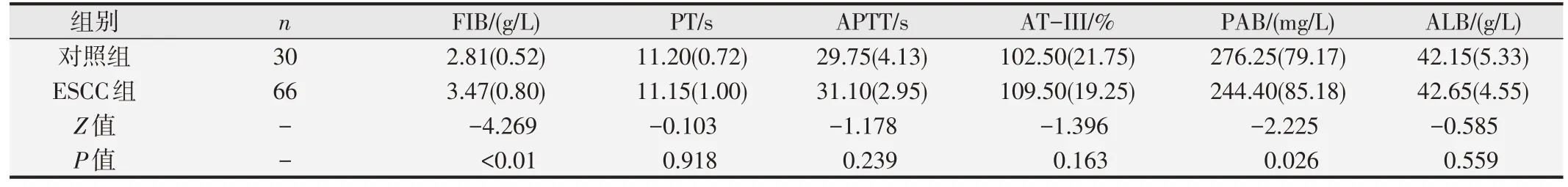
表2 ESCC组与对照组凝血、生化指标水平的比较[中位数(四分位数间距)]

表3 ESCC组与对照组血常规指标水平的比较[中位数(四分位数间距)]
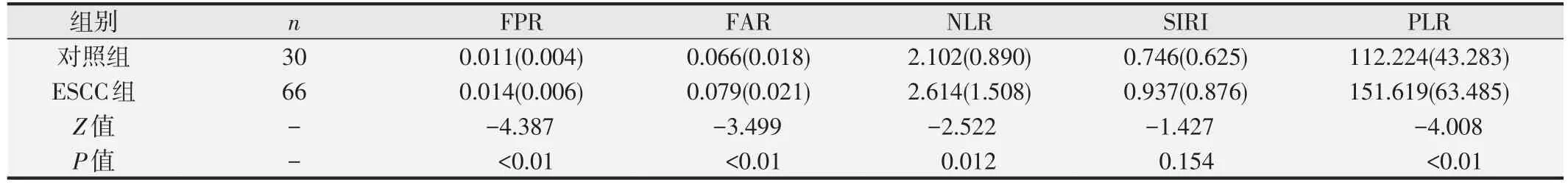
表4 ESCC组与对照组炎性指标水平的比较[中位数(四分位数间距)]
2.2 分析各实验室检测指标对ESCC 临床进展的预测价值
分析ESCC 组不同TNM 分期的FIB、FPR、FAR、NLR、PLR、CEA和SCC-Ag水平差异,并绘制的ROC曲线,分析其对ESCC 临床进展的预测价值(图1A)。TNM 分期为III~IV 期的FIB、FAR、CEA 和SCC-Ag 水平明显高于I~II 期(P<0.05)。见表5。ROC 曲线下面积比较显示,FIB、FAR、CEA 和SCC-Ag 对ESCC 的临床进展具有预测价值,差异均有统计学意义(P<0.05)。其中SCC-Ag 的ROC 曲线下面积最大(AUC=0.663),提示ESCC 的敏感度为58.3%,特异度为76.7%,cut off值为1.575 ng/mL,该指标对ESCC临床进展的预测比其他指标更为准确。但FIB、FAR、CEA和SCC-Ag联合检测对ESCC的临床进展的预测效能更高(AUC=0.732,敏感度为72.2%,特异度为63.3%,cut off值为0.482),见图1B和表6。
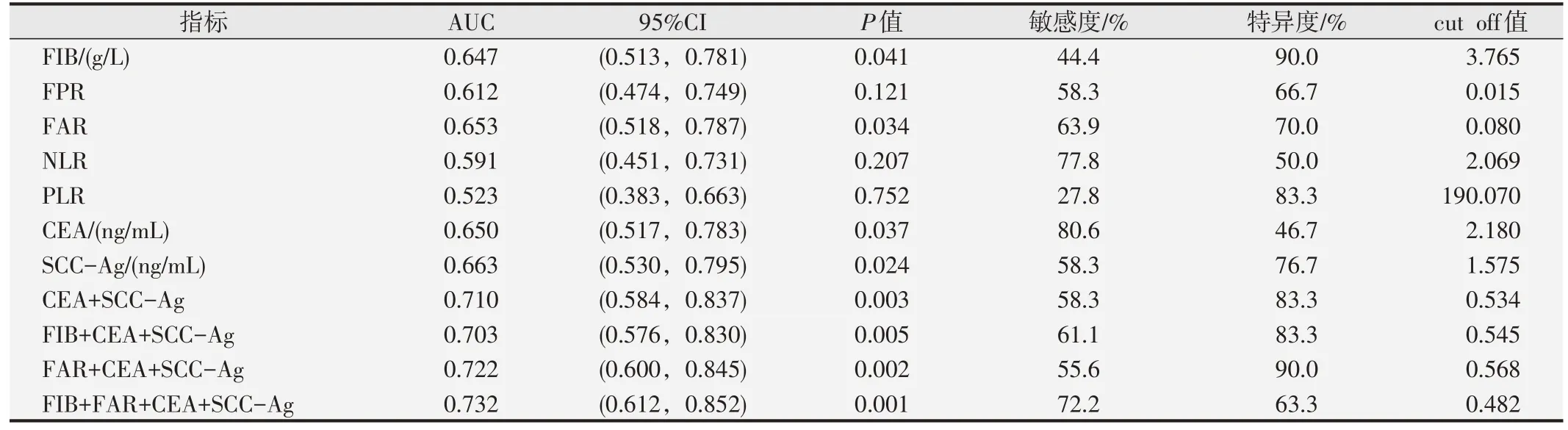
表6 各检测指标的ROC曲线下面积、95%CI、敏感度、特异度和cut off值
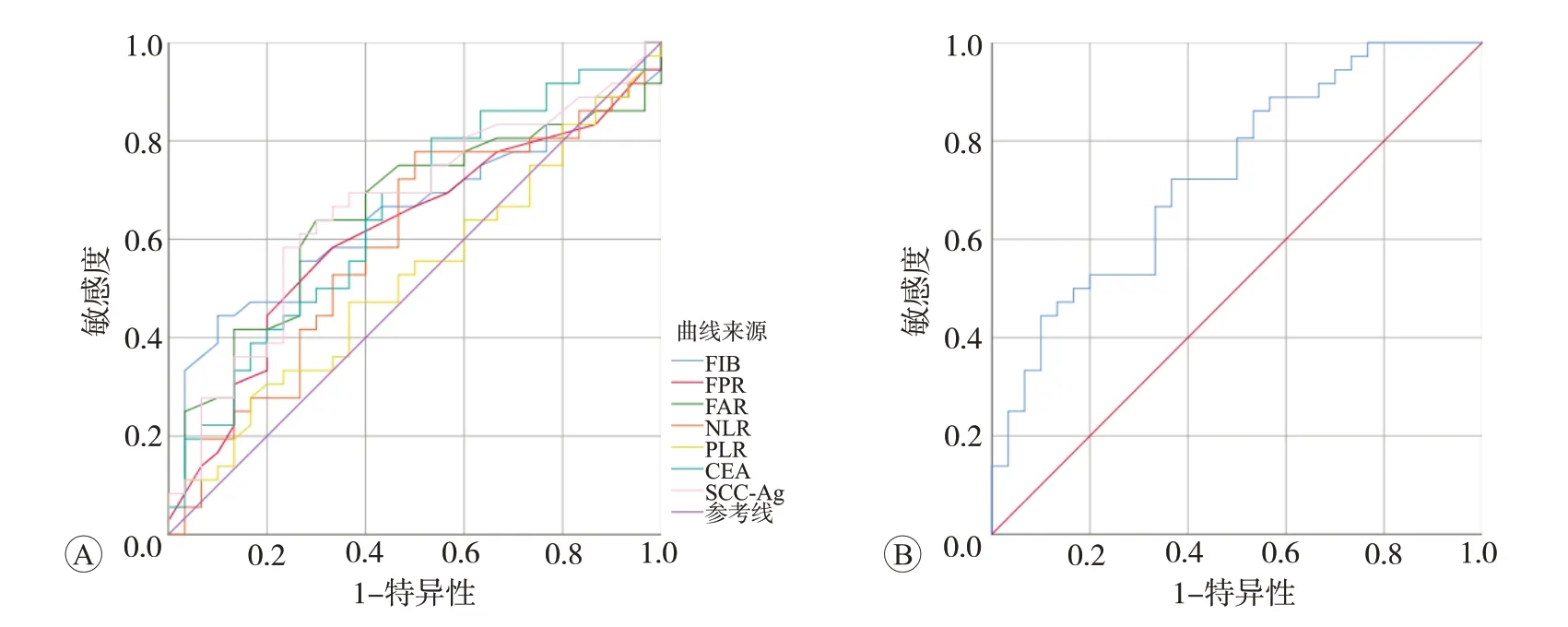
图1 ESCC患者各检测指标的ROC曲线分析和各指标联合检测的ROC曲线分析
2.3 FIB、FAR、CEA和SCC-Ag与ESCC患者临床病理学指标的相关性分析
以ROC曲线分析得到的cut off值为界值将不同水平FIB、FAR、CEA 和SCC-Ag 的ESCC 组患者分为高值组和低值组,χ2检验结果显示,FIB、FAR、SCCAg 高值组患者N 分期和TNM 分期均明显高于低值组,差异具有统计学意义(P<0.05);FAR 高值组患者的肿瘤最大径和T 分期也明显高于低值组,差异具有统计学意义(P<0.05);CEA 高值组患者TNM 分期明显高于低值组,且男性多于女性,差异具有统计学意义(P<0.05)。见表7~表10。
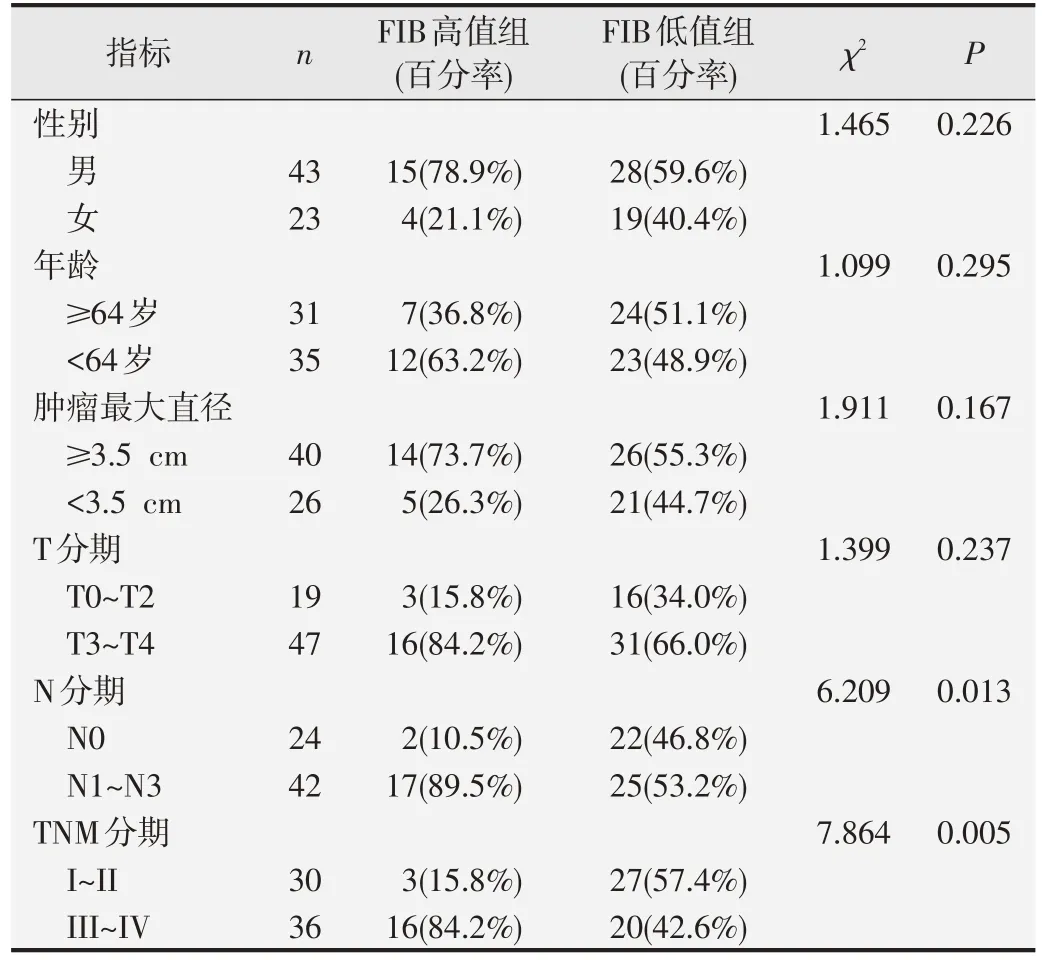
表7 FIB与ESCC组患者临床病理特征的相关性分析
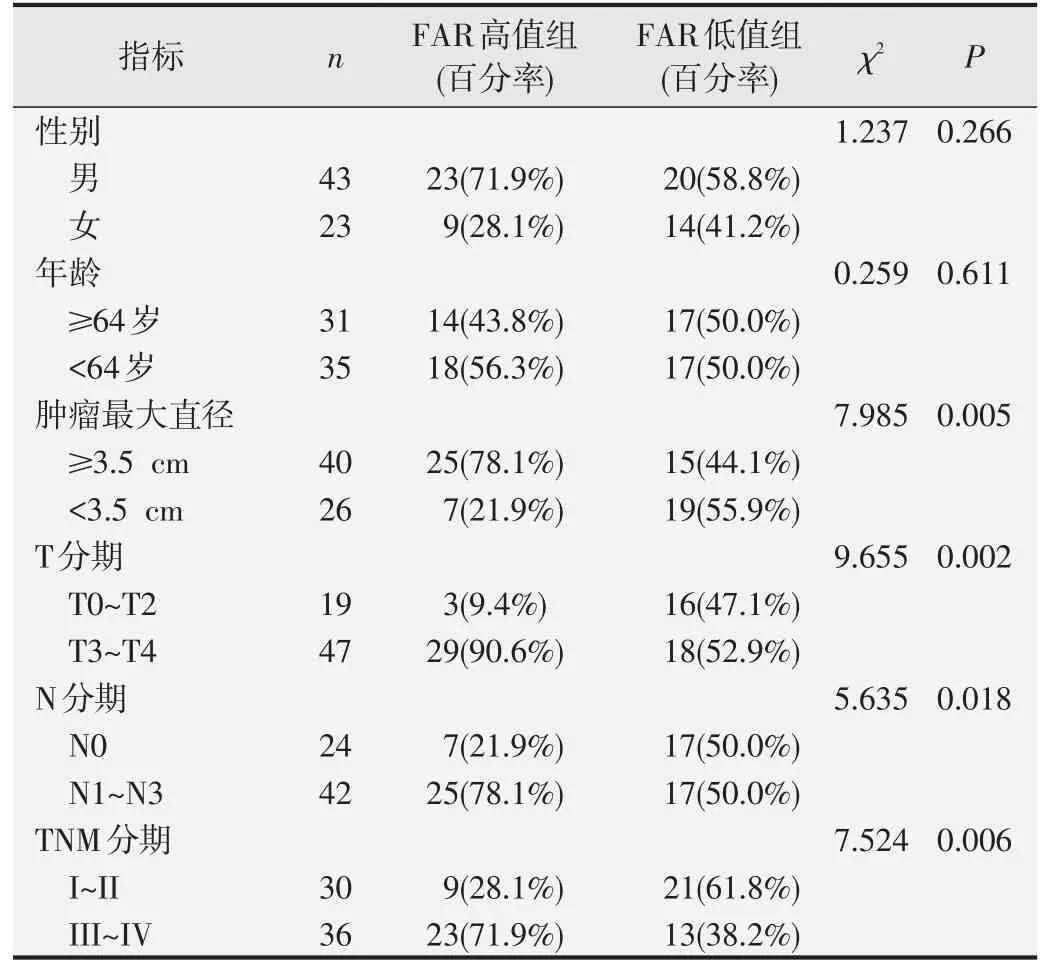
表8 FAR与ESCC组患者临床病理特征的相关性分析
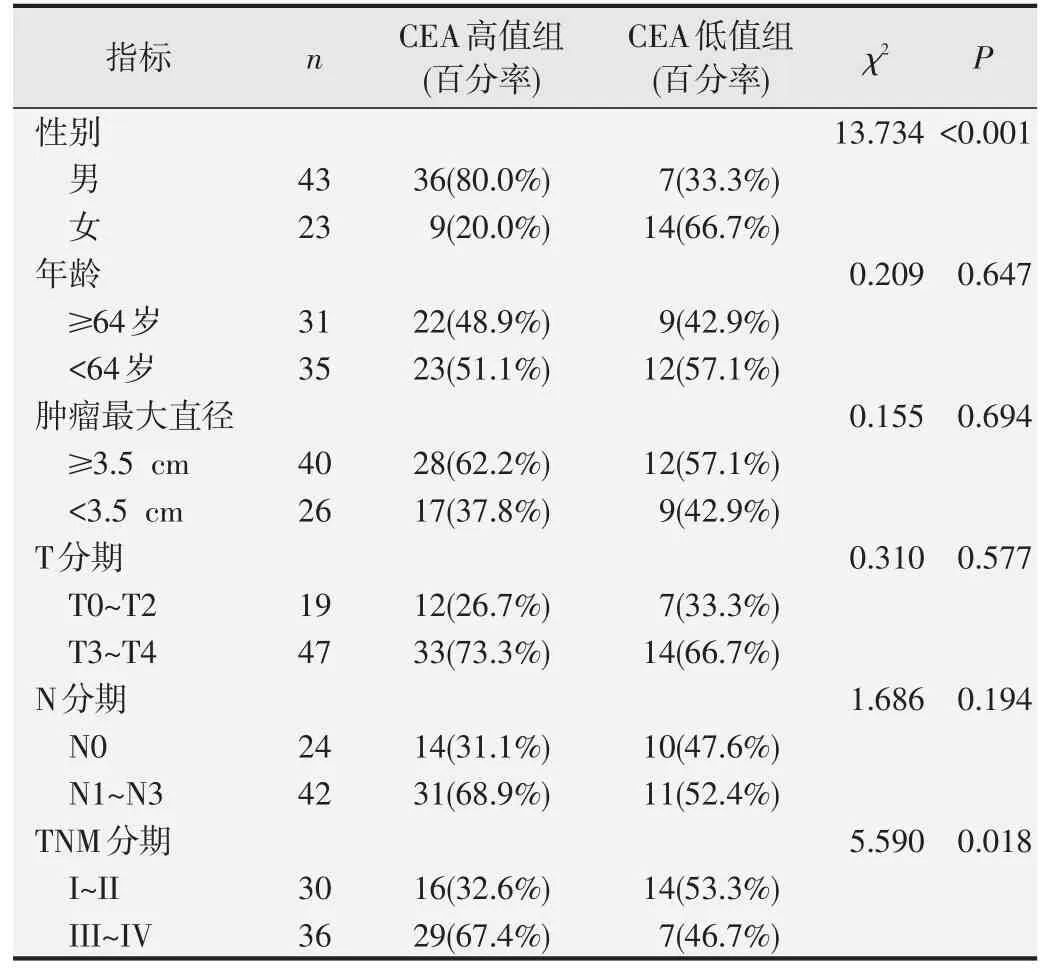
表9 CEA与ESCC组患者临床病理特征的相关性分析
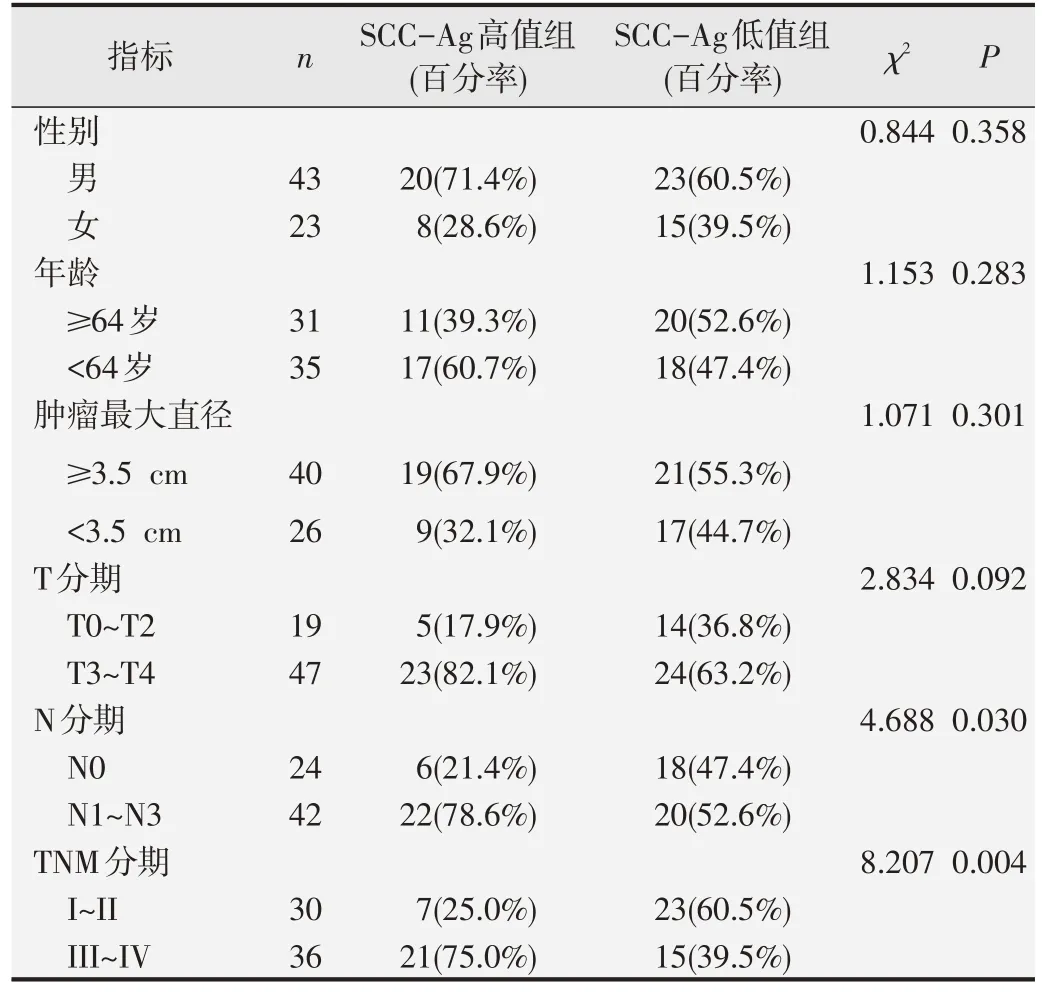
表10 SCC-Ag与ESCC组患者临床病理特征的相关性分析
3 讨论
本研究回顾性分析了近3年ESCC患者初诊时临床病理学特征及实验室检测指标,发现血浆FIB、FPR、FAR、NLR 和PLR 水平较相对健康人群明显增高;淋巴细胞计数和前白蛋白含量明显降低。ROC曲线分析结果发现ESCC患者血浆或血清中FIB、FAR、CEA和SCC-Ag水平与ESCC临床进展有一定的相关性。
恶性肿瘤患者血液往往呈高凝状态[5]。在恶性肿瘤患者体内,肿瘤细胞本身具有促凝血特性,其进入血液后,刺激内皮细胞分泌大量组织因子(TF),启动外源性凝血途径,使血液呈现高凝状态。并且通过激活相关通路促进肿瘤细胞的增殖、浸润及肿瘤血管的形成,参与肿瘤免疫逃逸,利于肿瘤的生长和扩散[6-7]。
本研究发现ESCC患者血浆FIB水平明显高于相对健康人群,提示大部分ESCC 患者机体可能处于相对高凝状态。同时,患者血浆FIB 升高,更易发生淋巴结转移,患者TNM分期也往往更晚,说明血浆FIB水平的明显增高可能是患者临床进展的提示性指标之一。张学振等[8-9]研究发现,食管癌患者FIB 水平会上调,临床分期为III~IV 期的患者其FIB 水平明显高于I~II 期者。Wakatsuki 等[10]指出,FIB 高水平ESCC 患者往往比FIB 正常水平患者总生存期更短。因此,血浆高水平FIB 可能是ESCC 患者预后不良的提示性指标。还有研究[11]表明,FIB可结合血管内皮生长因子,利于肿瘤组织血管形成,参与肿瘤的生长和转移,故FIB水平增高患者更易发生淋巴结转移。与本研究的结果一致。
本研究将FIB 水平与白蛋白和前白蛋白水平相结合,克服了单一指标的局限性,组成新的指标FAR和FPR。与FIB 相比,FAR 和FPR 不仅可以反映机体的凝血功能,还可以反映机体营养状况和炎症反应[12]。研究结果显示,ESCC 患者的淋巴细胞计数和前白蛋白水平比相对健康人群明显下降。由于恶性肿瘤过度增殖,消耗机体大量营养物质,导致患者出现营养不良[13]。恶性肿瘤破坏性生长引起机体炎症反应,导致外周血淋巴细胞数量降低,机体对肿瘤的免疫功能降低[14]。因此,ESCC患者普遍营养状况不佳,免疫功能减弱,促使肿瘤细胞的增殖和发展加速,对ESCC 患者的预后产生负面影响[15]。
本研究结果显示,ESCC 组患者血浆FAR 水平明显高于对照组,并且ESCC 患者血浆FAR 水平与患者的肿瘤大小、有无淋巴结转移和TNM分期具有一定的相关性。提示ESCC 患者凝血功能、营养状况和免疫功能可能与肿瘤进展密切相关。Tan等[16]招募1 135名ESCC患者,发现FAR水平与肿瘤长度、T分期、N分期显著相关,高水平FAR 患者5 年生存率比低水平FAR 患者显著下降。进一步验证了我们的假设。此外,多项研究也证实FAR 水平与转移性结直肠癌[17]、肝细胞癌[18-19]和胆囊癌[20]的临床进展显著相关,且对肿瘤预后评估有一定的临床价值。因此,监测血浆FAR水平在评估多种肿瘤进展中有重要的作用。
肿瘤标记物是指由恶性肿瘤细胞分泌或由机体对肿瘤细胞反应而产生(或)升高的一类物质。可用于监测肿瘤的发生发展以及预后情况。用于检测ESCC 的血清肿瘤标记物主要有CEA 和SCC-Ag。CEA 主要存在于未分化成熟的胚胎组织中,是一种广谱的血清肿瘤标记物;SCC-Ag 是鳞状上皮细胞异常凋亡分解的一种糖蛋白,可反映鳞状上皮细胞异常增殖和分化的情况[21]。本研究检测ESCC患者血清CEA和SCC-Ag水平与其病理学特征的相关性。结果显示,血清CEA和SCC-Ag 水平高低能较好地体现ESCC 肿瘤发展进程,但ESCC组患者中血清CEA和SCC-Ag水平异常检出率较低。因此,只通过检测血清CEA 和SCC-Ag 水平对ESCC 的检出及监测肿瘤进展具有一定难度。并且ROC 曲线显示,FIB、FAR 和血清肿瘤标记物联合检测比血清肿瘤标记物单独检测敏感度更高,对ESCC诊断效能也相对更好。四者联合检测更有利于对ESCC的检出及临床进展的监测。
综上所述,FIB、FAR 和血清肿瘤标记物与ESCC诊断和肿瘤进展密切相关,对于提示ESCC 患者临床进展程度有较大意义。且FIB、FAR 和血清肿瘤标记物联合比血清肿瘤标记物单独检出和监测ESCC 临床进展的价值更高,检测更简便,值得临床推广使用。
另本研究的局限性在于所选取的临床病例为近3年就诊患者,未能全面评估上述指标在预测患者5 年生存期中的意义,在后续研究中,我们将扩大样本量,继续对患者进行随访以探讨FIB、FAR 和血清肿瘤标记物联合检测在预测ESCC患者预后中的意义。

