CD109、STAT3在宫颈鳞状细胞癌中的表达及其与HPV感染的关系
黄丽娟,李 芳,舒 超,张秀娟,孔 红
1.新疆生产建设兵团第二师库尔勒医院病理科,新疆巴音郭楞 841000;2.河北省保定市第二医院病理科,河北保定 071051;3.库尔勒市第一人民医院病理科,新疆巴音郭楞 841000
宫颈鳞状细胞癌(SCC)是一种较为常见的女性生殖道恶性肿瘤,该肿瘤经历了由上皮内病变逐步发展为癌的一个渐进的病理过程。白细胞分化抗原109(CD109)是一种细胞表面糖蛋白抗原,与糖基化磷脂酰肌醇联结[1]。信号转导和转录活化因子(STAT)家族是一个由STAT基因编码合成的蛋白质家族,其中STAT3为凋亡抑制基因,有研究表明STAT3与多种肿瘤的发展关系密切[2]。长期持续性的高危型人乳头瘤病毒(HR-HPV)感染是导致SCC和宫颈鳞状上皮内病变(SIL)的高危因素,90%以上的宫颈癌患者被检测出HR-HPV[3]。本研究采用免疫组化法检测正常宫颈上皮(NCE)、SIL、SCC组织中CD109和STAT3的表达情况,采用杂交捕获-化学发光法检测NCE、SIL和SCC组织中HR-HPV的感染情况,探讨CD109、STAT3及HPV在SCC癌变过程中的表达、与临床病理特征的关系及三者间的相互关系。希望能进一步探讨SCC的发病机制,为SCC患者的诊断和治疗提供一定的理论支持。
1 资料与方法
1.1一般资料 选择2017年1月至2020年9月新疆生产建设兵团第二师库尔勒医院病理科收集的136例患者手术切除或宫颈活检标本的存档石蜡包埋蜡块为研究对象。因子宫肌瘤或腺肌症行全子宫切除的27例NCE作为对照,纳入NCE组;SIL患者78例纳入SIL组,其中低级别鳞状上皮内病变(LSIL)23例(29.49%,23/78)、高级别鳞状上皮内病变(HSIL)55例(70.51%,55/78)分别纳入LSIL组、HSIL组;SCC患者31例纳入SCC组,SCC组中角化型1例(3.23%,1/31)、非角化型30例(96.77%,30/31)。NCE组年龄25~64岁,平均(47.03±11.29)岁;LSIL组年龄20~66岁,平均(46.57±11.24)岁;HSIL组年龄25~78岁,平均(47.25±12.25)岁;SCC组年龄37~89岁,平均(53.01±13.37)岁。所有的病理切片均经过2名高年资病理医师复诊。本研究已通过新疆生产建设兵团第二师库尔勒医院医学伦理委员会审查。
1.2方法
1.2.1收集资料 收集所有研究对象年龄、肿瘤最大径、组织分化程度[4]、临床分期(FIGO2018临床分期[5])、淋巴结转移情况等资料。
1.2.2免疫组化染色 标本经10%中性甲醛溶液固定,脱水、透明、石蜡包埋、切片后进行常规HE染色及免疫组化染色。兔抗人CD109多克隆抗体、鼠抗人STAT3单克隆抗体(OTI21E7)均购自OriGene公司,免疫显色试剂购自Leica公司。免疫组化染色使用LEICA BOND-MAX全自动免疫组化仪进行。
1.2.3杂交捕获-化学发光法 136例患者均使用专用HPV标本采样刷采集宫颈脱落细胞,检测HPV感染情况。标本及试剂恢复至室温后,按照试剂盒说明书进行变性、杂交、捕获、检测、化学发光读数。HPV核酸检测试剂盒购于杭州德同生物技术有限公司。捕获微孔板A和(或)捕获微孔板B显示阳性为HPV阳性结果。
1.2.4免疫组化染色评定标准 CD109定位于细胞质和细胞膜,其阳性表达主要为细胞质和细胞膜有棕黄色颗粒。STAT3定位于细胞质,少部分在细胞核,在细胞质内呈现棕黄色颗粒为阳性。根据阳性细胞占肿瘤区域的百分比进行评分[6],评分标准如下:阳性肿瘤细胞数占总的肿瘤细胞数<10%为0分、10%~<30%为1分、30%~<60%为2分、≥60%为3分。无着色记为0分、淡黄色记为1分、棕黄色记为2分、棕褐色记为3分。两项得分相乘结果为0~4分判为阴性,≥5分判为阳性。
1.3统计学处理 采用SPSS19.0统计软件进行数据处理及统计学分析。计数资料以例数或百分率表示,组间比较采用χ2检验;采用Spearman相关进行相关分析。以P<0.05为差异有统计学意义。
2 结 果
2.1CD109免疫组化染色结果 免疫组化染色结果表明,NCE组中未见CD109阳性表达,SIL组和SCC组中CD109的阳性率分别为35.90%和58.06%,SCC组的CD109阳性率高于SIL组,差异有统计学意义(P<0.05),见表1。在不同级别的SIL组织中,CD109的阳性率随SIL病变程度的增加而升高,HSIL组CD109的阳性率明显高于LSIL组,差异有统计学意义(P<0.05),见表2。CD109在SCC和宫颈HSIL中的阳性表达见图1。进一步研究SCC组,发现CD109的阳性率在有淋巴结转移患者中(100.00%)明显高于无淋巴结转移患者(48.00%),差异有统计学意义(P<0.05),而其他不同临床病理特征SCC患者CD109的阳性率比较,差异无统计学意义(P>0.05),见表3。
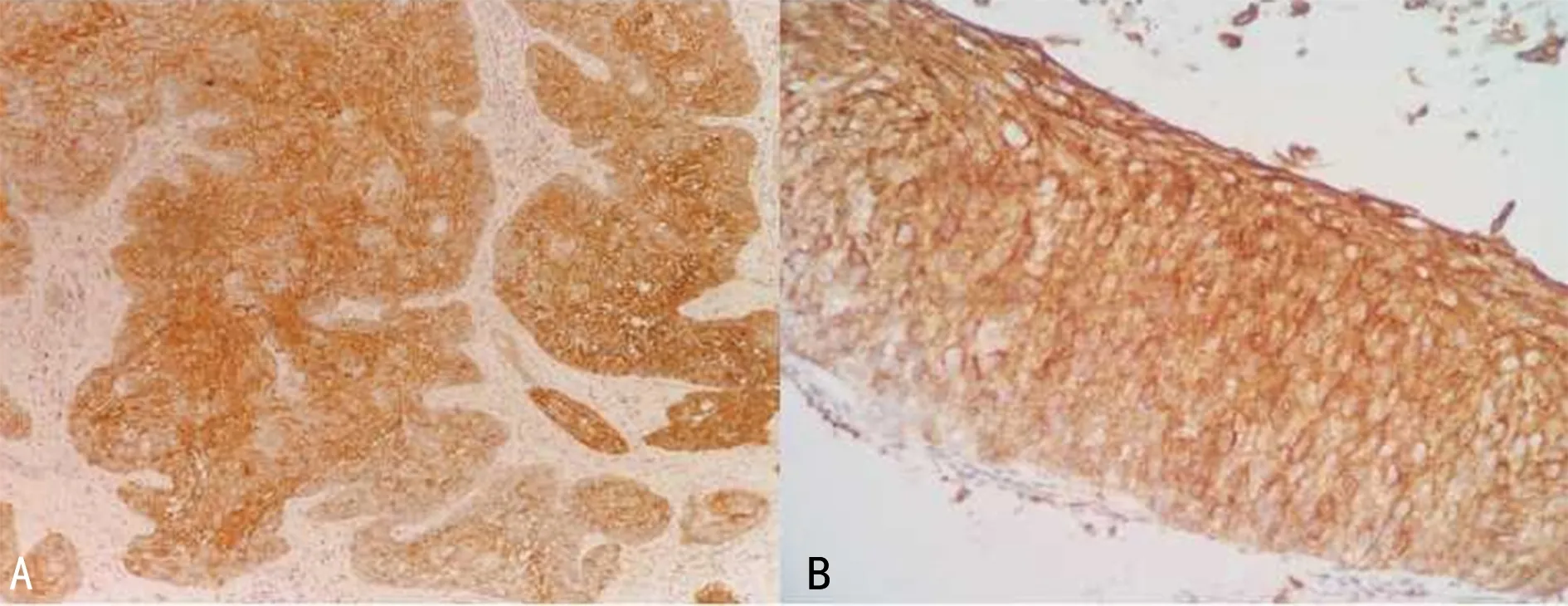
注:A为CD109在SCC中的阳性表达(×100);B为CD109在宫颈HSIL中的阳性表达(×400)。图1 CD109的阳性表达
2.2STAT3免疫组化染色结果 NCE组、SIL组和SCC组中STAT3的阳性率分别为29.63%、57.69%和90.32%,SCC组的STAT3的阳性率明显高于NCE组和SIL组,差异有统计学意义(P<0.05),见表1。STAT3在SIL组中的阳性率也随SIL病变程度的增加而升高,HSIL组的STAT3的阳性率明显高于LSIL组,差异有统计学意义(P<0.05),见表2。STAT3在SCC和宫颈HSIL中的表达见图2。SCC组中,STAT3的阳性率在不同临床病理特征患者间比较,差异无统计学意义(P>0.05),见表3。

注:A为STAT3在SCC中的阳性表达(×100);B为STAT3在宫颈HSIL中的阳性表达 (×400)。图2 STAT3的阳性表达
2.3HPV感染率 NCE组、SIL组、SCC组中HPV阳性率分别为18.52%、76.92%和93.55%。SCC组和SIL组HPV阳性率明显高于NCE组,差异有统计学意义(P<0.05),SCC组的阳性率也高于SIL组,差异有统计学意义(P<0.05),见表1。HSIL组HPV的阳性率高于LSIL组,差异有统计学意义(P<0.05),见表2。SCC组中,HPV阳性率在不同临床病理特征患者间比较,差异无统计学意义(P>0.05),见表3。

表1 NCE、SIL、SCC组中CD109、STAT3和HPV的阳性表达情况[n(%)]
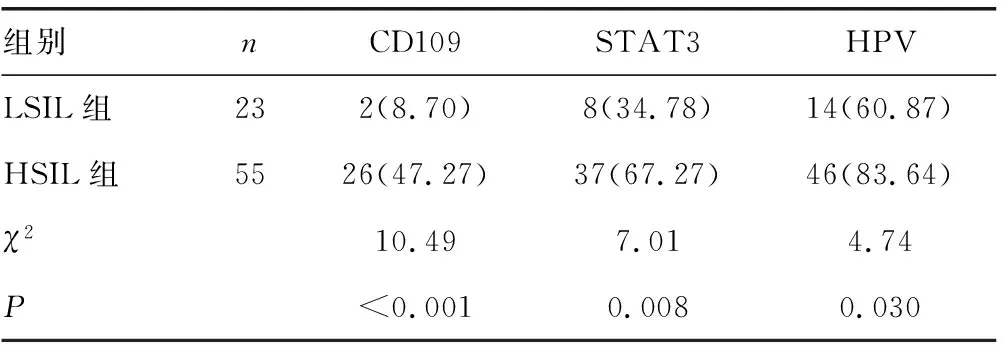
表2 LSIL组、HSIL组中CD109、STAT3和HPV的阳性表达情况[n(%)]

表3 CD109、STAT3、HPV在不同临床病理特征SCC患者中的阳性表达情况分析[n(%)]
2.4CD109与STAT3表达、HPV感染的相关性分析 136例研究对象中CD109与STAT3呈正相关(r=0.208,P<0.001),CD109表达与HPV感染呈正相关(r=0.291,P<0.001)。
3 讨 论
宫颈癌是一种常见的生殖道肿瘤,病死率很高。全球每年大约有50万人因宫颈癌而就诊,大多数死亡患者和新发患者在发展中国家。宫颈癌筛查和HPV疫苗接种有助于减少宫颈癌的发生[7]。目前普遍认为,宫颈癌的高风险因素是HPV感染,而持续性HPV感染很可能引发宫颈病变[8]。本研究发现,随着患者宫颈病变级别逐渐升高,患者HPV阳性率升高,提示HPV感染与宫颈病变严重程度关系密切。CD109是一种细胞表面抗原,研究发现,在健康人睾丸组织及某些肿瘤细胞系(包括鳞状细胞癌及胶质母细胞瘤细胞)中CD109呈高表达[9]。HASHIMOTO等[10]对33例肺癌患者进行分析,发现约1/2鳞状细胞癌组织中CD109表达明显升高,而在腺癌、小细胞肺癌和大细胞肺癌组织中CD109均未见表达。除了肺鳞状细胞癌,ZHANG等[11]报道,相较于子宫内膜样腺癌、正常宫颈鳞状上皮及正常子宫内膜腺上皮,SCC组织中CD109的表达升高。可见在一些肿瘤组织中,尤其是鳞状细胞癌组织中CD109的表达上调。STAT是一种细胞质转录因子,可以与细胞核中的DNA结合,并参与靶基因的调控,从而介导一系列病理、生理变化(包括肿瘤细胞增殖、肿瘤细胞侵袭、肿瘤细胞浸润、肿瘤细胞转移和凋亡)[12]。因此,STAT是恶性肿瘤发生和发展的重要调控因子。STAT3是表皮生长因子受体(EGFR)、IL-6/JAK、Src等多个致癌性酪氨酸激酶信号通路汇聚的焦点,在多种肿瘤细胞和组织中都有过度表达[13]。
本研究采用免疫组化及杂交捕获-化学发光法对NCE、SIL、SCC做了初步研究,旨在探讨CD109、STAT3、HPV与宫颈癌发生、发展的关系,CD109、STAT3、HPV的表达随着病变级别的升高而逐渐升高,提示3项指标可以作为SIL进展成癌的早期标志物。本研究还发现,在不同年龄、肿瘤最大径、分化程度、临床分期SCC患者中,CD109、STAT3、HPV的表达水平比较,差异无统计学意义(P>0.05),而CD109在有淋巴结转移与无淋巴结转移SCC患者中比较,差异有统计学意义(P<0.05),提示CD109的高表达更易于淋巴结转移,与肿瘤预后不良有关。从LSIL、HSIL到SCC,CD109在子宫颈鳞状上皮癌变过程中的表达呈逐渐升高的趋势,并且在SCC组中,CD109的表达与淋巴结转移有关;CD109与STAT3呈正相关关系,在宫颈癌的癌变过程中起协同作用。该结果与MO等[14]研究具有一定的相似性,MO等[14]发现,CD109在SCC组织中的表达明显高于正常宫颈组织,并且CD109在不同临床TNM分期/分级SCC组织间表达差异无统计学意义(P>0.05)。有研究显示,TGF-β信号通路的异常与SCC的发生、发展有关[15]。CD109是TGF-β/Smads信号通路中新的辅助受体,在人类角质形成细胞中CD109可负性调节TGF-β。CD109在某些肿瘤的发生、发展中发挥着重要作用,且CD109作为TGF-β受体,可以和TGF-β1绑定形成异构体复合物TGF-β受体Ⅰ和Ⅱ (TGFβRⅠ/TGFβRⅡ),并加速TGFβR1蛋白酶体的降解[16]。但CD109在SCC中与TGF-β信号通路有无关联,当前尚未知。STAT3与多种肿瘤的发展有密切关系,白细胞介素、生长因子等能引发STAT3磷酸化,磷酸化的STAT3(p-STAT3)进入细胞核显示出致癌作用,参与肿瘤细胞的增殖、分化、侵袭、转移、血管生成及抗凋亡,STAT3过度表达可导致细胞增殖和恶性转化。在SCC中,CD109影响STAT3信号转换器和激活因子的激活,可能是由EGFR介导的。具体为CD109的高表达会提高体外和体内的致瘤性及侵袭性,同时该因子可能诱导EGFR介导的STAT3磷酸化,进而影响STAT3所介导的细胞迁移、增殖等[15]。同样本研究也发现CD109与STAT3存在明显的正相关,进一步证实了以上结果的科学性。但当前相关的机制分析文献报道甚少,关于CD109如何促进宫颈癌肿瘤侵袭性的详细机制尚不清楚,其具体机制还有待深入分析。
本研究采用免疫组化及杂交捕获-化学发光法对CD109、STAT3、HPV在SCC癌变过程中的作用做了初步研究,可以相信,随着研究的不断推进,CD109、STAT3、HPV作为宫颈癌诊断标志物的价值将会逐渐清晰。

