扩张型心肌病心脏移植患者全外显子测序分析
武 琼, 刘 涛, 魏 兵, 安 然
北部战区总医院1. 新生儿科;2. 心血管外科,辽宁 沈阳110016
扩张型心肌病(dilated cardiomyopathy,DCM)是 一种以左心室或双心室扩大伴心脏收缩功能降低为典型特征的原发性心肌病,临床主要表现为慢性心力衰竭、心律失常、附壁血栓形成及心源性猝死。美国的一项流行病学调查显示,在欧美人群中,DCM 的年患病率为36.5/10 万人[1]。 近年来,随着血管紧张素转换酶抑制剂、β 受体阻滞剂、植入型心律转复除颤器和心脏移植等治疗措施的不断应用,DCM 患者的生存质量不断改善,但仍有较高的病死率[2-5]。 Haas 等[6]研究报道,DCM 占所有心力衰竭患者的30% ~40%,是心脏移植的主要原因。DCM 可归因于遗传和非遗传原因,遗传原因占所有DCM 患者的30% ~50%[6],常染色体显性遗传是主要的遗传方式。 非遗传原因包括高血压、瓣膜疾病、心肌炎、遗传代谢病和神经肌肉疾病等,但这些非遗传形式的心肌病也可能受个人遗传特征的影响。 全外显子测序技术的发展使人类遗传学和基因组学进入临床研究的新时代[7]。 本研究采集DCM 心脏移植患者的静脉血DNA 进行全外显子基因测序,结合生物信息学分析,旨在探索与DCM 发生密切相关的突变基因,并分析其与临床特征的相关性。 现报道如下。
1 对象与方法
1.1 研究对象 回顾性分析自2016 年9 月至2020 年9 月就诊于北部战区总医院心血管外科的6 例DCM 心脏移植患者的临床资料。 患者均符合《中国扩张型心肌病诊断和治疗指南》[8]中DCM 的诊断标准。 6 例患者的一般资料见表1。 本研究经医院伦理委员会批准[伦审K(2020)29 号]。
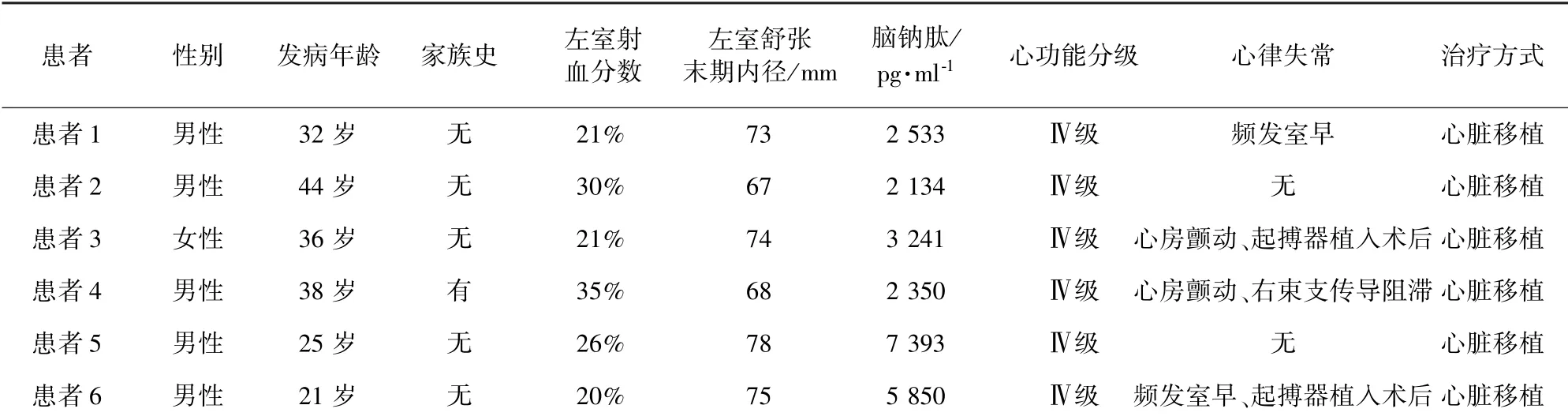
表1 6 例患者一般资料
1.2 全外显子测序 采集患者静脉血约2 ml,经EDTA 抗凝,离心后于-80℃冰箱保存,高通量测序法进行全外显子基因测序。 使用DNA 血液检测试剂盒提取血液DNA。 通过1%琼脂凝胶电泳评估DNA 的降解程度以及是否有RNA、蛋白质污染,进而评估DNA 的完整性。 对所有DNA 样本进行定量,总量>250 ng 可用来建库。 将DNA 随机剪切到200 bp 的平均片段大小,使用AMPureXP 磁珠提纯碎片以除去小产物。 片段化后的DNA 经过3 个酶解步骤:末端修复、A-拖尾和与Illumina 成对末端索引接头的连接,通过PCR 扩增进行样本标记并富集DNA,用Qubit 2.0 荧光光度计进行定量检测。将带有生物素标记的RNA 探针与特异片段文库进行液相杂交,再通过带有链酶亲和素标记的磁珠获取目标基因外显子,进而用PCR 扩增进行目标基因的富集。 测量DNA 浓度,文库浓度>25 ng/μl 参考为合格文库。 使用Agilent 的2100 生物分析仪分析捕获的文库,文库主峰在220 ~320 bp,主峰前后无杂峰。 文库构建完成后,使用Qubit 3.0 进行定量,然后用NovaSeq 6000 平台进行PE150 测序,产生2 ×150 bp 的成对末端读数。
1.3 生物信息学分析 使用GATK 分析基因突变位点,并用ANNOVAR 注释。 在CLNDN、HGMD_Phenotype、KEGG、OMIN_disease、HPO、HGMD 数据库筛选关键词“DCM”,将发现的致病基因位点与其进行比对。 通过千人基因组 2015 年版(1000g2015aug)、 ExAC 数 据 库、 gnomAD exome人群基因突变频率数据库筛选,保留“未收录”及人群突变频率≤0.05 的突变。 采用GERP ++RS 软件对核苷酸序列进行保守性分析,分值>2 代表突变基因位点具有保守性,分值越高表明核酸的保守性越高。 采用Mutation Taster、Fathmm MKL 在线预测软件及CADD 评分评估蛋白质的致病性。 Mutation Taster 用于预测内含子和非同义突变、移码突变对基因功能的影响,分值越大结果越可靠,预测结果取值为D:Disease causing(有害);N:Polymorphism(无害)。 Fathmm MKL 软件的预测分值越小越有害,预测结果取值为D:Deleterious(有害);T:Tolerated(无害)。 采用CADD 评分评估单核苷酸位点突变的有害性,CADD 值越高,该突变位点是一个有害突变的概率越高,CADD 分值>15 为有害突变。 应用InterVar 软件对筛选的基因突变位点进行美国医学遗传学与基因组学学会(The American College of Medical Genetics and Genomics,ACMG)评级。
2 结果
2.1 全外显子测序结果 全外显子测序共筛选出3 个与DCM 相关的基因突变位点。 (1) 患者2 发现PSEN2 基因在chr1:227078985 位置发生错义突变,导致编码的第298 号氨基酸由蛋氨酸变异为苏氨酸。 (2)患者3 发现MYBPC3 基因在chr11:47364625 位置发生错义突变,导致编码的第433 号氨基酸由丙氨酸变异为甘氨酸。 (3)患者4 发现LMNA 基因在chr1:156104248 位置发生错义突变,导致编码的第190 号氨基酸由精氨酸变异为色氨酸。 见表2。
2.2 突变位点致病性评估结果 LMNA 及MYBPC3 基因突变位点在人群突变数据库中为未收录位点,PSEN2 基因突变位点在人群数据库中的最高突变频率为0.000 008 15。 经GERP ++RS 软件预测,3 个突变基因位点均具有保守性。 经Mutation Taster 软件、Fathmm-MKL 软件预测及CADD 评分,3 个基因突变位点均具有致病性。 经ACMG 评级,LMNA Arg190Trp 突变为可能致病的突变,MYBPC3 Ala433Gly 突变及PSEN2 Met298Thr 突变为临床意义未明的突变。 见表3。

表2 筛选基因突变位点的具体信息

表3 基因突变位点突变频率及在线软件预测结果
3 讨论
分子遗传学研究表明,基因突变与DCM 发病机制、临床表型及预后等高度相关[9]。 目前研究发现,有40 多个基因与DCM 相关,这些基因分别编码细胞骨架、心肌结构蛋白、离子通道蛋白、线粒体和RNA 结合蛋白等[10]。 LMNA 基因突变是家族性DCM 的第二大常见病因,发生于5% ~13%的特发性DCM 患者中[11]。 LMNA 基因编码的核纤层蛋白A 和C,可以维持细胞核核膜的稳定及核孔的形成,在肌动蛋白和细胞外基质的连接中起机械传导的作用[12]。 功能研究表明,与野生型蛋白相比,LMNA 变异体改变了蛋白的粘弹性,降解速率更快,并形成了更多的蛋白质聚集体[13-14]。 该突变位点ACMG 评级为可能致病的突变(致病证据:PM1 +PM2 +PP3 +PP5),在ClinVar 网站中被报告为致病性突变(变异ID:66908)。
LMNA 基因突变的患者常在未诊断DCM 前便出现了有症状的传导系统疾病或心律失常,诊断DCM 后常伴有严重心力衰竭、左室壁血栓形成或心源性猝死,但心源性猝死的患者一般伴有轻微的收缩功能障碍或无收缩功能障碍[15]。 因此,欧洲心脏病学会指南建议,对于具有LMNA 突变的DCM患者,即使心脏收缩功能正常,也应考虑植入型心律转复除颤器治疗(Ⅱa 类推荐)[16]。 本研究中,LMNA 基因突变患者伴有心房颤动及右束支传导阻滞,心功能较差,在38 岁接受了心脏移植手术,这与现有的LMNA 基因型与DCM 临床表型相关的研究结论相符,且患者父亲具有心脏扩大病史,不能排除家族性DCM 的可能。 有研究报道,LMNA相关的DCM 患者表现出与年龄相关的外显率,70 岁时外显率可达90% ~95%[15],因此建议患者家系成员进行该基因位点的筛查,对无症状基因突变携带者的心脏功能进行长期的随访筛查。
MYBPC3 基因编码的心肌肌球蛋白结合蛋白C,在肌节A 带中横向排列,在粗肌丝中结合肌球蛋白重链,在细肌丝中结合肌动蛋白,该蛋白的磷酸化对于心肌肌节的收缩起调节作用。 MYBPC3基因突变与DCM 相关研究较少,多在肥厚性心肌病家系中被报道。 Daehmlow 等[17]报道了1 例DCM男性患者的MYBPC3 错义突变(Asn948Thr)。 本研究发现了 1 例新的 MYBPC3 错义突变(Ala433Gly),ACMG 评级为临床意义未明的突变(致病证据:PM1 +PM2 +PP3),需进一步获取患者家系成员的基因位点信息以提升ACMG 评级的证据等级。 目前尚缺乏MYBPC3 基因突变与DCM 临床表型相关联的研究,仅有Dhandapany 等[18]分析了南亚人群心肌病患者MYBPC3 基因中25 bp 的缺失,确定了MYBPC3 基因突变与心力衰竭风险增加相关。 而本研究中MYBPC3 基因突变患者心力衰竭症状较重,在接受心脏起搏器治疗后心功能难以维持,最终接受心脏移植治疗。
PSEN2 编码早老素2,是影响γ-分泌酶活性的重要决定因素,负责淀粉样前体蛋白和NOTCH 受体蛋白的蛋白水解切割,被证实为3 型阿尔兹海默病的突变基因。 Li 等[19]对315 例DCM 患者的PSEN1 和PSEN2 基因序列进行了评估,在两个DCM 家系分别中发现了一个新的PSEN1 错义突变(Asp333Gly)和一个PSEN2 错义突变(Ser130Leu),并证实来自PSEN1 和PSEN2 突变携带者的成纤维细胞中的钙信号发生了改变。 而本研究发现了1 例新的PSEN2 错义突变(Met298Thr),ACMG 评级为临床意义未明的突变(致病证据:PM1 +PM2 +PP3)。 由于目前对于PSEN2 基因与DCM 的相关研究较少,仍需大样本的临床研究及功能验证进一步得到更准确的结论。
综上所述,本研究发现了1 例DCM 的热点突变LMNA Arg190Trp,2 例临床意义未明的基因突变位点MYBPC3 Ala433Gly 及PSEN2 Met298Thr,需要进一步对患者家系成员进行基因筛查,同时进行功能试验,对基因位点的致病性进行验证。

