多柔比星对人骨肉瘤细胞P-糖蛋白表达的影响
叶天宝,张振宇,王伯仁,王大昊
(锦州医科大学附属第一医院,辽宁 锦州 121000)
骨肉瘤是最常见的发生于青少年的原发性恶性肿瘤,排在所有恶性肿瘤发生率的第8位,约占骨恶性肿瘤的20%。随着医疗水平和治疗手段的不断进步,骨肉瘤患者的5年生存率已经从20世纪60年代的不到20%提升到20世纪80年代的中期的近70%。然而,近20年来,骨肉瘤患者的治疗效果并没有明显提升,且合并远处肺转移的骨肉瘤患者5年生存率仍较低[1-2]。
现阶段,骨肉瘤的治疗是以新辅助化疗为主的综合治疗,化学治疗是主要手段之一。虽然化疗使患者的生存率有了明显的提高,但耐药性的产生成为影响化疗药物效果的主要障碍[3]。克服骨肉瘤药物耐药是目前重点研究的领域,肿瘤的耐药是多种机制参与的非常复杂的过程,其中,多药耐药(multiple drug resistant,MDR)的产生,是目前临床上骨肉瘤化学治疗的主要障碍之一[4]。
虽然多药耐药-1基因(MDR-1)的转录调控机制尚未完全了解,但据研究显示,大量的转录因子参与其中,如Ras、Sp1、P53、NF-κB等[5-8]。多种耐药的产生机制十分复杂,但目前研究较多且有大量证据支持的仍为能量依赖型将化疗药物泵出细胞的外排系统,如P-糖蛋白[9]。P-糖蛋白(permeability glycoprotein,P-gp)由MDR-1基因编码,是一个分子量为170 kDa的跨膜糖蛋白,既能与ATP结合,也能与药物结合,具有能量依赖型“药泵”功能[10-11]。NF-κB是广泛存在于体内细胞中的重要核转录因子,与肿瘤细胞多药耐药(MDR)有密切关系。
多柔比星是临床上常用的化疗药物之一,属于蒽环类,抗瘤谱较广。本研究以多柔比星作用于人骨肉瘤U2-OS细胞,观察多柔比星促进人骨肉瘤U2-OS细胞凋亡并诱导耐药产生的规律。
1 材料与方法
1.1 材料
人骨肉瘤U2-OS细胞株购自中国科学院上海生命科学研究院细胞资源中心。MTS由美国Promega公司生产,DMEM高糖培养基及胎牛血清由Thermo公司生产,Annexin V :FITC Apoptosis Detection Kit I由BD公司生产,二甲基亚枫(DMSO)、胰酶、Western blot相关试剂购自碧云天(北京)生物技术有限公司,兔抗人NF-κB抗体由英国Abcam公司生产,鼠抗人P-gp抗体由美国Millipore公司生产。
1.2 细胞培养
(1)人骨肉瘤U2-OS细胞培养在含10%胎牛血清,DMEM高糖培养基,5% CO2的37 ℃的培养箱内,当细胞生长至培养基底板面积的75%~80%左右弃去培养液;(2)加入适量PBS液漂洗1次,弃去PBS液;(3)用0.25%胰酶消化,倒置显微镜下见细胞间隙增大、胞质回缩时终止消化,然后分瓶再培养;(4)待细胞进入对数生长期后用于实验或每2~3 d换液传代,见图1。
40× 200×图1 细胞培养图片
1.3 MTS法测定细胞增殖活性
(1)于96孔板培养板中每孔加入100 μL的1×105/L人骨肉瘤U2-OS细胞,每排加6孔,留2孔只加培养液做调零孔,细胞周围的孔由PBS填充,避免“周围效应”(即水分蒸发造成的浓度改变);(2)各孔依次加入0、1、5、10和100 μg/mL DOX,37 ℃分别培养24、48、72 h后,每孔加入MTS 10 μL;(3)继续培养4 h,酶标仪测定490 nm处吸光度(A)值。细胞存活率(%)=A实验组-空白组/A对照组-空白组×100%。
1.4 流式细胞仪测细胞凋亡
(1)于6孔板培养板中每孔加入2 mL 5×105/L人骨肉瘤U2-OS细胞,细胞分为5组,分别为不含药物的正常对照组和分别加入不同浓度(1、5、10、100 μg/mL)的DOX组;(2)分别培养24、48、72 h后,用0.25%胰酶常规消化细胞,收集至流式管,1200 rpm,离心5 min,弃上液;(3)每管加入适量PBS液,重悬细胞,轻轻吹打,避免气泡,1200 rpm,离心5 min,重复2次; (4)配制Binding buffer为1×Binding buffer,加入100 μL 1×Binding buffer重悬细胞;(5)加入5 μL Fluorochrome-conjugated Annexin V;(6)室温孵育10~15 min;(7)加入5 μL Propidium Iodide,室温孵育5 min后即可上流式细胞仪检测,一般4 h内上机均可,可2~8 ℃避光保存。
1.5 Western blot法检测目的基因的蛋白表达水平
细胞培养同前,用细胞裂解液裂解细胞得胞质蛋白,用BCA法测定其浓度。取30 μg蛋白上样到SDS-聚丙烯酞胺凝胶(分离胶浓度为10%、浓缩胶浓度为5%),电泳,转移至PVDF膜,室温5%脱脂牛奶摇床2 h以封闭非特异性结合位点,分别用NF-κB抗体1∶3000,P-gp抗体1∶500,4 ℃摇床过夜,设GAPDH为内参,再用辣根过氧化物酶标记的二抗孵化2 h,TBST洗膜3次,将高敏ECL发光液A、B液按1∶1比例混匀后完全浸湿PVDF膜,使用MF-ChemiBIS凝胶成像系统成像。
1.6 统计学方法
2 结 果
2.1 DOX对骨肉瘤U2-OS细胞增殖的影响
各组骨肉瘤细胞的吸光度值(A值)显示,用1、5、10和100 μg/mL DOX作用骨肉瘤U2-OS细胞24 h后,各药物组吸光度值分别为(1.583±0.007)、(1.423±0.035)、(1.370±0.021)、(1.083±0.255),对照组为(1.611±0.016),各药物组与对照组相比及各药物组之间比较差异均有统计学意义(P<0.05);作用48 h后,各药物组吸光度值分别为(1.521±0.027)、(1.362±0.022)、(1.146±0.030)、(0.985±0.015),对照组为(1.609±0.028),各药物组与对照组相比及各药物组之间比较差异均有统计学意义(P<0.05);作用72 h后,各药物组吸光度值分别为(1.248±0.057)、(1.108±0.040)、(0.941±0.033)、(0.544±0.028),对照组为(1.476±0.066),各药物组与对照组相比及各药物组之间比较差异均有统计学意义(P<0.05),见图2。
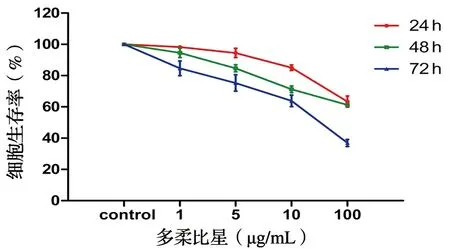
图2 多柔比星对骨肉瘤细胞生长的抑制曲线
2.2 DOX对骨肉瘤U2-OS细胞凋亡的影响
流式细胞检测结果显示,用1、5、10和100 μg/mL DOX作用骨肉瘤U2-OS细胞24 h后,各药物组凋亡率分别为(14.155±0.488)%、(24.750±0.636)%、(33.650±0.919)%、(58.150±2.616)%,对照组为(3.645±0.785)%,各药物组与对照组相比及各药物组之间比较差异均有统计学意义(P<0.05);作用48 h后,各药物组凋亡率分别为(15.575±1.252)%、(37.600±1.839)%、(42.590±3.974)%、(65.150±0.495)%、对照组为(3.585±0.007)%,各药物组与对照组相比及各药物组之间比较差异均有统计学意义(P<0.05);作用72 h后,各药物组凋亡率分别为(27.950±2.475)%、(45.650±0.495)%、(56.050±1.060)%、(75.250±0.919)%,对照组为(6.230±0.226)%,各药物组与对照组相比及各药物组之间比较差异均有统计学意义(P<0.05),见图3。
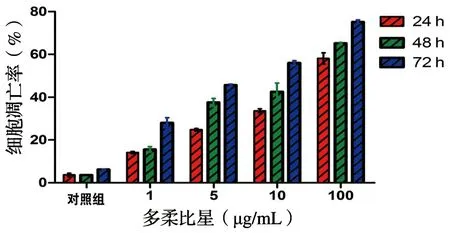
图3 不同浓度多柔比星作用于U2-OS细胞24、48、72 h后凋亡率变化
2.3 DOX对骨肉瘤U2-OS细胞的NF-κB和P-gp 蛋白表达的影响
Western blot检测结果显示,用1、5、10和100 ug/mL不同浓度的DOX作用U2-OS细胞24 h后,NF-κB的蛋白表达水平各组分别为(1.9033±0.1697)、(2.0595± 0.1124)、(2.8318±0.4279)、(3.1559±0.5710)均较对照组(0.3068±0.0601)明显升高,随DOX浓度增加而升高,NF-κB的表达量与DOX的作用呈剂量正相关(P<0.05)。P-gp的蛋白表达水平与对照组(0.4238±0.0804)相比,各组间呈升高趋势,1 μg/mL组(0.2953±0.1108)、5 μg/mL组(0.4660±0.0849)、10 μg/mL组(0.6062±0.0462)及100 μg/mL(0.7893±0.1113)P-gp蛋白的表达水平随DOX浓度增而升高,差异有统计学意义(P<0.05),见图4~5。
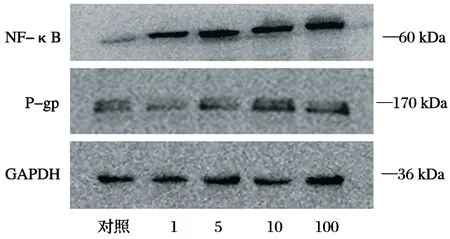
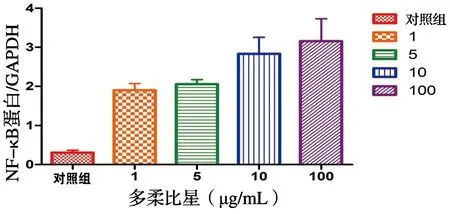
图4 用0、1、5、10和100 μg/mL DOX作用骨肉瘤U2-OS细胞24 h后NF-κB蛋白表达
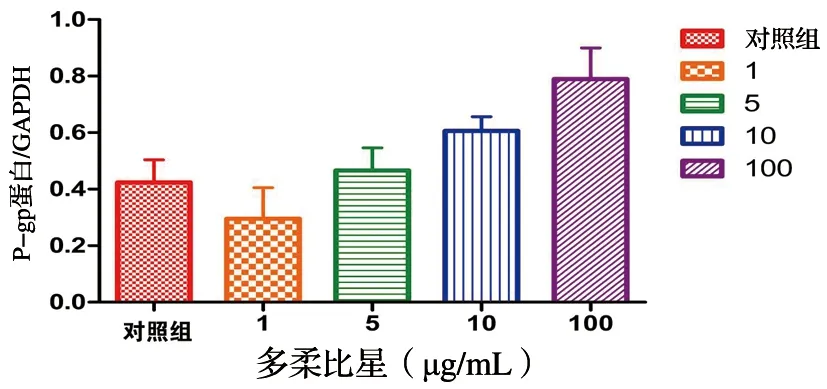
图5 用0、1、5、10和100 μg/mL DOX作用骨肉瘤U2-OS细胞24 h后P-gp蛋白表达
3 讨 论
骨肉瘤是好发于青少年最常见的骨原发性恶性肿瘤,恶性程度高,远处肺转移发生较早,预后差[12]。骨肉瘤的治疗开展以新辅助化疗为主的综合性治疗,虽然多柔比星等化疗药物对骨肉瘤细胞具有较强的杀灭能力,但长期应用后的耐药及毒副反应仍然是影响治疗效果的主要障碍[13]。多药耐药(MDR)的形成是多种机制共同作用的结果,每一种机制都有十分复杂而精细的过程,研究表明,肿瘤细胞对多种化疗药物如紫杉醇、蒽环类的抗性与过度表达的P-gp有关系。而P-gp就是MDR转运体中三磷酸腺苷结合盒型转运蛋白超家族(ABC)的一员[14]。研究肿瘤细胞耐药的分子机制发现,参与P-gp导多药耐药信号传导的通路主要有丝裂原活化蛋白激酶(MAPK)信号通路、环核苷酸依赖性蛋白激酶(cAMP /PKA)信号通路、NF-κB信号通路等[15-16]。其中,研究较为广泛的是NF-κB信号通路。Yague[17]等人使用多种化疗药物(包括多柔比星)处理化疗敏感白血病K562细胞72 h后,同样发现MDR1基因表达明显升高。有研究表明,在肝癌耐药细胞中,可以通过下调核转录因子NF-κB表达从而逆转P-gp蛋白的高表达[18]。研究显示,在人膀胱癌T24/J82耐药细胞株中,MDR1基因高表达,并发现可以通过激活NF-κB信号通路增加MDR1基因的表达,同时也能增强T24/J82耐药细胞对化疗药物顺铂的耐药性[19]。
本实验用不同浓度的DOX作用于人骨肉瘤U2-OS细胞,MTS结果显示DOX能够抑制肿瘤细胞生长,且各药物浓度组细胞生长明显受到抑制,差异有统计学意义。流式细胞仪检测结果显示,随各组DOX浓度和时间增加,细胞凋亡率逐渐升高,差异有统计学意义。以上两项结果表明,多柔比星作为经典抗肿瘤药物,在体外多柔比星可以明显抑制骨肉瘤细胞增殖并诱导其产生凋亡,其抑制率和凋亡率随药物浓度呈时间-剂量依赖性;NF-κB是一类特别重要的转录调控因子,其广泛存在于多种细胞中,能在转录水平调节许多基因的表达,一项研究表明,核因子κB及P-gp蛋白过表达与骨肉瘤的化疗耐药有关;P-gp蛋白是ABC转运蛋白家族中发现最早的一个蛋白,也是目前研究最广泛和最深入的一个蛋白,P-gp为广谱药物的外排泵,在肿瘤化疗过程中,可以促进化疗药物的外排,从而增强肿瘤细胞的化疗抵抗力,进而导致化疗耐药的发生;相关研究发现,P-gp高表达与肿瘤的进展有关,P-gp高表达骨肉瘤患者的肿瘤转移率和复发率均较P-gp低表达骨肉瘤患者明显增高[20];本实验用不同浓度DOX作用于人骨肉瘤U2-OS细胞24 h后,Western blot检测结果显示,各个给药组核转录因子NF-κB的蛋白表达量随DOX浓度增加而增加,同时P-gp蛋白表达量也随DOX浓度增加而增加,可以看出其表达量与药物的作用浓度之间呈现正相关。因此,本研究表明,多柔比星可能通过上调核转录因子NF-κB表达从而介导骨肉瘤U2-OS细胞多药耐药P-gp蛋白表达升高。
多药耐药形成的机制十分复杂,骨肉瘤化学治疗中,如何提高化疗药物敏感性,减少耐药的发生,还需要深入研究。继续研究及探讨骨肉瘤耐药细胞株中相关核转录因子及多药耐药蛋白的关系,用不同方法(如质粒转染等)继续探讨研究NF-κB转录因子在骨肉瘤多药耐药(MDR)的发生、发展中的作用,寻找有效的NF-κB转录因子抑制剂,降低或逆转多药耐药蛋白的表达,将为减少骨肉瘤耐药的发生以及提高骨肉瘤患者疗效和生存率有重要意义。

