神经生长因子对大鼠尾状核脑出血后脑组织炎症反应和神经元凋亡的影响
王月,王凌冰
(锦州医科大学附属第一医院,辽宁 锦州 121000)
脑出血是常见急性脑血管性疾病,我国约18.8%~47.6%的卒中患者为脑出血,该病病情凶险、变化快,致残和致死率高,死亡率可高达30%~50%[1]。脑出血后形成的血肿占位效应、血肿促进周围脑组织释放的血管活性物质、凝血酶级联放大反应、补体系统激活以及血肿分解产物均能够通过诱发炎症反应、促进神经元细胞凋亡造成脑组织损伤,进而降低患者神经功能[2]。白细胞介素-6(IL-6)属于促炎因子,在中枢神经系统小胶质细胞、星形胶质细胞、神经内皮细胞等,研究显示脑出血患者血肿周围脑组织IL-6表达升高,高水平IL-6能够诱导补体系统激活,进一步加重脑组织损伤和神经元细胞凋亡[3]。细胞因子信号传导抑制因子-3(SOCS-3)能够通过JAK/STAT通路负反馈调节IL-6表达并促进Th细胞生成和活化,进而抑制炎症反应和神经元细胞凋亡[4]。鼠神经生长因子(NGF)能够保护感觉神经元和交感神经元,减轻脑组织损伤程度,促进神经纤维再生和生长,有助于神经功能恢复,目前已经在神经中毒、周围神经损伤、颅脑外伤等疾病治疗中得以应用[5]。但目前关于NGF在脑出血治疗中的应用效果及相关机制研究较少,本研究采用腹腔注射NGF治疗对尾状核脑出血大鼠,观察脑组织炎症反应、神经元凋亡及IL-6、SOCS-3的影响,以探讨NGF对脑出血后脑损伤的改善效果和作用机制。现将研究内容和结果报道如下。
1 材料与方法
1.1 实验动物及分组
选择60只成年雄性SD大鼠,体重305~360 g,采用随机分组饲养,用动物实验中心的标准饲料喂养,自由饮水,饲养温度保持在20~25 ℃。采用随机数字表法将SD大鼠分为假手术组、模型组和NGF组,各20只。
1.2 模型建立及分组处理方法
非肝素化自体鼠尾血注入法建立的尾状核脑出血模型,具体方操作参照Xue M[6]等的方法:术前禁食12 h、禁水4 h,大鼠称重后,予以腹腔注射400 mg/kg水合氯醛(10%,m/v),麻醉成功后调整俯卧位并固定在定位仪上,保持头部正中位,前囟和后囟处于同一平面,并保持大鼠耳间线平面比其门齿钩平面高2.5 mm左右。剔除大鼠头顶毛发,碘伏消毒局部皮肤,以前囟中央作为原点,在前囟前约0.2 mm、中线向右旁约3.5 mm位置做一个1 mm小孔,将微量进样器置入约5 mm,即达尾状核位置。模型组和腹腔NGF注射组大鼠被缓慢注入50 μL自体鼠尾血;假手术组大鼠被缓慢注入50 μL无菌生理盐水,均在15~20 min完成注射,留针5 min后退出微量进样器,采用骨蜡封闭钻孔颅骨并缝合大鼠皮肤。术后大鼠清醒后采用Bederson[7]等的四级评分法对大鼠造模情况进行评价,若神经功能缺损症状≥1级则视为造模成功,剔除造模失败大鼠,以备用大鼠随机补充。
于大鼠脑出血模型建立30 min后给予NGF组大鼠腹腔注射5 μg/kg NGF[舒泰神(北京)药业有限公司,2 毫克/瓶,国药准字S20060023],给予假手术组、模型组大鼠腹腔注射5 μg/kg 生理盐水。
1.3 研究方法
各组分别于术后第1、3、5天随机选择5只大鼠,采用过量水合氯醛进行麻醉,迅速打开胸腔,自左心室灌注生理盐水,直至由剪开的右心耳流出的液体变为清亮为止,之后断头取脑,去除小脑、脑干、嗅球和额极前部约4 mm的脑组织,将右侧大脑半球中部进针位置周围脑组织冠状切割成2 mm的薄片2片,其中1片用于脑组织含水量测定,另一片经10%福尔马林固定和梯度酒精脱水后采用石蜡包埋,连续切成2 μm切片,用于HE染色、免疫组织化学检测等。(1)脑组织含水量检测:采用干湿重法测定大鼠脑组织含水量,置于称量瓶中,利用电子天平称取湿重,于105 ℃恒温肝脏箱内烘至恒重,再次称重。脑组织含水量(%)=(湿重-干重)/湿重×100%;(2)HE染色及炎症反应观察:选取一片2 μm切片经二甲苯脱蜡,乙醇脱苯后采用苏木素-伊红(HE)染色,制备好的玻片于100×光学显微镜下观察出血部位,调整至400×观察血肿周围脑组织病理变化和炎症反应情况,并与正常部位比较;(3)神经元细胞凋亡检测:每只大鼠随机选择5张切片采用TUNEL法检测神经元细胞凋亡,严格按照江苏凯基生物技术股份有限公司细胞凋亡原位检测试剂盒步骤进行操作,于400×光学显微镜下随机选择6个无重叠视野进行观察和计数,细胞核内有棕黄色颗粒者为TUNEL阳性凋亡细胞;(4)免疫组织化学染色检测:采用免疫组织化学法检测血肿周围脑组织IL-6和SOCS-3表达情况,实验操作步骤严格按照S-P免疫组化检测试剂盒说明书进行。采用PBS缓冲液代替一抗作为阴性对照,已知抗体阳性标本作为阳性对照。IL-6表达于细胞质中,SOCS-3表达在细胞质或细胞核中,相应位置表现为淡黄色至棕褐色即为阳性。于400×光学显微镜下随机选择6个无重叠视野进行观察和计数。
1.4 统计学方法
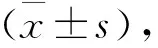
2 结 果
2.1 3组大鼠血肿周围脑组织含水量比较
假手术组大鼠术后3个时间点血肿周围脑组织含水量比较无显著差异(P>0.05);模型组和NGF组大鼠术后各时间点血肿周围脑组织含水量均显著高于假手术组(P<0.05),且均在术后3 d达到最高值,随后下降,但术后5 d时模型组和NGF组大鼠血肿周围脑组织含水量仍显著高于术后1 d(P<0.05);NGF组大鼠术后各时间点血肿周围脑组织含水数量均显著低于模型组(P<0.05),见表1。
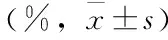
表1 3组大鼠血肿周围脑组织不同时间点含水量比较
2.2 3组大鼠血肿周围组织炎症反应比较
假手术组大鼠术后针孔周围脑组织结构清晰且完整,细胞形态正常、结构完整;神经元排列整齐,未见水肿和炎性细胞浸润。模型组和NGF组大鼠术后针孔周围脑组织可见炎性细胞浸润,脑细胞水肿和空泡样改变,细胞核发生一定程度固缩;细胞和血管周围间隙变宽,染色质密度增加,伊红染色增深。术后第1天时模型组和NGF组大鼠血肿周围表现为中性粒细胞增加,细胞水肿,神经元细胞部分坏死;术后第3天时可见明显细胞充血水肿,炎性细胞大量浸润,神经元细胞坏死,胶质细胞发生增生;术后第5天时炎性细胞数量减少,水肿程度减轻。NGF各时间点脑出血周围炎症、水肿程度、神经元细胞坏死程度均显著好于模型组,见图1~3。
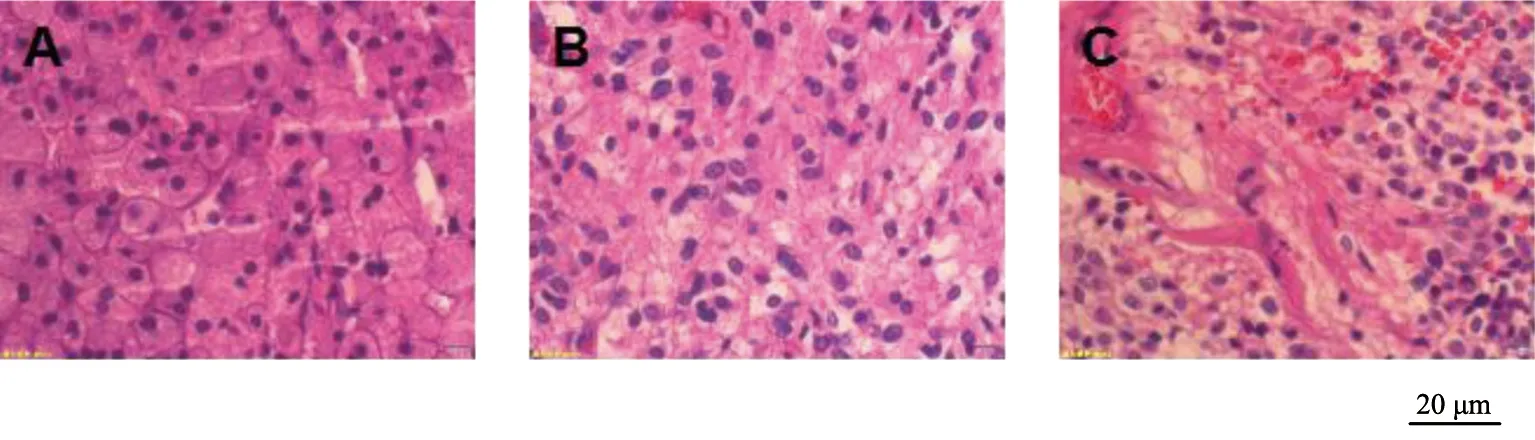
A为假手术组;B为模型组;C为NGF组图1 术后第1天各组HE染色

A为模型组;B为NGF组图2 术后第3天各组HE染色

A为模型组;B为NGF组图3 术后第5天各组HE染色
2.3 3组大鼠血肿周围脑组织细胞凋亡比较
假手术组大鼠术后3个时间点血肿周围脑组织神经元细胞TUNEL染色阳性率比较无显著差异(P>0.05);模型组和NGF组大鼠术后各时间点血肿周围脑组织神经元细胞TUNEL染色阳性率均显著高于假手术组(P<0.05),且均在术后第1天达到最高值,随后显著下降(P<0.05);NGF组大鼠术后各时间点血肿周围脑组织神经元细胞TUNEL染色阳性率均显著低于模型组(P<0.05),见图4~6、表2。
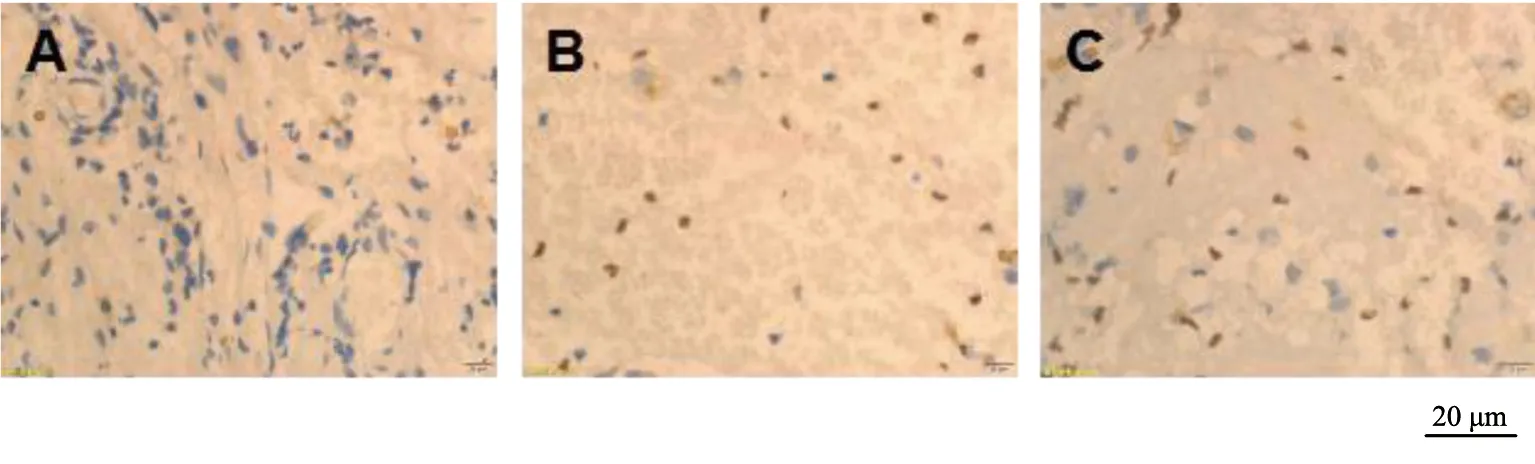
A为假手术组;B为模型组;C为NGF组图4 术后第1天各组TUNEL染色

A为假手术组;B为模型组;C为NGF组图5 术后第3天各组TUNEL染色
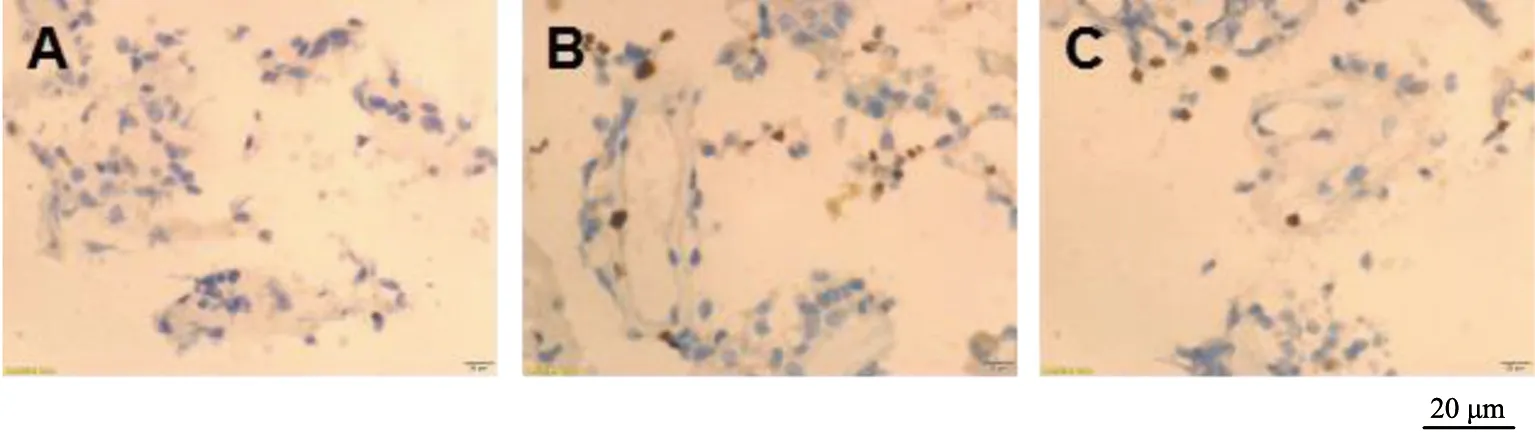
A为假手术组;B为模型组;C为NGF组图6 术后第5天各组TUNEL染色

表2 3组大鼠血肿周围脑组织不同时间点血肿周围脑组织神经元细胞TUNEL染色阳性数目(个,
2.4 3组大鼠血肿周围脑组织IL-6和SOCS-3表达情况比较
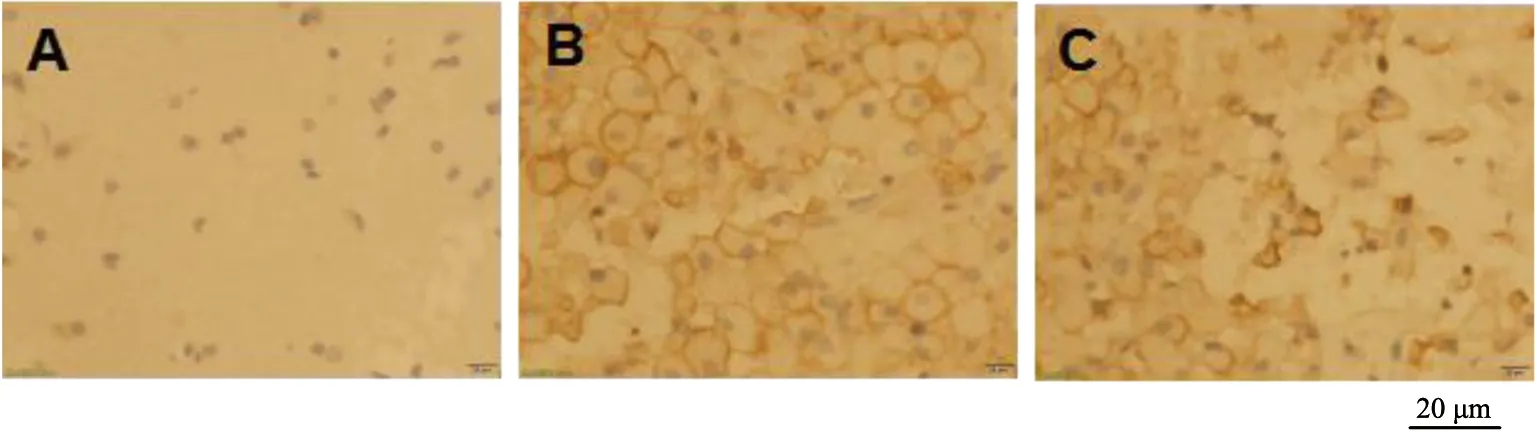
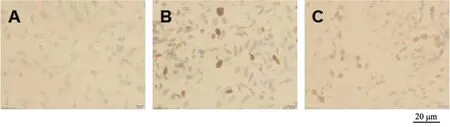
假手术组大鼠术后3个时间点血肿周围脑组织IL-6和SOCS-3染色阳性数目比较无显著差异(P>0.05);模型组和NGF组大鼠术后各时间点血肿周围脑组织IL-6和SOCS-3染色阳性数目均显著高于假手术组(P<0.05),且均在术后第3天达到最高值,术后第5天均显著降低(P<0.05),与术后第1天比较无显著差异(P>0.05)。NGF组大鼠术后各时间点血肿周围脑组织IL-6染色阳性数目显著低于模型组,但SOCS-3染色阳性数目显著高于模型组,差异有统计学意义(P<0.05),见图7~12和表3~4。
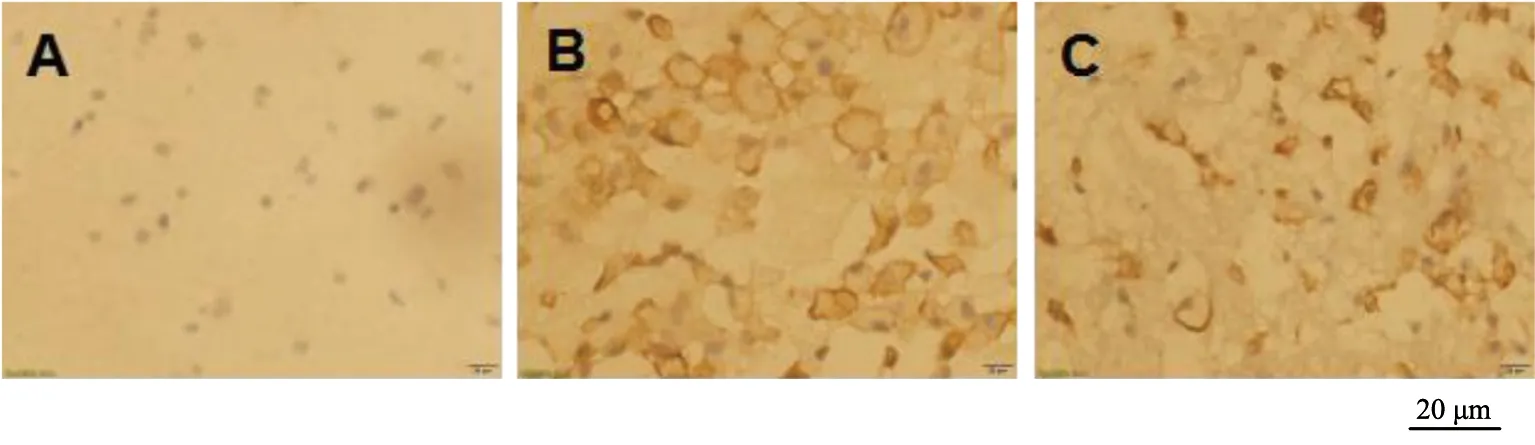
A为假手术组;B为模型组;C为NGF组图7 术后第1天各组IL-6染色
A为假手术组;B为模型组;C为NGF组图8 术后第3天各组IL-6染色

A为假手术组;B为模型组;C为NGF组图9 术后第5天各组IL-6染色
A为假手术组;B为模型组;C为NGF组图10 术后第1 天各组SOCS-3染色

A为假手术组;B为模型组;C为NGF组图11 术后第3天各组SOCS-3染色
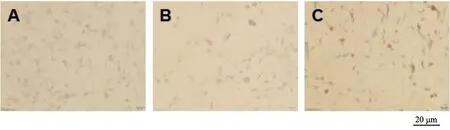
A为假手术组;B为模型组;C为NGF组图12 术后第5天各组SOCS-3染色

表3 3组大鼠血肿周围脑组织不同时间点血肿周围脑组织IL-6染色阳性数目(个,

表4 3组大鼠血肿周围脑组织不同时间点血肿周围脑组织SOCS-3染色阳性数目(个,
3 讨 论
脑出血后可通过多种途径引发脑组织损伤和炎性反应,进而造成脑水肿和神经元凋亡,影响患者神经功能。有研究表明脑出血后血肿周围脑组织炎症反应程度远高于非出血性脑损伤,引起的脑水肿更加严重[8]。本研究结果显示模型组和NGF组大鼠术后第1~5天血肿周围脑组织含水量均显著高于假手术组,术后第3天达到峰值,之后降低。与目前报道的脑出血后第2~3天神经功能障碍最严重,之后逐渐恢复相一致[9],也提示脑水肿程度能够直接反应神经功能损害。另外NGF组大鼠各时间点脑组织含水量显著低于模型组,也提示NGF能够降低脑出血大鼠脑组织含水量。本研究结果也发现NGF组和模型组大鼠血肿周围脑组织出现炎症、水肿、神经元细胞坏死等病理改变,而NGF组各项病理改变程度均低于模型组,与周仁兰等[10]研究结果一致。这与NGF能够抑制Ca2+超载,维持细胞内Ca2+浓度,并能够为神经元修复提供营养因子,促进轴突和神经纤维再生有关。
高水平IL-6能够通过以下途径介导脑损伤[11-12]:(1)破坏血脑屏障,提高其通透性,加重脑水肿程度,促进神经元凋亡;(2)诱导内皮细胞粘附分子(ICAM-1)表达,增加细胞间粘附性,造成细胞聚集,阻塞微血管;(3)增强中性粒细胞活性,加重炎症反应;(4)增加氧自由基产生和释放,加重脑细胞损伤;(5)激活补体系统,形成细胞毒性损伤。JAK/STAT是IL-6的重要调节通路,受SOCS家族的负反馈调节,其中以SOCS-3研究最多。本研究结果显示模型组和NGF组大鼠血肿周围脑组织IL-6和SOCS-3染色阳性细胞数目均显著高于假手术组(P<0.05),NGF组大鼠术后各时间点血肿周围脑组织神IL-6染色阳性细胞数目均显著低于模型组,但SOCS-3染色阳性细胞数目显著高于假手术组(P<0.05),提示NGF能够通过上调SOCS-3表达来下调IL-6表达,继而起到改善脑水肿作用。
本研究结果还显示,NGF组和模型组大鼠各时间点血肿周围组织神经元凋亡数目显著高于假手术组,且均在术后第1天达到最高值,随后显著下降(P<0.05)。与Karwacki Z等[13]研究结果相符。而NGF组大鼠术后各时间点血肿周围脑组织神经元细胞TUNEL染色阳性率均显著低于模型组(P<0.05),与NGF能够调控SOCS-3和IL-6表达减轻炎症反应和脑水肿有关。
综上所述,NGF可能通过上调SOCS-3表达,下调IL-6表达改善脑出血后脑组织炎症反应、减少神经元凋亡等途径发挥神经功能保护作用。

