miR⁃126、Lp⁃PLA2和TNF⁃α在急性脑梗死中的表达及临床意义
胡占斌 曹丹丹 李豪威
急性脑梗死(Acute cerebral infarction,ACI)是脑部血供突然中断后导致的脑组织坏死,多数患者经治疗后仍会遗留后遗症,对生活质量造成严重影响[1]。微小RNA(micro RNA,miRNA)是一类丰富内源性、非编码的RNA,在中枢神经系统损伤后会发生改变,可调节炎症、凋亡及氧化应激导致的神经元死亡过程[2]。脂蛋白磷脂酶A2(Lipopro⁃tein phospholipase A2,Lp⁃PLA2)是一种血管特异性炎症标志物,既往研究显示,Lp⁃PLA2 是导致动脉粥样硬化形成的危险因素之一,亦会增加脑血管疾病发生风险[3]。近年来,随着对脑缺损损伤机制的不断深入研究,脑缺血早期白细胞浸润引发的炎症反应备受临床关注,其中肿瘤坏死因子(Tumor ne⁃crosis factor⁃α,TNF⁃α)与炎症反应存在密切联系,研究认为其在ACI 进展中发挥重要作用[4]。本研究就ACI 患者miR⁃126、Lp⁃PLA2、TNF⁃α 水平变化情况进行了观察,旨在探讨上述因子在ACI 发病及病理生理过程中的作用机制。
1 资料与方法
1.1 一般资料
选取2019年9月至2021年9月漯河市第三人民医院收治的119 例ACI 患者纳入ACI 组。纳入标准:①均符合ACI 相关诊断标准[5];②年龄18~80 岁;③初次发病,发病时间<4.5 h;④临床资料完整,无缺损或丢失。排除标准:①存在颅内出血、颅内肿瘤等;②存在全身严重感染疾病史;③合并活动性出血、严重创伤者;④伴精神疾病、晚期恶性肿瘤者。其中男75 例,女44 例,平均年龄(51.36±8.47)岁;既往史:高血压43例,糖尿病33 例。另选取同期于本院进行健康体检的62 例健康者作为对照组,男42 例,女20例,平均年龄(52.15±9.32)岁。两组一般资料比较差异无统计学意义(P>0.05)。本研究经院医学伦理委员会批准通过,受试者或家属已签署知情同意书。
1.2 方法
1.2.1 miR⁃126、Lp⁃PLA2、TNF⁃α 检测
采集两组受检者晨起空腹静脉血5 mL,以4 000 r/min 离心10 min(离心半径10 cm),分离上层血清,采用EP 管进行分装,置于-80℃低温保存备用。采用酶联免疫吸附法检测Lp⁃PLA2、TNF⁃α水平,试剂盒由武汉菲恩生物科技有限公司提供,货号EH0302;检测仪器为芬兰雷勃公司提供的全自动酶联仪。详细步骤严格按照说明书操作。采用实时荧光定量PCR 法检测miR⁃126。取250 μL血清样本用蛋白酶K 溶解后56℃水浴2 h,按照Trizol 试剂说明提取血浆总RNA。取总RNA 样品2 μL 加入水、缓冲液、RNA 酶抑制剂、dNTP Mix及逆转录茎环引物共计10 μL,离心后在PCR 仪中反应,反应条件为37℃,反应时间为60 min,所得产物置-4℃冷藏箱内保存。以GAPDH 为内参照物,以荧光定量检测试剂盒进行检测,引物分别为:上游5′⁃GGGGTCGTACCGTT⁃3′,下游5′⁃CAGTGCGTGTCGTGGAGT⁃3′,反应预变性设定反应条件为94℃,反应时间为2 min,继以94℃20 s,60℃36 s,共进行45 个循环,以2⁃ΔΔCT法计算miR⁃126 相对表达水平。
1.2.2 病情评估及随访
1.2.2.1 梗死面积[6]经头颅CT、MRI 检查后评估,将ACI 组分为:小面积梗死:梗死面积<1.5 cm(小面积组);中面积梗死:梗死面积1.5~3 cm(中面积组);大面积梗死:梗死面积>3 cm 且累及两个以上解剖部位(大面积组)。
1.2.2.2 神经缺损程度 采用美国国立卫生研究院卒中量表(National institutes of health stroke scale,NIHSS)量表[7]评估,将ACI 组分为:轻度组:NIHSS 评分≤4 分,中度组:NIHSS 评分5~15 分,重度组:NIHSS 评分≥16 分。
1.2.2.3 预后随访 采用电话或门诊随访方式对患者进行3 个月随访,随访截止至2021年9月,根据患者预后情况将ACI 组分为生存组和死亡组。
1.3 统计学方法
采用SPSS 22.0 统计软件进行统计分析,计量资料以()表示,组间比较行t检验,多组间比较采用方差分析;以P<0.05 为差异具有统计学意义。
2 结果
2.1 两组miR⁃126、Lp⁃PLA2、TNF⁃α 水平比较
ACI组miR⁃126水平明显低于对照组,Lp⁃PLA2、TNF⁃α 水平明显高于对照组,差异均有统计学意义(P<0.05)。见表1。
表1 两组miR⁃126、Lp⁃PLA2、TNF⁃α 水平比较(±s)Table 1 Comparison of the levels of miR⁃126,Lp⁃PLA2 and TNF⁃α between the two groups(±s)
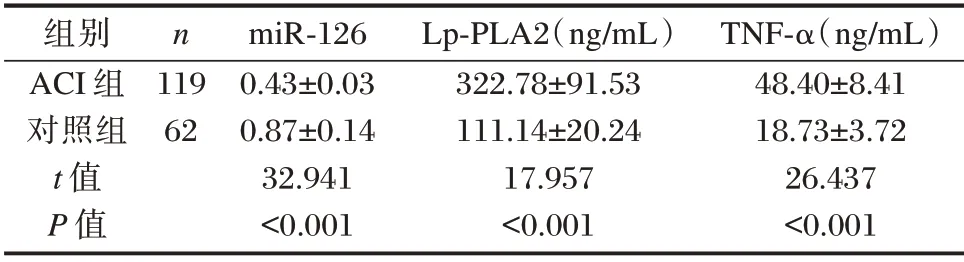
表1 两组miR⁃126、Lp⁃PLA2、TNF⁃α 水平比较(±s)Table 1 Comparison of the levels of miR⁃126,Lp⁃PLA2 and TNF⁃α between the two groups(±s)
组别ACI 组对照组t 值P 值n 119 62 miR⁃126 0.43±0.03 0.87±0.14 32.941<0.001 Lp⁃PLA2(ng/mL)322.78±91.53 111.14±20.24 17.957<0.001 TNF⁃α(ng/mL)48.40±8.41 18.73±3.72 26.437<0.001
2.2 ACI 不同梗死面积患者miR⁃126、Lp⁃PLA2、TNF⁃α 水平比较
ACI 患者中,小面积梗死者46 例(小面积组),中面积梗死者35 例(中面积组),大面积梗死者38例(大面积组)。不同梗死面积患者miR⁃126 水平比较:小面积组>中面积组>大面积组,Lp⁃PLA2、TNF⁃α 水平比较:小面积组<中面积组<大面积组,差异均有统计学意义(P<0.05)。见表2。
表2 ACI 不同梗死面积患者miR⁃126、Lp⁃PLA2、TNF⁃α水平比较(±s)Table 2 Comparison of miR⁃126,Lp⁃PLA2 and TNF⁃α levels in patients with different infarct sizes in ACI(±s)
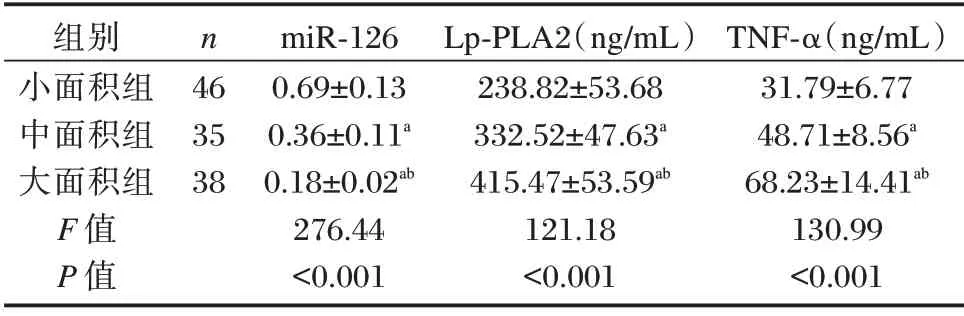
表2 ACI 不同梗死面积患者miR⁃126、Lp⁃PLA2、TNF⁃α水平比较(±s)Table 2 Comparison of miR⁃126,Lp⁃PLA2 and TNF⁃α levels in patients with different infarct sizes in ACI(±s)
注:a与小面组比较,b与中面积组比较,P<0.05。
2.3 ACI 不同神经功能缺损程度患者miR⁃126、Lp⁃PLA2、TNF⁃α 水平比较
ACI 患者中,神经功能轻度缺损者49 例(轻度组),中度缺损者35 例(中度梗死组),重度缺损者35 例(重度组)。不同神经功能缺损程度患者miR⁃126 水平比较:轻度组>中度组>重度组,Lp⁃PLA2、TNF⁃α 水平比较:轻度组<中度组<重度组,差异均有统计学意义(P<0.05)。见表3。
表3 ACI 不同神经功能缺损程度患者miR⁃126、Lp⁃PLA2、TNF⁃α 水平比较(±s)Table 3 Comparison of miR⁃126,Lp⁃PLA2 and TNF⁃α levels in patients with different neurological deficits in ACI(±s)
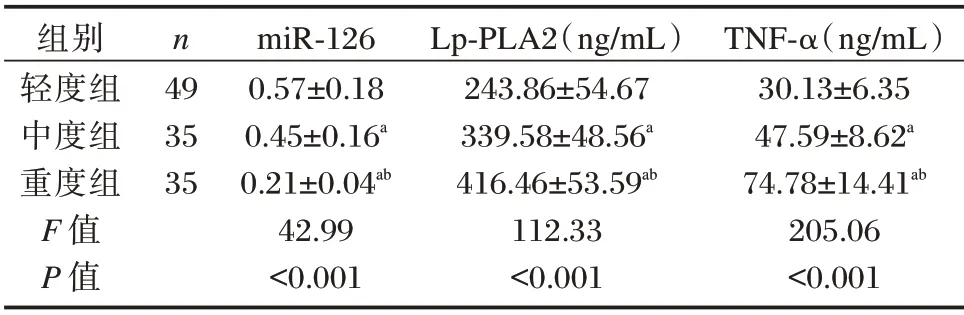
表3 ACI 不同神经功能缺损程度患者miR⁃126、Lp⁃PLA2、TNF⁃α 水平比较(±s)Table 3 Comparison of miR⁃126,Lp⁃PLA2 and TNF⁃α levels in patients with different neurological deficits in ACI(±s)
注:a与轻度组比较,b与中度组比较,P<0.05。
组别轻度组中度组重度组F 值P 值n 49 35 35 miR⁃126 0.57±0.18 0.45±0.16a 0.21±0.04ab 42.99<0.001 Lp⁃PLA2(ng/mL)243.86±54.67 339.58±48.56a 416.46±53.59ab 112.33<0.001 TNF⁃α(ng/mL)30.13±6.35 47.59±8.62a 74.78±14.41ab 205.06<0.001
2.4 ACI 不同预后结局患者miR⁃126、Lp⁃PLA2、TNF⁃α 水平比较
ACI 患者中,预后生存者99 例(生存组),死亡者20 例(死亡组)。生存组miR⁃126 水平明显高于死亡组,Lp⁃PLA2、TNF⁃α 水平低于死亡组,差异均有统计学意义(P<0.05)。见表4。
表4 ACI 不同预后结局患者miR⁃126、Lp⁃PLA2、TNF⁃α水平比较(±s)Table 4 Comparison of miR⁃126,Lp⁃PLA2 and TNF⁃α levels in patients with different prognostic outcomes of ACI(±s)
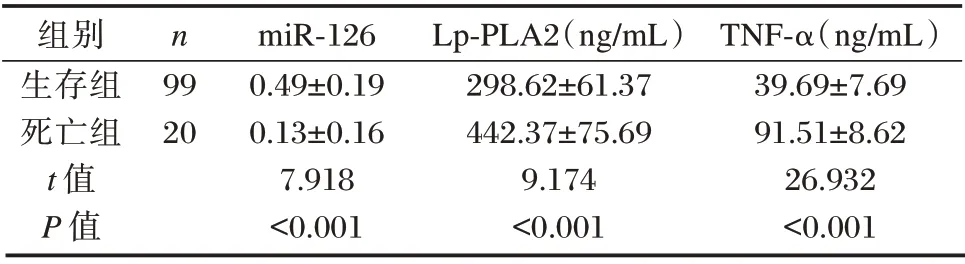
表4 ACI 不同预后结局患者miR⁃126、Lp⁃PLA2、TNF⁃α水平比较(±s)Table 4 Comparison of miR⁃126,Lp⁃PLA2 and TNF⁃α levels in patients with different prognostic outcomes of ACI(±s)
3 讨论
ACI 患者由于脑部局灶性血运减少,导致周围神经元细胞、神经胶质细胞等受损,易诱发感觉、运动异常,甚至出现意识障碍,危及生命[8]。
既往报道显示,中枢神经系统中可见miRNA表达,miRNA 在神经系统疾病发生、发展中具有重要作用[9]。miR⁃126 是内皮细胞最丰富的miR⁃NA,具有miR⁃126⁃3p、5p 两条成熟链,在血管生成中具有重要作用[10]。张翠等[11]研究发现,ACI 患者miR⁃126 水平明显增高,通过抑制血清miR⁃126水平可降低ACI 患者病情严重程度。本研究与上述报道相符,且miR⁃126 水平会随ACI 梗死面积增大、神经缺损程度加剧不断增高,说明miR⁃126与ACI 病情严重程度、血脑屏障破坏程度存在紧密联系。考虑其原因可能是由于血清miR⁃126 表达主要存在血管内皮细胞内,可多方面调节维持内皮细胞,如细胞增殖、迁移等;在ACI 作用下内皮细胞分泌miR⁃126 受到抑制,导致血清miR⁃126存在差异。通过进一步预后随访发现,与存活患者相比,死亡组miR⁃126 水平更低,表明miR⁃126与患者预后亦存在关联,可能可作为预后评估的重要指标。
Lp⁃PLA2 主要由炎性细胞分泌,如淋巴细胞、巨噬细胞;同时Lp⁃PLA2 是与低密度脂蛋白C 水解氧化生成促炎物质相关的酶[12]。Perrot 等[13]发现,Lp⁃PLA2 除与血管炎性反应存在密切联系外,在促进动脉粥样硬化、不稳定斑块形成中也具有重要作用。既往研究发现,冠心病患者中TNF⁃α 水平明显增高,与低密度脂蛋白等脂质成分有关,可促进冠心病发展[14]。郭鹏等[15]研究则发现,TNF⁃α 水平在老年ACI 患者中明显增高,在ACI 进展中可能发挥促炎作用。本研究结果显示,ACI 组Lp⁃PLA2、TNF⁃α 水平明显高于对照组,且Lp⁃PLA2、TNF⁃α水平越高ACI 患者梗死体积越大,神经功能缺损越严重,预后更差,表明Lp⁃PLA2、TNF⁃α 水平可在一定程度上反映患者病情进展情况,并可为预后评估提供参考。分析其原因可能是低密度脂蛋白的氧化过程中,经Lp⁃PLA2 作用后产生了自由脂肪酸、溶血磷脂脂酰胆碱两种促炎产物,进而刺激黏附因子及细胞因子产生;而TNF⁃α 可能通过影响炎症反应、血栓形成、神经毒性物质释放等过程,促进ACI 发生,加速病情进展[16]。
综上所述,ACI 患者血清miR⁃126、Lp⁃PLA2、TNF⁃α 水平存在异常表达,且与患者梗死面积、神经功能缺损程度及预后存在紧密联系,可作为病情监测、预后评估的辅助指标。

