彩色多普勒超声引导下动静脉内瘘球囊扩张术在尿毒症维持性血液透析患者中的应用效果
曲矿云,杨雅丽,秦洋,王慧,鲍旭波,张朝平
(黄河三门峡医院 肾内科,河南 三门峡 472000)
维持性血液透析(maintenance hemodialysis,MHD)是现阶段尿毒症最主要的治疗手段,通过代替肾脏维持机体代谢,减轻病情,延长患者生命[1]。动静脉内瘘(arteriovenous fistulas,AVF)是尿毒症患者MHD的首选血管通路,随着MHD患者年龄增加及MHD负担增大,患者AVF狭窄发生率随之增高[2]。AVF狭窄是造成血管通路功能丧失的主要原因,占AVF患者的50%以上,可影响MHD效果,威胁患者生命[3]。目前临床针对AVF狭窄以手术为主,但不同术式其效果不尽相同[4]。基于此,本研究选取92例MHD尿毒症患者,分别采用内瘘切除修复术及彩色多普勒超声(color doppler flow imaging,CDFI)引导下AVF球囊扩张术(percutaneous transluminal angioplasty,PTA)治疗,旨在分析CDFI引导下AVF PTA的临床效果及优势。现报告如下。
1 资料与方法
1.1 一般资料选取2018年1月至2021年1月黄河三门峡医院收治的92例尿毒症MHD并发AVF患者作为研究对象,根据治疗方法分为常规组(46例)和试验组(46例)。常规组:男25例,女21例;年龄36~65(51.76±6.39)岁;MHD时间8~27(18.73±3.49)个月;AVF发生时间2~5(3.56±0.69)周;原发病肾小球肾炎19例,糖尿病肾脏疾病14例,多囊肾8例,梗阻性肾病5例。试验组:男22例,女24例;年龄37~68(52.63±7.13)岁;MHD时间8~29(19.46±4.12)个月;AVF发生时间1~5(3.42±0.73)周;原发病肾小球肾炎21例,糖尿病肾脏疾病11例,多囊肾6例,梗阻性肾病8例。两组一般资料比较,差异无统计学意义(P>0.05)。
1.2 诊断标准符合第1版《中国血液透析用血管通路专家共识》[5]中AVF诊断标准,术前经CDFI检测内瘘管腔狭窄>50%,透析血流量<200 mL·min-1,举臂试验呈阳性。
1.3 纳入及排除标准
1.3.1纳入标准 (1)符合上述诊断标准;(2)血管无先天畸形;(3)符合PTA适应证;(4)首次出现AVF;(5)患者及家属签署知情同意书。
1.3.2排除标准 (1)血液系统疾病或免疫功能异常;(2)合并严重心脑血管疾病;(3)存在智力缺陷影响沟通;(4)资料欠缺,不能满足随访要求;(5)恶性肿瘤;(6)存在手术禁忌证。
1.4 手术方法
1.4.1术前准备 (1)基础检查:血常规、凝血功能、心功能。(2)采用CDFI诊断仪(MyLab Alpha eHD)对AVF进行检测。
1.4.2常规组 接受内瘘切除修复术。患者取仰卧位,以盐酸利多卡因注射液(福安药业集团宁波天衡制药有限公司,国药准字H33022559)行局部麻醉,消毒铺巾;于内瘘狭窄处皮肤行切口,分离皮肤,离断浅筋膜与脂肪组织连接处的内瘘静脉端,向吻合口方向进行分离,剪开深筋膜;静脉远端狭窄处结扎,桡动脉使用止血夹,使用肝素盐水扩张静脉近端,切除静脉狭窄段;修整静脉血管,以血管缝合线连续吻合静脉端及动脉端;松开止血夹,确定吻合口无活动性出血,清理术区,逐层缝合切口。
1.4.3试验组 接受CDFI引导下AVF PTA术。患者取仰卧位,穿刺点消毒,局部麻醉;以CDFI引导,于内瘘流出通道穿刺,置入导管鞘;经导管鞘将超滑导丝推送至狭窄方向(血管成角、迂曲、闭塞区采用高硬度导丝);通过狭窄部位后,沿超滑导丝置入球囊,球囊直径为正常管径的1.1倍;超声引导将球囊置于内瘘狭窄部位;球囊导管连接注入生理盐水的生理泵,向球囊注水,根据实际情况调节压力值(10~16 Kpa),反复进行,每次1~2 min,待球囊完全打开后停止操作;此阶段充分扩张血管,然后抽水使球囊萎缩,退出导管鞘,对穿刺口加压包扎。
1.5 观察指标(1)内瘘畅通率、手术成功率。手术标准[5]:成功,即狭窄血管内径增大,血流增加,可满足MHD要求,血流量≥200 mL·min-1;未达上述标准则为手术失败。(2)手术前后血流情况。采用CDFI诊断仪检测患者血管内径、透析血流量、内瘘血流量、峰值流速。(3)术后并发症发生情况。包括静脉撕裂、血肿、感染、神经损伤、假性动脉瘤等。(4)再狭窄发生情况。通过门诊或电话随访6个月,对比两组再狭窄发生情况。
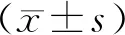
2 结果
2.1 手术成功率试验组内瘘畅通率、手术成功率高于常规组,差异有统计学意义(P<0.05)。见表1。

表1 两组内瘘畅通率、手术成功率比较[n(%)]
2.2 血流指标术前,两组血管内径、透析血流量、内瘘血流量、峰值流速对比,差异无统计学意义(P>0.05);术后,两组血管内径增大,透析血流量、内瘘血流量升高,峰值流速降低,且试验组血管内径大于常规组,透析血流量、内瘘血流量高于常规组,峰值流速低于常规组,差异有统计学意义(P<0.05)。见表2。
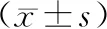
表2 两组血流指标对比
2.3 术后并发症情况试验组术后并发症发生率低于常规组,差异有统计学意义(P<0.05)。见表3。

表3 两组术后并发症发生率比较[n(%)]
2.4 术后再狭窄情况随访期间两组均无脱落病例。术后1个月,两组再狭窄发生率比较,差异无统计学意义(P>0.05);术后6个月,试验组再狭窄发生率低于常规组,差异有统计学意义(P<0.05)。见表4。

表4 两组术后再狭窄发生率比较[n(%)]
3 讨论
尿毒症是严重危害人们健康及生命的常见病之一,其发病率随着环境恶化及生活方式改变呈上升趋势[6]。血管通路称为尿毒症患者的治疗生命线,但患者在MHD过程中易出现AVF闭塞、狭窄等情况,导致供血不足,更有甚者形成血栓,影响血液透析进行[7]。内瘘切除修复术是临床常用的术式之一,通过切除血管异常部位,重建动静脉血管通路,进而为血液透析创造有利条件[7]。但在实际应用中仍存在不足,如AVF恢复时间较长,影响MHD效果;手术创伤较高,出血量、感染风险较高;该术消耗血管资源,造成新吻合口再狭窄的发生,致使患者丧失再手术机会[8-9]。随着医疗科技的发展,微创手术逐渐应用于临床,且取得良好的手术效果。
CDFI引导下AVF PTA是常用的微创技术,经超声引导穿刺血管,置入球囊,扩张AVF狭窄部位,能有效解决血管功能异常问题,是现阶段临床治疗MHD患者MHD的首选手术方案[10]。与切除修复术相比,具有以下优势:(1)安全可靠,操作简单,利于手术进行,且多处狭窄患者可多点扩张;(2)手术创伤较小,能降低出血量,减少术后并发症的发生;(3)不会对血管自身造成损耗,保证血管完整性,缩短术后首次MHD时间;(4)不使用对比剂即可直视操作,避免对比剂加重透析负担[11-12]。本研究对MHD患者AVF狭窄实施不同的手术方案,结果显示试验组内瘘畅通率、手术成功率高于常规组,术后并发症发生率低于常规组,可见采用CDFI引导下PTA治疗AVF狭窄患者,能提高手术效率,降低术后并发症发生风险。
维持血管通路是充分血液透析的必要条件,良好的血管通路才能增强溶质清除率,提高MHD质量[13]。研究显示,术后患者血管内径、透析血流量、内瘘血流量及峰值流速均较术前改善,且与常规组相比,试验组改善更明显,提示采用CDFI引导PTA在改善血液循环方面具有优势,利于MHD的实施。本研究结果显示,2种手术方案治疗AVF狭窄的短期效果良好,但随着时间推移,常规组再狭窄发生率高于试验组,其原因可能在于动静脉在修复中可致血管内膜增生,纤维组织增生及形成血管壁,增加再狭窄风险[14]。行CDFI引导下PTA时应注意[15]:(1)选择合适球囊直径及控制球囊扩张速率,避免血管破裂风险;(2)注意术后穿刺点出血、感染等情况,避免患者血管壁弹性脆弱引起血肿。
综上所述,与瘘口切除修复术相比,对尿毒症MHD AVF患者AVF狭窄实施CDFI引导PTA术效果较好,内瘘畅通率、手术成功率较高,能够改善患者血流情况,为MHD实施创造有利条件,在一定程度上缓解AVF再狭窄情况,安全性较高,临床值得应用推广。

