外源H2O2引发对燕麦种胚细胞AsA-GSH循环的影响
李红玉, 王雅聪, 曾 佳, 王聪聪, 董宽虎, 夏方山*
(1.山西农业大学科研管理部, 山西 太谷 030801; 2.山西农业大学草业学院, 山西 太谷 030801;3.中国农业大学草业科学与技术学院, 北京 100193)
种子是现代农牧业生产过程中最重要的基础性资料,其质量好坏是决定农牧业发展质量高低的关键所在[1-2]。种子活力会在发育成熟后的贮藏过程中不断丧失,而活性氧(Reactive oxygen species,ROS)过量累积被认为是种子活力丧失的主要原因[3],H2O2是动植物体内调控ROS平衡的动态核心,其含量升高被认为是直接导致种子活力丧失的决定因素[4-5]。然而,H2O2又是一种参与植物调节生长发育的小分子信号物质,其具有维持植物细胞稳态的作用,能够促进种子萌发及幼苗根系生长,并提高植物抗逆生长能力[6]。研究发现,H2O2的生理生化作用具有浓度效应,低浓度会发挥促进作用,而高浓度则会起抑制作用[7-9],此外,外源H2O2处理对植物种子萌发及幼苗生长的影响与植物种类(品种)及引发时间关系密切,且其作用机理目前仍不明确[10]。研究燕麦(Avenasativa)种子老化发现,H2O2含量升高是导致其活力降低的主要原因,这主要是由种胚细胞及线粒体内抗坏血酸-谷胱甘肽(Ascorbic acid-glutathione,AsA-GSH)循环抗氧化能力降低而导致了脂质过氧化损伤加剧造成的[10-13]。高浓度外源H2O2长时间处理也会造成燕麦种子活力的丧失[9],且外源H2O2处理对种子抗氧化酶的影响虽已在植物萌发及其幼苗抗盐碱[6-7]及抗寒[8]等方面有了报道,但关于内外源H2O2影响种子胚细胞AsA-GSH循环的异同关系仍未见报道。因此,本试验以燕麦种子为材料,探讨外源H2O2对其ASA-GSH循环抗氧化酶活性的影响,以期验证H2O2调节种子活力的抗氧化机理,从而为详细阐明H2O2影响种子老化的内在机理研究提供理论依据。
1 材料与方法
1.1 材料来源
供试种子为‘太阳神’燕麦,于2018年3月购买自北京正道农业股份有限公司,种子初始发芽率为98%左右,初始含水量为7.8%(鲜重基础)左右,-20℃条件保存至2018年5月试验进行。
1.2 H2O2引发处理
参照文献[14]的方法将燕麦种子含水量调整至10%(鲜重基础)左右,将每份约10 g左右燕麦种子在室温黑暗条件下分别用200 mL不同浓度(0,0.96,1.92,3.84和7.68 mol·L-1)的H2O2浸泡0,6,12和18 h,再用蒸馏水冲洗3次并用滤纸吸干表面水分,最后置于黑暗室温条件下干燥2 d,使其含水量降至约10%左右(鲜重基础),于4℃下密封保存备用,用于后续试验。
1.3 指标测定
粗酶液的提取参考Kibinza等[15]的方法进行,在室温条件下用蒸馏水吸胀4 h(胚根为突破种皮)后剥取100个种胚冰浴研磨,每个处理重复4次。超氧化物歧化酶(Superoxide dismutase,SOD)的活性测定参照Rao和Sresty[16]的方法,过氧化氢酶(Catalase,CAT)的活性测定参照Clairbone[17]的方法,谷胱甘肽还原酶(Glutathione reductase,GR)的活性测定参照Esterbauer和Grill[18]的方法,抗坏血酸过氧化物酶(Ascorbate peroxidase,APX)和脱氢抗坏血酸还原酶(Dehydroascorbate reductase,DHAR)的活性测定参照Nakano和Asada[19]的方法,单脱氢抗坏血酸还原酶(Monodehydroasorbate reductase,MDHAR)的活性测定参照Arrigoni等[20]的方法,H2O2和可溶性蛋白含量测定均使用购买自南京建成生物工程研究所的试剂盒进行,丙二醛(Malondialdehyde,MDA)的含量测定则参照Bailly等[21]的方法。
1.4 数据分析
试验数据采用Excel 2010和SPSS 21.0统计分析软件进行数据整理和方差分析,之后用Duncans法(P<0.05)进行多重比较,结果以平均值±标准误表示。
2 结果与分析
2.1 外源H2O2引发对燕麦种胚细胞SOD活性的影响
由图1可知,引发6 h时,燕麦种胚细胞SOD活性随H2O2浓度增加而升高,浓度0.96~ 7.68 mol·L-1间均差异显著(P<0.05);引发12和18 h时,其SOD活性随H2O2浓度增加呈先升后降的趋势,且各浓度间均存在显著差异(P<0.05),分别在1.92和0.96 mol·L-1时达到最大值。浓度为0.96 mol·L-1时,其SOD活性随引发时间延长呈显著升高趋势(P<0.05);浓度为1.92~7.68 mol·L-1时,其SOD活性随引发时间延长呈先升后降趋势,各引发时间下均显著高于CK(P<0.05),浓度为1.92,3.84和7.68 mol·L-1时分别在引发12,6和6 h达到最大值。
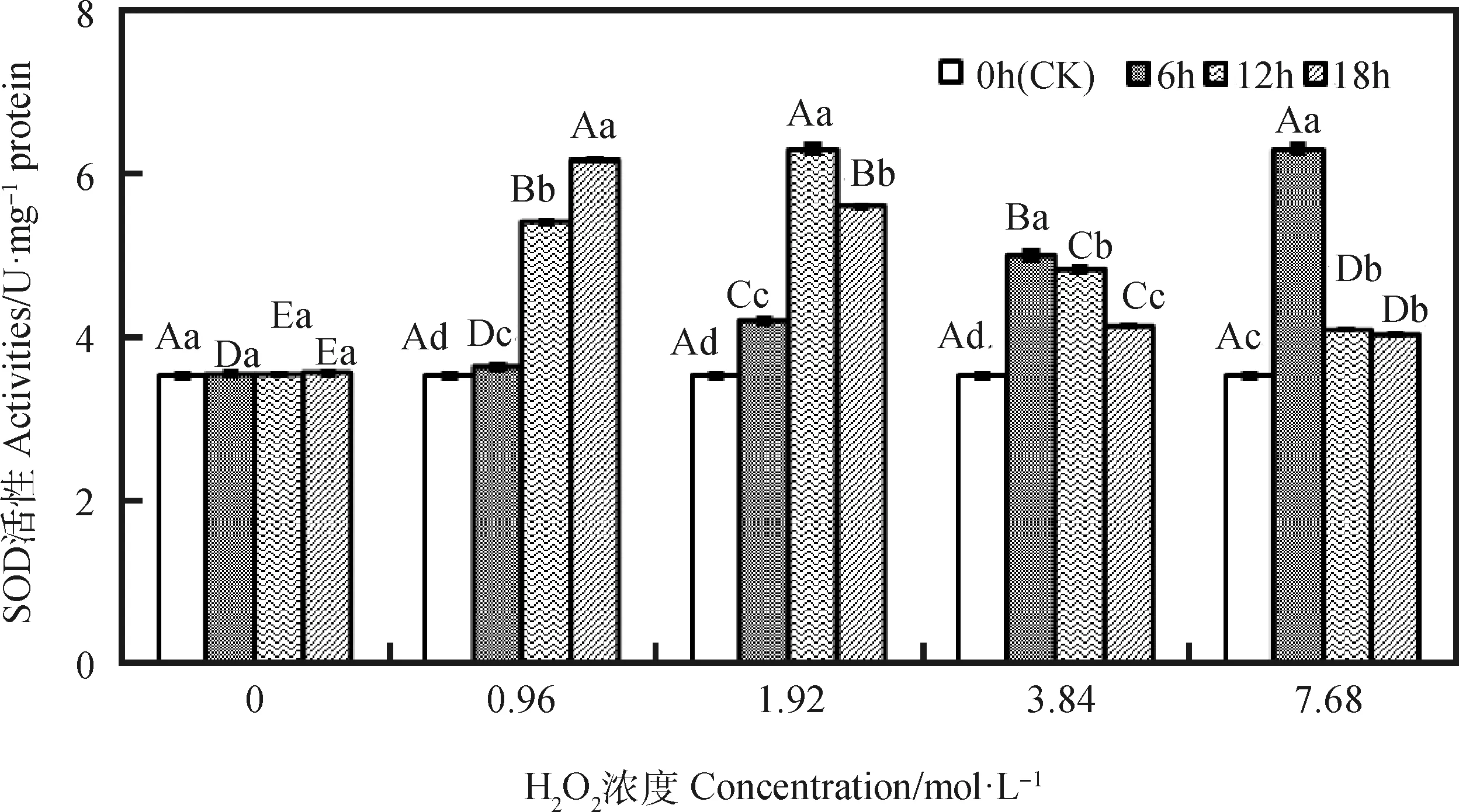
图1 外源H2O2引发下燕麦种胚细胞SOD活性变化Fig.1 Changes of SOD activities in embryonic cells of oat seeds under exogenous H2O2 priming注:不同大写字母表示同一引发时间下不同浓度间差异显著(P<0.05);不同小写字母表示同一浓度下不同引发时间间差异显著(P<0.05),下图同Note:Means with different capital letters are significant differences between different concentrations under same priming time at the 0.05 level;means with different small letters are significant differences between different priming time under same concentrations at the 0.05 level, the same as below
2.2 外源H2O2引发对燕麦种胚细胞CAT活性的影响
由图2可知,引发6~18 h时,燕麦种胚细胞CAT活性均随H2O2浓度增加呈先升后降的趋势;引发6 h时其在1.92和3.84 mol·L-1显著高于其他浓度(P<0.05),而引发12和18 h时则均在0.96 mol·L-1显著高于其他浓度(P<0.05)。浓度为0和0.96 mol·L-1时,燕麦种胚细胞CAT活性随引发时间延长而显著升高(P<0.05);浓度为1.92~7.68 mol·L-1时,其CAT活性均随引发时间延长呈先升后降趋势,并在引发6 h时显著高于其他引发时间(P<0.05),且同一H2O2浓度下各引发时间存在显著差异(P<0.05),且均显著高于CK(P<0.05)。
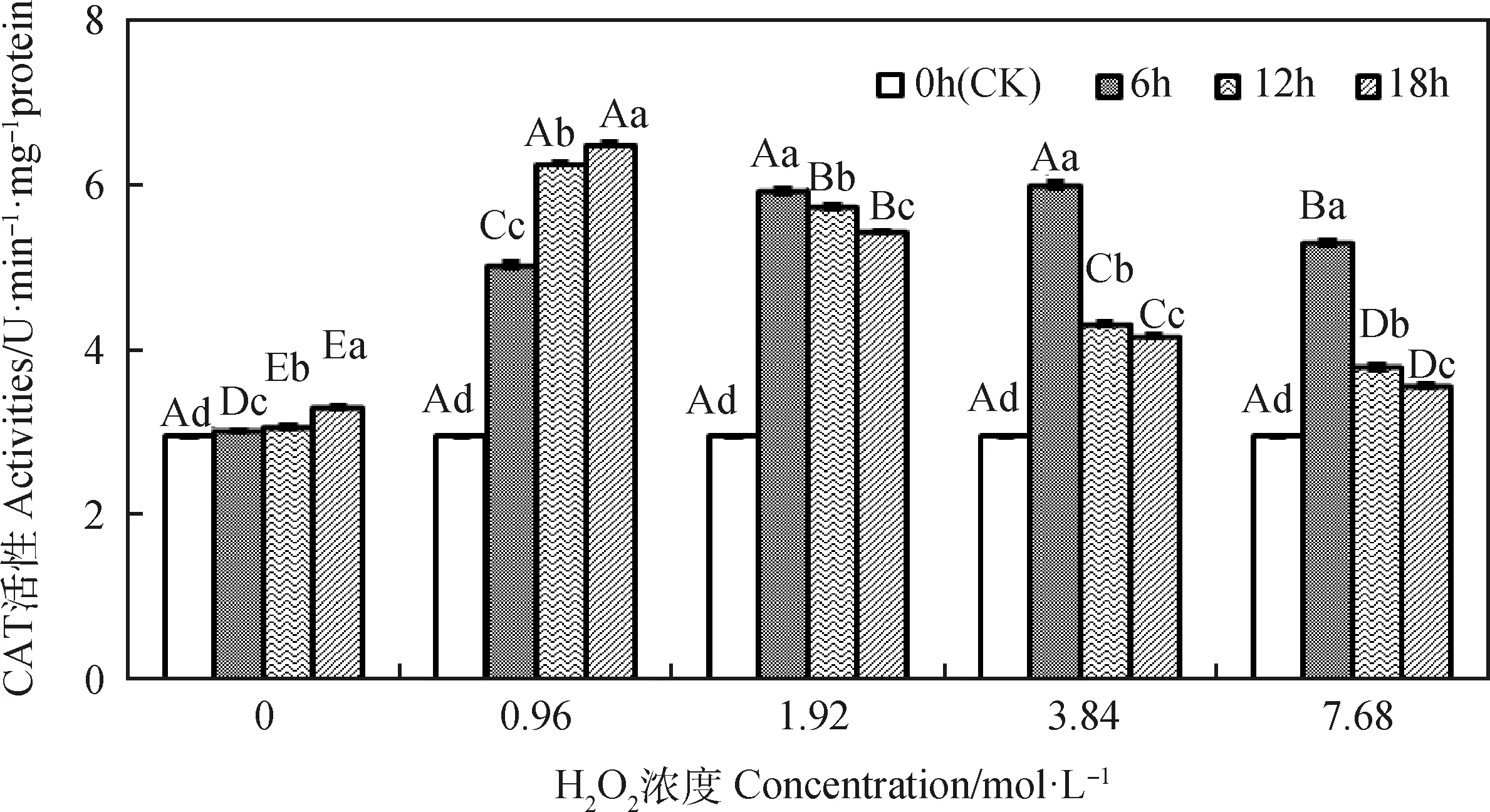
图2 外源H2O2引发下燕麦种胚细胞CAT活性变化Fig.2 Changes of CAT activities in embryonic cells of oat seeds under exogenous H2O2 priming
2.3 外源H2O2引发对燕麦种胚细胞APX活性的影响
由图3所示,引发6~18 h时,燕麦种胚细胞APX活性均随H2O2浓度增加呈先升后降的趋势,且均在0.96 mol·L-1时显著高于其他浓度(P<0.05);引发6 h时,其在7.68 mol·L-1时显著低于0 mol·L-1时(P<0.05);引发12 h时,其在3.84和7.68 mol·L-1时显著低于0 mol·L-1时(P<0.05);引发18 h时,其在1.92~7.68 mol·L-1时均显著低于0 mol·L-1时(P<0.05)。浓度为0~3.84 mol·L-1时,燕麦种胚细胞APX活性随引发时间延长呈先升后降趋势;浓度为0.96 mol·L-1时其APX活性在各引发时间下均显著高于CK(P<0.05),并在引发6 h时显著高于其他引发时间(P<0.05);浓度为1.92 mol·L-1时其APX活性在引发6和12 h时显著高于CK(P<0.05);浓度为3.84 mol·L-1时其APX活性在引发6 h时显著高于其他引发时间(P<0.05),但在引发12和18 h时显著低于CK(P<0.05);浓度为7.68 mol·L-1时,其APX活性随引发时间的延长而显著下降(P<0.05)。

图3 外源H2O2引发下燕麦种胚细胞APX活性变化Fig.3 Changes of APX activities in embryonic cells of oat seeds under exogenous H2O2 priming
2.4 外源H2O2引发对燕麦种胚细胞MDHAR活性的影响
由图4所示,引发6~18 h时,燕麦种胚细胞MDHAR活性均随H2O2浓度增加呈先升后降的趋势,且各浓度间存在显著差异(P<0.05);引发6 h时,其MDHAR活性在0.96~3.84 mol·L-1时显著高于0 mol·L-1时(P<0.05),并在1.92 mol·L-1时达到最大值,而在7.68 mol·L-1时则显著低于0 mol·L-1时(P<0.05);引发12和18 h时其MDHAR活性在0.96和1.92 mol·L-1时显著高于0 mol·L-1时(P<0.05),并均在0.96 mol·L-1时达到最大值,而在3.84和7.68 mol·L-1时则显著低于0 mol·L-1时(P<0.05)。除浓度为0 mol·L-1外,同一H2O2浓度下各引发时间下存在显著差异(P<0.05);0.96~3.84 mol·L-1时,其MDHAR活性随引发时间延长呈先升后降趋势;在0.96和1.92 mol·L-1时,各引发时间下均显著高于CK(P<0.05),并分别在引发12和6 h时达到最大值;在3.84 mol·L-1时,其MDHAR活性在引发6 h时显著高于其他引发时间(P<0.05),但在引发12和18 h时显著低于CK(P<0.05);在7.68 mol·L-1时,其MDHAR活性则随引发时间延长而显著下降(P<0.05)。

图4 外源H2O2引发下燕麦种胚细胞MDHAR活性变化Fig.4 Changes of MDHAR activities in embryonic cells of oat seeds under exogenous H2O2 priming
2.5 外源H2O2引发对燕麦种胚细胞DHAR活性的影响
由图5可知,引发6~18 h时,燕麦种胚细胞DHAR活性均随H2O2浓度增加呈先升后降的趋势;引发6和12 h时,其DHAR活性均在0.96和1.92 mol·L-1时显著高于0 mol·L-1时(P<0.05),而引发18 h时仅在0.96 mol·L-1时显著高于其他浓度(P<0.05);引发6 h时其DHAR活性仅在7.68 mol·L-1时显著低于0 mol·L-1时(P<0.05),而引发12和18 h时则在3.84和7.68 mol·L-1时均显著低于0 mol·L-1时(P<0.05)。浓度为0.96~3.84 mol·L-1时,其DHAR活性随引发时间延长呈先升后降趋势;浓度为0.96 mol·L-1时,其DHAR活性在各引发时间均显著高于CK(P<0.05),并在引发12 h时达到最大值;浓度为1.92和3.84 mol·L-1时,其DHAR活性均在引发6 h时显著高于其他引发时间(P<0.05),但浓度为3.84 mol·L-1时则在引发12和18 h时显著低于CK(P<0.05);浓度为7.68 mol·L-1时,其DHAR活性随引发时间延长而显著下降(P<0.05)。

图5 外源H2O2引发对燕麦种胚细胞DHAR活性变化Fig.5 Changes of DHAR activities in embryonic cells of oat seeds under exogenous H2O2 priming
2.6 外源H2O2引发对燕麦种胚细胞GR活性的影响
由图6所示,引发6~18 h时,燕麦种胚细胞GR活性均随H2O2浓度增加呈先升后降的趋势,且0.96~7.68 mol·L-1时均显著高于0 mol·L-1时(P<0.05);引发6 h时,其GR活性在1.92和3.84 mol·L-1时显著高于其他浓度(P<0.05);引发12和18 h时,其GR活性各浓度间存在显著差异(P<0.05),分别在1.92和0.96 mol·L-1时达到最大值。浓度为0.96 mol·L-1时,其GR活性随引发时间延长而显著升高(P<0.05);浓度为1.92~7.68 mol·L-1时,其GR活性随引发时间延长呈先升后降趋势,但在各引发时间下均显著高于CK(P<0.05)。
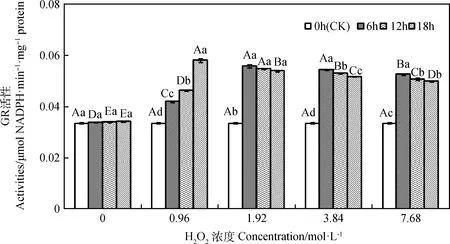
图6 外源H2O2引发下燕麦种胚细胞GR活性变化Fig.6 Changes of GR activities in embryonic cells of oat seeds under exogenous H2O2 priming
2.7 外源H2O2引发对燕麦种胚细胞H2O2和MDA含量的影响
由图7可知,引发6~18 h时,燕麦种胚细胞H2O2和MDA含量均随H2O2浓度增加而升高,且均在7.68 mol·L-1时达到最大值,并显著高于其他浓度(P<0.05);除浓度为0和0.96 mol·L-1时,其MDA含量无显著差异外,其H2O2和MDA含量在各浓度间均存在显著差异(P<0.05)。燕麦种胚细胞H2O2和MDA含量在0.96~7.68 mol·L-1时均随引发时间延长而升高,且均显著高于CK(P<0.05);浓度为1.92~7.68 mol·L-1时,其H2O2和MDA含量在同一浓度下的各引发时间间均存在显著差异(P<0.05)。
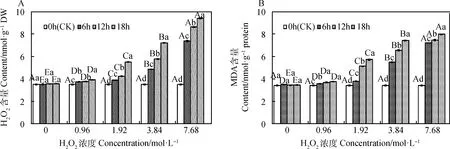
图7 外源H2O2引发下燕麦种胚细胞H2O2(A)和MDA(B)含量变化Fig.7 Changes of H2O2 (A) and MDA (B) contents in embryonic cells of oat seeds under exogenous H2O2 priming
3 讨论
植物体内ROS的产生与清除在正常条件下会处于一个维持正常生命活动的动态平衡,然而这种平衡一旦被破坏就会影响植物的正常代谢活动,从而破坏其正常的生长发育[22]。抗氧化酶是动植物细胞内调控ROS自由基平衡的主要清除剂,可缓解植物种子老化过程中过量积累的ROS对其细胞膜的攻击作用,减弱其细胞膜的脂质过氧化,进而降低植物种子的老化速率[23]。然而,种子细胞在老化过程中会大量积累以H2O2为动态核心的ROS自由基,并造成其抗氧化酶活性的迅速下降,从而导致细胞程序性死亡,使种子活力逐渐丧失[24]。本试验发现,外源H2O2引发浓度为0~0.96 mol·L-1时燕麦种胚细胞内H2O2含量增加相对缓慢,而其SOD,CAT,APX,MDHAR,DHAR及GR活性均保持较高水平,其MDA含量增加也就相对较少,这表明此时燕麦种胚细胞内AsA-GSH循环有能力清除过量增加的H2O2,从而减缓其造成的脂质过氧化损伤。因此,燕麦种子发芽率、发芽指数及幼苗活力指数在外源H2O2引发浓度为0~0.96 mol·L-1时也保持相对较高的水平,而其平均发芽时间的延长也相对较少[9]。这与外源H2O2促进盐胁迫下黄瓜(Cucumissativus)[6]和小白菜(Brassicachinensis)[7]等植物种子萌发的研究结论相似。然而,高浓度(3.84~7.68 mol·L-1)外源H2O2引发时,燕麦种胚细胞内H2O2含量会显著升高(P<0.05),尽管其SOD,CAT和GR活性仍显著高于CK(P<0.05),但其APX,MDHAR和DHAR活性除引发6 h外均已显著低于CK(P<0.05),其MDA含量也显著高于CK(P<0.05),这表明燕麦种胚细胞内AsA-GSH循环抗氧化能力已经不足以维持其H2O2平衡,从而导致其脂质过氧化损伤急剧加重。因此,高浓度的外源H2O2引发处理显著降低了燕麦种子的发芽率、发芽指数及幼苗活力指数(P<0.05),并显著提高了其平均发芽时间(P<0.05)[9]。本试验中,高浓度(3.84~7.68 mol·L-1)外源H2O2引发下,燕麦种胚细胞内SOD,CAT和GR活性仍显著高于CK(P<0.05),而其APX,MDHAR和DHAR活性则除引发6 h外均已显著低于CK(P<0.05),这说明其APX,MDHAR和DHAR是调控其H2O2平衡的关键酶,这与燕麦种子老化研究的结论相似[4,14]。
外源H2O2对植物种子萌发的影响不仅与其浓度高低有关,还与其处理时间的长短有密切关系[9]。本试验发现,除浓度为0和0.96 mol·L-1外,相同浓度外源H2O2引发下,燕麦种胚细胞内H2O2及MDA含量均随引发时间的延长而显著升高(P<0.05),这表明引发时间越长,细胞内H2O2积累量就越多,其脂质过氧化损伤也就越严重。然而,低浓度(0.96 mol·L-1)外源H2O2引发下,燕麦种胚细胞内SOD,CAT和GR活性均随着引发时间的延长而升高,APX,MDHAR和DHAR活性呈先升高后下降的趋势,所以燕麦种胚细胞内H2O2及MDA含量在低浓度外源H2O2引发下随引发时间的延长而增加的幅度相对较少,因而对其种子活力的影响也相对较小[9]。然而,高浓度(3.84~7.68 mol·L-1)外源H2O2引发下,燕麦种胚细胞内SOD,CAT,APX,MDHAR,DHAR和GR活性均随引发时间由6 h延长到18 h而降低,这说明引发时间越长,其AsA-GSH循环抗氧化能力也就越低,因而燕麦种子活力也就丧失的越严重[9]。燕麦种胚细胞内SOD,CAT和GR活性在引发12和18 h时仍显著高于CK(P<0.05),而其APX,MDHAR和DHAR活性则显著低于CK(P<0.05),这说明燕麦种胚细胞AsA-GSH循环的抗氧化能力在外源H2O2引发条件下主要依赖APX,MDHAR和DHAR来发挥作用。研究燕麦种子老化也发现种胚细胞内APX和MDHAR活性下降是其H2O2的积累的主要原因[14]。
4 结论
外源H2O2引发对燕麦种胚细胞抗氧化能力的影响与其引发浓度和时间有关,低浓度(0.96 mol·L-1)或短时间(6 h)引发时能够提高燕麦种胚细胞AsA-GSH循环的抗氧化能力,而高浓度(3.84~7.68 mol·L-1)或长时间(12~18 h)则相反。外源H2O2引发导致燕麦种胚细胞H2O2和丙二醛含量增加,而抗坏血酸过氧化物酶,单脱氢抗坏血酸还原酶和脱氢抗坏血酸还原酶是外源H2O2引发下燕麦种胚细胞内抗坏血酸-谷胱甘肽循环清除H2O2的关键酶,这与种子老化过程中内源H2O2的影响一致,为深入探究H2O2影响种胚细胞AsA-GSH循环抗氧化性能的分子机制提供了理论依据,有利于燕麦种子的长期贮藏与科学利用。

