不同生长天数‘热研4号’王草青贮品质和微生物群落多样性研究
龙仕和, 李雪枫, 潘俊歆, 常 晔, 史孟丽, 黄乃馨, 崔智海, 王 坚*
(1. 海南大学动物科技学院, 海南 海口 570228; 2. 海南大学林学院, 海南 海口 570228)
‘热研4号’王草(Pennisetumpurpureum×P.americanum‘Reyan No.4’)是中国热带农业科学院热带牧草研究中心经多年试验选育而成的多年生禾本科牧草,为象草(Pennisetumpurpureum)和美洲狼尾草(Pennisetumtyphoideum)的杂交品种[1]。该草具有品质好,生物产量高,光合作用强,可利用年限长,适应性和抗逆性强等特点,在广东、海南、广西和福建等热带亚热带地区广泛种植[2],常作为反刍动物的优质青绿饲料。在海南,夏、秋季节高温多雨王草生长旺盛,产量高,家畜短期内无法完全利用,因此,在王草生长旺盛季节将其调制成青贮饲料以缓解冬春季节饲料短缺成为确保反刍动物可持续发展的有效途径。目前有关王草的青贮研究,众多学者做了不少探讨,如研究王草与不同农副产品混合青贮[3-4],王草青贮后的有氧稳定性[5-6],添加剂对王草青贮发酵品质的影响[7-8],不同刈割茬次王草表面附着的乳酸菌分布和青贮发酵品质等[9-10]。
近年来,海南地区台风、极端降水等气候频率增加,导致牧草无法及时收获,生产者必须调整牧草收获时间以避免经济损失。由于牧草在不同生长阶段因其化学组分不同,进而影响其青贮发酵品质,是影响牧草青贮品质的主要因素之一[11-12]。牧草在生长早期含有较高的可溶性碳水化合物[13],相较于晚收割的牧草其干物质含量较低[14],在青贮过程中容易引起梭菌发酵导致干物质损失。牧草随着生长时间延长,木质化程度增加,可溶性碳水化合物含量下降不利于青贮发酵[15]。目前,关于不同生长天数王草的青贮发酵品质和微生物群落的研究鲜有报道。本试验拟对热带地区生长90,110,130 d的王草进行刈割青贮,研究其发酵品质和微生物群落多样性,以期为热带地区王草青贮饲料的调制提供理论依据。
1 材料与方法
1.1 试验材料
原料为热研4号王草(以下简称王草),于2020年6月5日种植在海南大学热带农林学院试验田。该试验基地位于海南大学海甸校区(19° 32′ N,109° 35′ E),地处热带季风气候区,年均气温22~26℃,年日照时间1 750~2 650 h,年均降水量1815 mm。基地0~20 cm深度土壤养分基本状况为:pH值4.93,有机质1.98%,全氮1.28 g·kg-1,全磷0.88 g·kg-1,全钾3.61 g·kg-1,碱解氮51.97 mg·kg-1,速效钾95.75 mg·kg-1,速效磷15.82 mg·kg-1。
1.2 试验设计
试验采用随机区组设计,设3个处理组:KM90S组(生长90 d)、KM110S组(生长110 d)和KM130S组(生长130 d),分别在青贮1,3,7,14和30 d后打开青贮袋取青贮饲料测定发酵品质和化学成分,对30 d的青贮样品进行微生物群落分析,每个处理各个青贮时间点3次重复。
1.3 试验方法
1.3.1王草原料处理 王草分别在生长90,110,130 d后将其刈割并带回实验室,用灭菌后的铡刀将原料切短至2~3 cm并充分混合,将混合好的王草随机选取15份(5个青贮时间×3个重复)样品(每份300 g)装入聚乙烯袋中,抽真空、密封,在室温下青贮。另取3份鲜样(每份300 g)用于化学成分测定,3份(每份10 g)用于微生物计数。
1.3.2青贮样品处理 分别在青贮第1,3,7,14,30 d后打开青贮袋,每个样品混匀后取20 g青贮料于100 mL锥形瓶中,加入70 mL蒸馏水,于4℃冰箱中浸提24 h后用4层纱布过滤得到浸提液用于测定pH、有机酸和NH3-N含量。剩余青贮料装入信封中于65℃烘箱干燥72 h,烘干后用粉样机粉碎然后经过40目筛用于测定化学成分。
1.3.3测定项目及方法 鲜样和青贮样置于65℃烘箱干燥72 h测定干物质(Dry matter,DM)含量;pH用pH计(PHS-3C精密pH计)对浸提液直接测定;蒽酮-硫酸比色法[16]测定可溶性碳水化合物(Water-soluble carbohydrates,WSC)含量;中性洗涤纤维(Neutral detergent fiber,NDF)和酸性洗涤纤维(Acid detergent fiber,ADF)含量通过范氏纤维分析法[17]进行测定;苯酚-次氯酸钠比色法[18]测定氨态氮(Ammonia nitrogen,NH3-N)含量;粗蛋白质(Crude protein,CP)和总氮(Total nitrogen,TN)含量采用全自动凯氏定氮仪(K9860,山东海能科学仪器有限公司)进行测定;乳酸(Lactic acid,LA)、乙酸(Acetic acid,AA)、丙酸(Propionic acid,PA)和丁酸(Butyric acid,BA)含量通过高效液相色谱仪检测(岛津LC-20A,Carbomix H-NP,7.8 mm × 300 mm),流动相:2.5 mmol·L-1H2SO4溶液;流速:0.6 mL·min-1;柱温箱温度:55℃;检测器:SPD-M20A;检测波长:210 nm;进样体积:5 μL。
1.3.4微生物计数 采用平板培养方法进行微生物计数。取10 g新鲜样品与100 mL无菌生理盐水(8.5 g·L-1)混合后进行连续梯度稀释(10-1至10-7)。乳酸菌(Lactic acid bacteria,LAB)在MRS琼脂(Solarbio Life Sciences Ltd. Co.,Beijing,China)上37℃厌氧培养24 h后计数。酵母和霉菌在马铃薯葡萄糖琼脂(PDA;Solarbio Life Sciences Ltd. Co.,Beijing,China)上30℃有氧培养48 h后计数。肠杆菌在紫红胆盐葡萄糖琼脂(VRBA;Solarbio Life Sciences Ltd. Co.,Beijing,China)上37℃有氧培养72 h后计数。
1.3.5微生物总DNA的提取 王草青贮30 d后,将青贮袋打开并充分混合,取3个重复样品,每个重复取20 g青贮料放入三角瓶,加入180 mL去离子水,三角瓶在37℃,120 r·min-1的摇床里均质15 min,然后用四层纱布进行过滤,得到浸提液。取40 mL浸提液于8000 rpm离心15 min后弃掉上清液,用1 mL无菌PBS溶液将沉淀溶解并收集到1.5 mL离心管,然后在-20℃冰箱保存,用于总DNA的提取。
1.3.6PCR扩增及16S rRNA基因高通量测序 选用DNA提取试剂盒(DP302-02,天根生物技术有限公司)提取青贮饲料样品中细菌的总DNA。利用前引物341F(5′-CCTACGGGNGGCWGCAG-3′)与后引物805R(5′-GACTACHVGGGTATCTAATCC-3′)获取细菌V3~V4高变异区l6S rRNA基因。PCR扩增产物回收纯化利用Qubit3.0 DNA检测试剂盒对基因组DNA精确定量,采用lllumina公司的TruSeq TM DNA Sample PrepKit制备测序文库。使用MiSeq测序仪进行2×300 bp的双端测序并对结果进行分析,lllumina HiSeq测序及结果分析测序及序列物种信息由生工生物工程(上海)股份有限公司协助完成。使用Usearch软件对测序序列进行聚类,对97%相似水平下的操作分类单元(OTU)进行生物信息统计分析。α多样性(Alpha diversity)包括Shannon,Chao,Ace和Good's coverage指数通过Mothur计算。主成分分析(PCA)通过R软件中的VEGEN包进行分析。优势物种相对丰度柱状图通过R软件进行计算。
1.4 数据分析
采用3(G)×6(E)完全随机区组设计进行数据统计和分析,每个处理3个重复。数据处理使用的模型为Yijk=μ+Ti+Cj+TCij+Eijk,其中,Yij=因变量值,μ=总体均值,Ti=生长天数效应,Cj=青贮时间效应,TCij=生长天数×青贮时间互作效应,Eijk=随机误差。对微生物计数以10为底的对数转换后进行数据分析,并以对数值表示。利用SPSS Statistics 26统计软件进行数据分析。使用Duncan’s法对均值进行多重比较。P<0.05表明数据差异显著,0.05≤P<0.10为存在趋势。
2 结果与分析
2.1 不同生长天数王草原料化学特性及附着微生物数量
由表1可知,3组王草原料的WSC含量在40.28~71.76 g·kg-1DM之间。随着生长天数延长,王草的DM含量显著增加(143.92~217.11 g·kg-1DM)(P<0.05),CP含量显著降低(P<0.05)。ADF和NDF含量随着生长天数延长总体呈上升趋势(P>0.05)。KM90S,KM110S和KM130S组王草的LAB数量分别为4.72,4.49和4.39 lg cfu·g-1FM,酵母和霉菌的数量在3.05~4.07 lg cfu·g-1FM之间,KM90S和KM130S组的肠杆菌数量显著高于KM110S组(P<0.05)。

表1 不同生长天数王草原料化学特性及微生物组成Table 1 Chemical characteristics and microbial populations of king grass in different growth days
2.2 王草青贮过程中发酵品质的变化
由表2可知,KM110S和KM130S组的pH随着青贮进行持续降低,均在青贮第30 d达到最低(P<0.05)。KM90S组的pH在青贮前7 d内变化不大,在青贮第14~30 d显著下降(P<0.05)。与青贮第1 d相比,KM90S组的LA含量在青贮前7 d变化不大(P>0.05),随后在青贮第14~30 d显著增加(P<0.05)。KM110S和KM130S组的LA含量在整个青贮过程中持续增加,均在青贮第30 d达到最大(P<0.05)。青贮结束后,KM90S组的AA含量显著高于另外2组(P<0.05)。青贮第7~30 d,KM110S组的LA/AA显著高于另外2组(P<0.05)。三个试验组的NH3-N含量随着青贮时间延长增加(P<0.05),均在青贮第30 d达到最大,除青贮第3 d外,KM90S组的NH3-N含量高于KM110S和KM130S组。
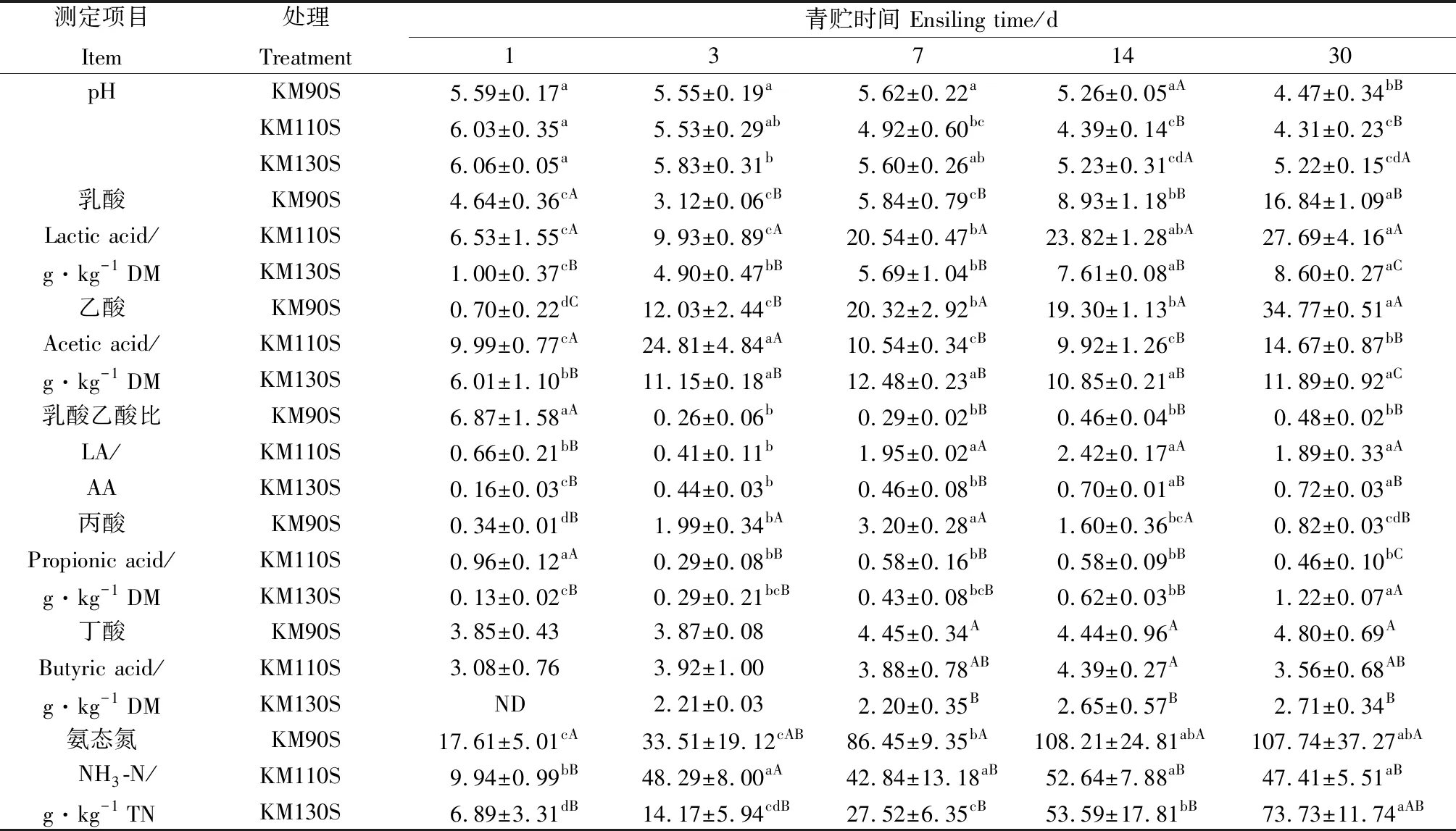
表2 王草青贮过程中发酵品质的变化Table 2 Changes in the fermentation quality of king grass silage during ensiling
2.3 王草青贮过程中化学成分和营养品质的变化
由表3可知,青贮结束后3组王草的DM含量显著降低(P<0.05)。WSC含量随着青贮时间的延长总体呈现为在青贮前7 d迅速下降(P<0.05),随后下降速度减缓,均在青贮第30 d达到最低。与青贮第1 d相比,KM90S组的CP含量在青贮第14 d显著降低(P<0.05)。KM90S组的ADF含量在青贮发酵期间持续增加,在青贮第14 d显著增加(P<0.05)。KM130S组的NDF含量在青贮过程中呈增加趋势,在青贮第30 d达到最大(P<0.05),KM110S组的NDF含量在青贮第7 d降低(P<0.05),随后在青贮第7~30 d显著增加(P<0.05)。
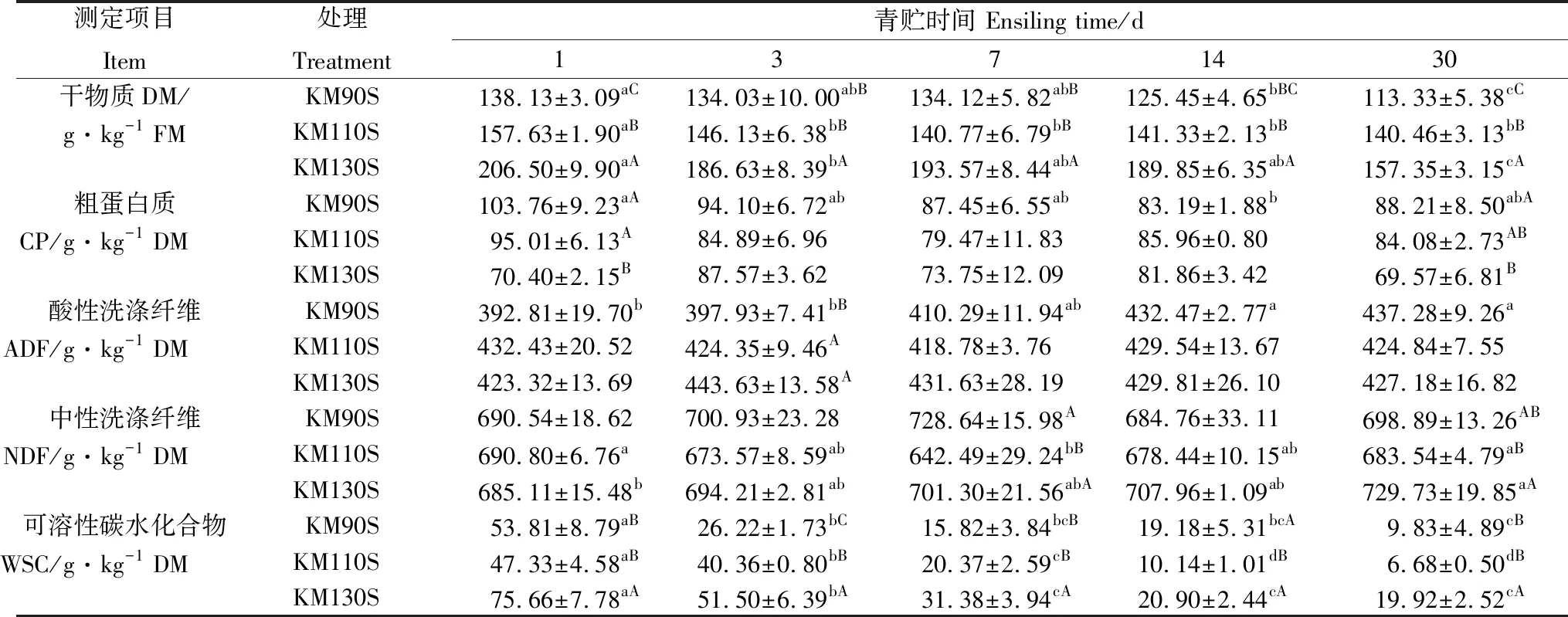
表3 王草青贮过程中化学成分和营养品质的变化Table 3 Changes in nutritional quality and chemical composition of king grass silage during ensiling
2.4 王草青贮30 d微生物α多样性分析结果
微生物α多样性分析结果见表4,KM90S,KM110S和KM130S组王草的青贮细菌OTU数分别为292,283,255个,Shannon和Chao指数随着生长天数的延长呈下降趋势。

表4 王草青贮30 d微生物α多样性Table 4 Alpha diversity of microbial community diversity for king grass at 30 d silage
2.5 王草青贮30 d微生物β多样性分析结果
青贮30 d后用主成分分析(PCA)对王草青贮样品进行分析,由图1可知,主成分1(PC1)和主成分2(PC2)对结果差异的贡献度分别为83.46%和9.95%,不同生长天数王草青贮30 d后细菌群落的分布和结构存在明显的分离和差异。
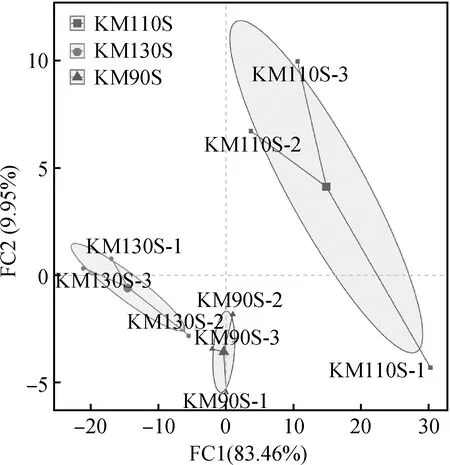
图1 王草青贮30 d细菌群落PCA分析Fig.1 PCA analysis of the bacterial community of king grass silage at 30 days
2.6 王草青贮30 d微生物群落结构分析结果
图2从门水平和属水平揭示了不同生长天数王草青贮30 d样品的微生物群落多样性,厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)总共占到了整个样品门水平的95%~98%,其中KM110S组Firmicutes的相对丰度占到了44.90%,Proteobacteria的相对丰度占到了53.70%。KM90S和KM130S组Firmicutes的相对丰度分别占到了28.13%和21.96%,Proteobacteria的相对丰度分别占到了68.33%和76.58%。共在属水平检测出15种细菌,将各组中平均丰度大于0.1%的菌群制作成物种分布堆叠图。结果表明,3组王草青贮后的优势菌属均为肠杆菌属(unclassifiedEnterobacteriaceae),其相对丰度在49.01%~70.03%之间。王草青贮料中相对丰度大于0.1%的乳酸菌属包括植物乳杆菌属(Lactobacillus)、乳球菌属(Lactococcus)、片球菌属(Pediococcus)、肠球菌属(Enterococcus)、明串珠菌属(Leuconostoc)和魏斯氏属(Weissella)。KM110S组中相对丰度最高的2种乳酸菌属为Lactobacillus和Pediococcus,相对丰度分别为28.30%和9.64%,KM90S组的乳酸菌属主要是Lactobacillus,相对丰度为20.38%,KM130S组中主要乳酸菌属为Lactobacillus和Lactococcus,相对丰度分别占到了9.94%和9.45%。3组王草青贮30 d后梭状芽孢杆菌属(Clostridium)的相对丰度较低,在0.49%~1.20%之间。
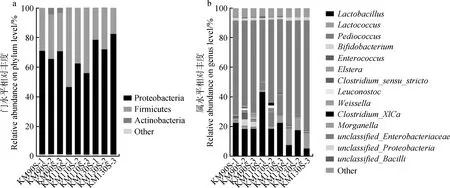
图2 王草青贮30 d门(a)和属(b)水平微生物群落组成Fig.2 Composition of microbial community of king grass silage at the phylum (a) and genus (b) levels at 30 d
3 讨论
3.1 不同生长天数王草原料特性
一般认为LAB数量大于105cfu·g-1FM能够使青贮饲料得到良好保存[15]。此外,在不使用任何添加剂时,青贮原料中至少要含约占DM含量8%~10%以上的WSC才能调制成功[19]。本试验中,3组王草的LAB数量在4.39~4.72 105cfu·g-1FM之间,WSC含量约占DM含量的4%~7%,可能会导致青贮发酵受限。随着生长天数延长,3组王草的DM,ADF和NDF含量增加,而CP含量降低,与Lounglawan等[20]研究相符。ADF和NDF含量的增加表明随着生长时间延长王草木质化程度增加。KM90S,KM110S,KM130S组的WSC含量分别为61.57,40.28和71.67 g·kg-1DM。张英[21]等研究发现,随着生长期延长王草的WSC呈上升趋势。Masuko等[22]研究表明,第2茬牧草比第1茬的WSC含量低。可能与植物不同的生长时期、温度、水分和光照条件有关[23]。
3.2 不同生长天数王草青贮过程中发酵品质的变化
青贮结束后3组王草的DM含量均显著下降,表明在青贮过程中存在营养物质的损失。青贮第1~14 d内,3组王草的pH下降速度和LA含量增加速度不同,KM110S组最快,其次为KM130S和KM90组,可能与不同生长期刈割牧草附着LAB的数量、种类和活性有关。青贮第14~30 d,KM130S和KM110S组的pH和LA含量变化不大,KM90S组的LA含量显著增加,pH显著下降,与Zi等[24]结果相一致。pH是评价青贮发酵品质的重要参数,本试验中,青贮结束后KM110S组(4.31)的pH低于KM90S(4.47)和KM130S组(5.22),是因为青贮过程中KM110S组的LA含量更多。有研究表明,AA是热带牧草青贮过程中的主要产物[25],在许多热带植物如木薯、雀稗和柱花草等青贮饲料中都得到了相类似的结果[26-27]。青贮结束后KM90S,KM110S和KM130S组的LA/AA分别为0.48,1.89和0.72,表明生长90 d和生长130 d的王草青贮发酵类型趋向于异型发酵模式。此外,青贮结束后3组王草的PA含量平均为0.83 g·kg-1DM,与Li等[27]在王草青贮饲料中的检测到的含量接近。AA和PA具有很强的抗真菌特性,可以有效地抑制青贮饲料中酵母菌的活性并提高青贮饲料的有氧稳定性[28-29]。Catchpoole和Henzell[31]认为保存良好的青贮饲料的BA含量应小于2.00 g·kg-1DM。青贮结束后3组王草的BA含量在2.71~4.80 g·kg-1DM之间,未达到良好青贮饲料的要求,可能是王草原料中DM(143.92~217.11 g·kg-1FM)含量较低,容易引起梭菌发酵[[32-33]。BA含量与梭状芽孢杆菌的活性有关,梭状芽孢杆菌会引起青贮饲料中DM和能量的损失,减少牲畜的饲料摄入量,可能会引起动物健康问题[15,30]。
3.3 不同生长天数王草青贮过程中化学成分和营养品质的变化
青贮饲料的调制主要是在厌氧条件下LAB利用青贮原料中的WSC和少量的纤维素生成LA迅速降低pH从而抑制有害微生物的繁殖[15]。本试验中,3组王草的WSC含量在青贮前7 d内快速下降,在青贮后期下降速度减慢,与郭刚[34]研究结果一致。KM90S组的LA含量在青贮的前7 d变化不大,可能是在青贮早期,大部分的WSC被植物的呼吸作用和有害微生物的活动所消耗,导致没有充足的糖被乳酸菌利用,故LA含量无显著变化,KM90S组第7 d的丁酸和NH3-N含量显著高于KM110S组和KM130S组也印证这一推测。3组王草的NH3-N含量在青贮过程中显著增加,这可能是植物蛋白酶和微生物共同作用的结果[35]。青贮结束后KM90S组的NH3-N含量最高,同时CP含量降低幅度最大,可能是该组中植物蛋白酶和微生物的活性较高。牧草中重要的营养物质包括NDF和ADF,家畜的饲料采食量和消化率与其含量密切相关。与青贮第1 d相比,KM90S组的ADF含量在青贮第14 d显著增加。KM110S组的NDF含量呈先降后增趋势,在青贮第7 d达到最低,KM130S组的NDF含量在青贮过程中持续增加,在青贮第30 d达到最大。青贮过程中ADF和NDF含量的增加可能与DM和WSC等有机物质的消耗损失有关,造成ADF和NDF的相对含量增加[36-37]。
3.4 不同生长天数王草的微生物多样性
青贮饲料的品质主要取决于发酵过程中微生物群落及其代谢产物,因此,研究青贮饲料中的微生物群落组成可以为提高青贮发酵质量提供有价值的科学依据[38]。本试验所有样本的覆盖率(Coverage)均在99%以上,表明测序数据有足够的覆盖性,可以反映细菌群落的核心组成。Shannon指数为常用的物种多样性指数,Shannon指数越大表明样品中物种多样性越高,Chao指数越高,表明样品中物种丰度越高[39]。本试验中,Shannon和Chao指数随着王草生长天数的延长呈下降趋势,说明随着生长期延长,王草青贮饲料的微生物多样性有所降低。在主成分分析中(图1),每个点距离越近代表样品之间微生物群落相似度越高,距离越远代表样品之间微生物群落相似度越低。3组王草青贮样品能够较明显的区分开。说明不同生长天数王草青贮微生物群落的组成和结构存在一定的差异。
3组王草青贮饲料在门水平上细菌区系的两大优势菌为Proteobacteria(53.7%~76.58%)和Firmicutes(28.13%~44.9%),与Zhang等[40]研究结果一致。青贮中参与LA发酵的大部分细菌群落属于Firmicutes,例如Lactobacillus,Pediococcus,Lactococcus,Weissella和Leuconostoc。本试验中KM110S组Firmicutes的相对丰度分别比KM90S和KM130S组高59.31%和104.30%,这可能是KM110S组中pH相对较低的原因,与Keshri等[41]在低pH青贮饲料中观察到的Firmicutes相对丰度较高的结果一致。青贮饲料中的LAB可以发酵WSC产酸降低pH,从而抑制有害微生物的活性,使青贮饲料得到良好保存。一般认为青贮发酵初期饲料中主要的LAB属为Enterococcus,Lactococcus,Pediococcus和Leuconostoc,之后随着青贮饲料pH的下降,逐渐被产酸能力强的Lactobacillus替代[15]。本试验中,KM90S和KM110S组在属水平上优势LAB均为Lactobacillus,相对丰度分别为20.38%和28.30%,KM130S组中优势LAB为Lactobacillus和Lactococcus,相对丰度分别为9.94%和9.45%。这可能跟KM130S组青贮结束后较高的pH(5.22)有关。卢强等[42]研究发现,在pH(5.08~5.41)较高的苜蓿青贮料中,Lactobacillus,Lactococcus和Enterococcus的相对丰度较高。
青贮饲料中的肠杆菌可能与LAB竞争营养物质,产生NH3-N并造成营养损失[43]。本试验中,3组王草青贮饲料在属水平上的优势菌为unclassifiedEnterobacteriaceae(49.01%~70.03%),与Li等[26]研究结论相一致。青贮饲料中BA的积累主要由梭菌发酵引起,不仅降低青贮饲料的营养价值,而且危害人和动物的健康[44]。王草青贮30 d后Clostridium(0.49%~1.20%)的相对丰度较低。表明3组王草青贮过程中BA的产生可能与青贮早期Clostridium的活动有关,随着青贮时间的延长,3组王草青贮的pH下降,Clostridium的活性受到抑制。
4 结论
与生长90 d和130 d的王草相比,生长110 d王草青贮结束后的pH,NH3-N和BA含量最低,乳酸菌属相对丰度和LA含量最高,因此生长110 d的王草调制出的青贮饲料优于生长90 d和130 d的。
——黔南扁穗雀麦

