磁性非均相Fe3O4/Si-FeOOH复合材料催化降解处理亚甲基蓝废水
于文肖,赵恒新,马 争,杜 霞
(河北师范大学 汇华学院,河北 石家庄 050091)
随着印染行业的发展,合成染料品种和产量剧增。在印染行业中应用非常广泛的偶氮染料进入水体会严重影响生态环境,损害接触者的健康[1]。Fenton法是目前工业有机污染物处理的主要方法之一。区别于传统的均相Fenton法,非均相Fenton法具有pH适用范围宽、不易形成铁泥污染、催化剂分离回收方便并可重复利用等优点[2],成为近年来水处理技术新的研究方向。
开发高效、稳定且易回收的催化剂是非均相Fenton工艺发展的关键问题。目前文献报道的非均相Fenton催化剂种类繁多[3]。其中,铁氧化物作为一种经典的非均相Fenton催化剂已被用于去除水中有机污染物并表现出一定的催化降解性能[4-11]。羟基氧化铁(FeOOH)作为土壤和地表沉积物中普遍存在的天然矿物,因具有比表面积大、催化活性高、成本低和较好的环境相容性等特点,被作为非均相Fenton催化剂广泛应用[12-13]。但FeOOH物理强度不高,易破碎,导致催化剂重复使用率不高[14],且在中性及碱性条件下FeOOH的催化活性会显著降低[15-16]。为了提高催化剂的适用范围和物理强度,研究人员通过掺杂和负载的方式对FeOOH进行改性研究[17-18]。文献[19-21]报道,在制备FeOOH的过程中掺入Si元素,得到Si-FeOOH,以其作为催化剂构成非均相Fenton体系降解有机物。与FeOOH相比,Si-FeOOH催化剂的稳定性和降解效果都有明显提高。但粉末状的催化剂直接应用于悬浮体系仍会存在固液分离和回收困难的不足,限制了其实际应用。因此,将Si-FeOOH与磁性纳米 Fe3O4结合,制备出一种既能提高FeOOH催化活性和稳定性又易分离回收的新型非均相Fenton催化剂具有非常重要的意义。
本研究制备了磁性Fe3O4/Si-FeOOH复合材料,将其作为非均相Fenton试剂催化H2O2降解有机染料亚甲基蓝(MB)。考察了不同条件下其对MB的催化降解性能及其回收利用情况。
1 实验部分
1.1 试剂和仪器
MB、NaOH、FeSO4、Fe(NO3)3、浓硫酸、Na2SiO3、H2O2(质量分数30%)均为分析纯。
FTIR-8400S型傅立叶变换红外光谱仪(日本Shimadzu公司);D8 advance型X射线衍射仪(德国Bruker公司);S-4800型扫描电子显微镜 (日本Hitachi公司);TU-1901型紫外-可见分光光度计(北京普析通用仪器公司);pHS-3B 型pH计(上海雷磁仪器有限公司)。
1.2 催化剂的制备
1.2.1 Fe3O4的制备
在搅拌状态下,向60 mL新配制的1 mol/L FeSO4溶液中缓慢滴加6 mol/L NaOH溶液,直至溶液pH为11。迅速加入一定量H2O2,持续搅拌0.5 h,加入1 mol/L FeSO4溶液30 mL,再次加入NaOH溶液调溶液pH至11,然后将其转移至圆底烧瓶中,加热回流2.5 h。冷却后将产物磁性分离,用纯水洗涤数次,将所得纳米Fe3O4置于50 ℃烘箱中干燥。
1.2.2 Fe3O4/Si-FeOOH的制备
在搅拌状态下,先将10 mL浓度为6 mol/L 的NaOH溶液加入经超声分散的40 mL的Fe3O4悬浮液(含2.5 g纳米Fe3O4)中,再加入50 mL浓度为1 mol/L 的Na2SiO3溶液。持续搅拌0.5 h后,取适量2 mol/L Fe(NO3)3溶液逐滴加入到反应液中,使n(Si)∶n(Fe)=0.3,反应过程中控制体系pH为6~7。搅拌2.0 h后,将混合液置于70 ℃的水浴中反应24.0 h。磁选分离产物,用纯水洗涤数次后,将所得样品Fe3O4/Si-FeOOH置于60 ℃烘箱中干燥24.0 h。
1.3 Fe3O4/Si-FeOOH催化降解MB
在室温下,将一定量的Fe3O4/Si-FeOOH催化剂加入到100 mL质量浓度为10 mg/L的MB溶液中,充分搅拌,调节溶液pH,加入一定量H2O2,开始反应。每隔一定时间取样,利用磁铁分离催化剂Fe3O4/Si-FeOOH,吸取上清液在最大吸收波长664 nm处测量其吸光度值,计算MB脱色率。
2 结果与讨论
2.1 催化剂的表征
2.1.1 FTIR
图1为样品Fe3O4/FeOOH和Fe3O4/Si-FeOOH的FTIR谱图。由图1可见:在3 415.7 cm-1处和1 623.9 cm-1处均出现了O—H的伸缩和弯曲振动峰;568.9 cm-1处为Fe3O4的特征吸收峰,是由于Fe—O键伸缩引起的[22];987.5 cm-1处出现了Fe3O4/Si-FeOOH独有的吸收峰,此峰归属于Fe—O—Si键伸缩振动[23]。由此可以证明,已成功将Si元素掺入FeOOH中制得Si-FeOOH,并将其与纳米Fe3O4进行了复合。
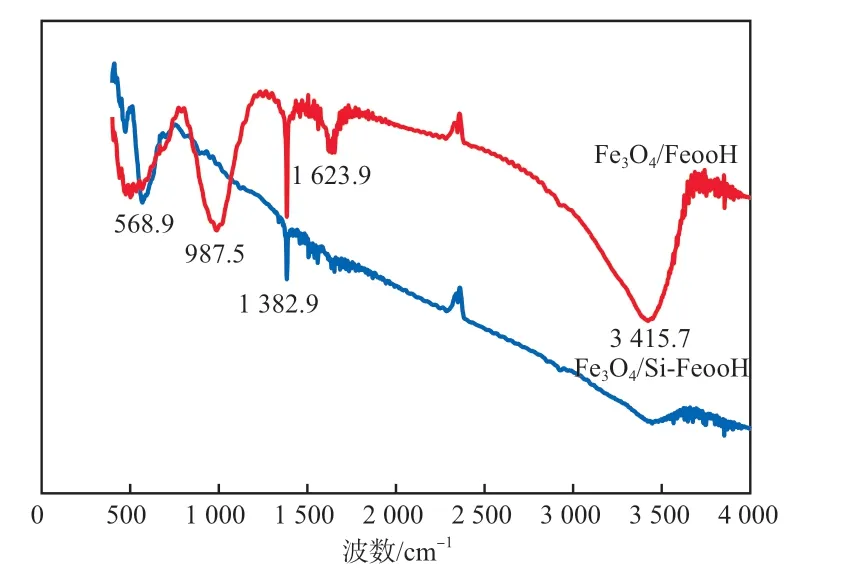
图1 Fe3O4/FeOOH和Fe3O4/ Si-FeOOH的FTIR谱图
2.1.2 XRD
图2为Fe3O4和Fe3O4/Si-FeOOH的XRD谱图。由图2可见,与立方相Fe3O4的特征衍射峰相一致的晶面衍射峰 (311)、(400)、(511)和(440)均出现在两样品的谱图中,表明复合材料Fe3O4/Si-FeOOH中包含立方相Fe3O4,且包覆层Si-FeOOH没有改变内核纳米Fe3O4的晶型。除此之外,没有发现其他晶型结构的铁氧化物和硅氧化物的衍射峰,结合FTIR谱图可以判断,包覆在Fe3O4表面的壳层呈Si—O—Fe无定型态[14]。另外,相较于图2中Fe3O4的谱图,Fe3O4/Si-FeOOH 谱图中(220) 和(422) 晶面的衍射峰消失,这可能是由于Fe3O4表面Si-FeOOH层的存在影响了这两个晶面的衍射强度[24]。

图2 Fe3O4和Fe3O4/Si-FeOOH的XRD谱图
2.1.3 SEM
图3为Fe3O4和Fe3O4/Si-FeOOH的SEM照片。由图3a可见,Fe3O4粒径分布范围窄,约为20~30 nm,颗粒表面光滑。由图3b可见,Fe3O4/Si-FeOOH呈颗粒状,有一定的团聚现象,颗粒表面凹凸明显,比表面积较大。

图3 Fe3O4(a)和Fe3O4/Si-FeOOH(b)的SEM照片
2.2 Fe3O4/Si-FeOOH对MB的降解效果
2.2.1 初始溶液pH对MB脱色率的影响
在Fe3O4/Si-FeOOH投加量为1.0 g/L、H2O2投加量为2.9 mmol/L的条件下,初始溶液pH对MB脱色率的影响见图4。由图4可见,反应进行60 min时,不同pH条件下MB的脱色率大小顺序为:pH 3(93%)> pH 5 (90%)> pH 7(59%)>pH 1(48%)。这说明该反应在pH 3~7之间都对MB有较好的降解效果。pH=1的强酸性条件下,MB脱色率有所下降,但仍能达到48%,说明该非均相Fenton反应pH适宜范围较传统Fenton反应有了明显的扩大。

图4 初始溶液pH对MB脱色率的影响
2.2.2 H2O2投加量对MB脱色率的影响
在初始废水pH为5、Fe3O4/Si-FeOOH投加量为1.0 g/L的条件下,H2O2投加量对MB脱色率的影响见图5。由图5可见:未加H2O2反应60 min时,MB脱色率只有14%,此时的去除应归属于催化剂对MB的吸附作用;体系中加入H2O2后,MB脱色率大幅提升;H2O2投加量为2.9 mmol/L反应60 min时,MB脱色率最高,达95%。这是因为加入催化剂后,Fe3O4/Si-FeOOH催化H2O2产生具有强氧化性的自由基·OH,引发Fenton反应,从而氧化去除MB。体系中产生的·OH数量会随着H2O2投加量的增加而增多,因而MB脱色率升高。当H2O2投加量大于2.9 mmol/L后,再继续提高H2O2投加量对MB脱色率的提高作用不大甚至产生不利影响。该结果与文献[25-26]报道的结果一致。故本实验选择H2O2投加量为2.9 mmol/L较适宜。

图5 H2O2投加量对MB脱色率的影响
2.2.3 Fe3O4/Si-FeOOH投加量对MB脱色率的影响
在初始废水pH为5、H2O2投加量为2.9 mmol/L的条件下,Fe3O4/Si-FeOOH投加量对MB脱色率的影响见图6。由图6可见:未加Fe3O4/Si-FeOOH时,MB脱色率较低;加入Fe3O4/Si-FeOOH后,MB脱色率明显提高;Fe3O4/Si-FeOOH投加量在0.5~1.0 g/L之间,MB脱色率随着Fe3O4/Si-FeOOH投加量的增加而提高;Fe3O4/Si-FeOOH投加量由1.0 g/L提高至2.0 g/L,MB脱色率不再升高。这是因为,Fe3O4/Si-FeOOH投加量增大可提高对染料的吸附量,同时使其表面可提供的活性反应位点数目增多,从而促使体系中·OH生成,使MB脱色率提高。在体系中H2O2的量一定的情况下,当绝大部分H2O2已和催化剂反应分解为·OH 时,催化剂投加量增加并不会增加·OH的数量,同时体系中过量催化剂的存在会增加纳米固体颗粒碰撞几率,从而发生团聚,使得相对有效催化剂的量并不能增多。综合考虑MB去除效果和处理成本,本实验选择Fe3O4/Si-FeOOH投加量为1.0 g/L较适宜。
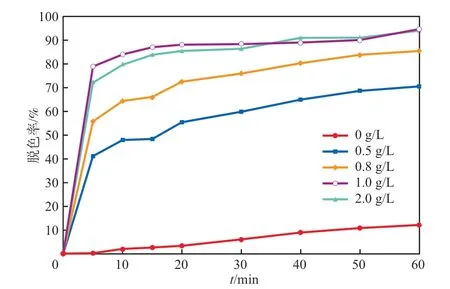
图6 Fe3O4/Si-FeOOH投加量对MB脱色率的影响
2.3 紫外-可见吸收光谱分析
在催化降解过程中,MB的紫外-可见吸收光谱随时间的变化见图7。由图7可见,在664 nm处出现最大吸收峰,此特征吸收峰是MB分子中苯环与带有孤对电子的氮、硫形成的共轭体系的电子跃迁引起的。随着降解的进行,MB分子在664 nm处的吸收峰强度逐渐减弱,当反应进行60 min时,此特征吸收峰基本消失,表明MB分子已被·OH氧化分解。同时,MB溶液的颜色随着降解反应的进行而逐渐变浅并最终变成无色。另外,在 MB最大吸收峰强度降低的同时,其位置略向低波数移动,表明MB降解过程为脱甲基过程,共轭发色团遭到破坏[27]。

图7 MB降解过程的紫外-可见吸收光谱
2.4 催化剂的重复使用性能
将降解MB反应后的Fe3O4/Si-FeOOH催化剂磁性分离,用蒸馏水洗涤数次,将其重复用于MB的降解,考察其重复使用性能,结果见图8。由图8可见,第4次使用,Fe3O4/Si-FeOOH仍具有较高的催化活性,反应60 min时对MB的脱色率仍高于90%。说明Fe3O4/Si-FeOOH催化剂具有良好的活性稳定性,可以重复使用。
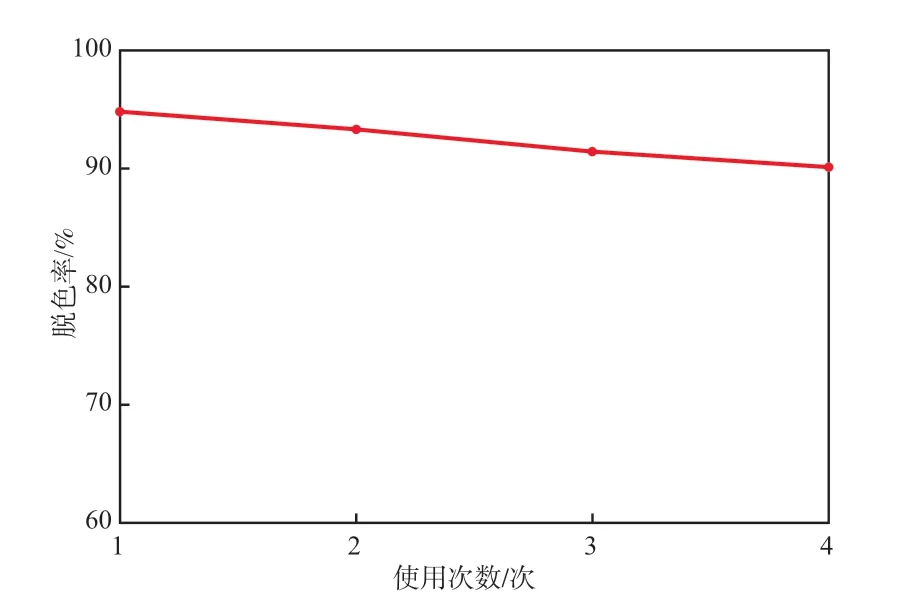
图8 Fe3O4/Si-FeOOH的重复使用性能
2.5 不同催化体系对MB的降解效果
在初始废水pH为5、H2O2投加量为2.9 mmol/L、催化剂投加量为1.0 g/L的条件下,不同催化体系的MB脱色率见图9。由图9可见:在反应60 min时,不同催化体系的MB脱色率大小顺序为 Fe3O4/Si-FeOOH+H2O2>Fe3O4/FeOOH+H2O2>Fe3O4/Si-FeOOH>Fe3O4/FeOOH>H2O2。其中Fe3O4/Si-FeOOH+H2O2体系的MB脱色率最高,达95%。可以推断出此体系对于MB的去除主要来自催化剂和H2O2构成的非均相Fenton体系协同作用,而Si的掺杂显著提高了催化剂的催化活性。这可能是由于通过掺入Si元素所制得的催化剂Fe3O4/Si-FeOOH包覆层Si-FeOOH呈无定型结构,比表面积增大,催化剂表面的活性点位增多,从而有利于催化体系产生·OH,催化性能明显提高[19]。

图9 不同催化体系的MB脱色率
3 结论
a)将Si-FeOOH层负载于Fe3O4纳米粒子上,制备了新型复合材料Fe3O4/Si-FeOOH,将其作为非均相Fenton试剂催化H2O2降解MB。该非均相Fenton反应体系的pH适宜范围宽,Si元素的掺入可以明显提高对MB的降解效率。
b)在初始废水pH为5、H2O2投加量为2.9 mmol/L、Fe3O4/Si-FeOOH投加量为1.0 g/L的条件下,反应60 min,对MB(10 mg/L)的脱色率可达95%。
c)Fe3O4/Si-FeOOH催化剂具有良好的活性稳定性,第4次使用,反应60 min时对MB的脱色率仍高于90%。

