基于表型和SSR标记的陇南油橄榄品种鉴定与遗传多样性分析
徐 悦,黄 兰,李金花,邓 煜,张建国,曾艳飞*
(1.国家林业和草原局林木培育重点实验室,中国林业科学研究院林业研究所,北京 100091;2.甘肃省陇南市经济林研究院油橄榄研究所,甘肃 陇南 746000)
油橄榄(Olea europaea L.)为木犀科(Oleaceae)木犀榄属(Olea L.)常绿乔木,是世界著名木本油料兼果用树种。由新鲜油橄榄果实直接冷榨而成的橄榄油,富含多种维生素和不饱和脂肪酸,可以显著降低心脑血管疾病发病机率,是食用油脂中最有益于人体健康的植物油[1]。油橄榄原产于地中海,具有悠久的栽培历史,由于不同地域之间频繁的品种交换,同名异物和同物异名现象较普遍[2]。目前已有记录名称品种达1 275个,分布在54个国家和地区[3]。我国大规模引种始于1964年,此后陆续开展了油橄榄引种试验和驯化育种研究,确定了甘肃陇南白龙江河谷、滇西北及川西南金沙江河谷等地区为最佳适生区,并建立了规模化栽培生产基地[4]。目前,我国橄榄油年产量达到2 620 t,但远远不能满足消费市场的巨大需求,国外橄榄油进口量逐年剧增(https://www.fao.org/faostat/en/#compare)。因此,针对我国油橄榄产量较低和良种不足的现状,亟需对国内油橄榄种质资源开展引种和驯化育种研究,而对现有品种的鉴定和遗传多样性分析是这一研究的重要前提[5]。
国外油橄榄品种鉴定和种质资源遗传多样性研究报道甚多,表型性状和SSR标记为最常用方法[6];西班牙[7]、法国[8]、突尼斯[9]、阿尔及利亚[10]等国均用SSR标记对本国油橄榄种质资源进行了多样性评价。目前世界最大油橄榄种质资源库为西班牙科尔多瓦(World Olive Germplasm Bank in Cordoba,WOGBC)[7]和摩洛哥马拉喀什(World Olive Germplasm Bank in Marrakech,WOGBM)[11],他们共收录了1 000多个油橄榄品种表型特征数据和以SSR标记为主的分子数据。Diez等[12]基于SSR标记分析了WOGBC数据库里289个油橄榄品种,认为地中海的油橄榄品种可分为3个基因库,其来源大致对应地中海盆地的西部、中部和东部。将我国油橄榄栽培品种对应基因库与地中海盆地基因库进行对比分析可为引进油橄榄新种质提供参考。
我国在油橄榄品种鉴定和遗传多样性研究方面已取得了一些进展。耿树香等[13]基于SSR标记计算了云南省选育品种和引种品种的遗传多样性,且发现聚类并不能将二者分开。李金花等[14]用SSR标记研究了适生区内的油橄榄遗传多样性,发现品种内的遗传变异远高于群体间和群体内不同品种间的遗传变异。Zhan等[15]用ISSR和SSR标记分析了四川省西昌市油橄榄遗传多样性,结果表明品种并没有根据来源国聚类。Li等[16]开发新SSR标记鉴定了云南省永仁县油橄榄材料,认为品种间遗传关系与起源并不相符。针对陇南地区的油橄榄,秦倩等[17]用SSR标记和表型性状分析了17份常见品种,发现其表型和遗传多样性均较高,两种方法分析的品种间关系存在一致性和差异性;邵文豪[18]用SSR标记分析了50份油橄榄样品,发现我国选育品种与意大利品种的遗传关系更近。
本研究尽量全面收集了我国油橄榄主产区和种质重点收集区——甘肃省陇南市的油橄榄品种;基于表型和SSR标记开展了品种鉴定和多样性分析,比较了两种手段在品种鉴定上的差异;并根据油橄榄品种基因型的遗传分组,结合品种来源和地中海油橄榄的起源研究,分析我国的引种品种和本土培育品种在多样上的局限。本研究拟为我国油橄榄种质资源引进、新品种选育和栽培利用提供参考。
1 材料与方法
1.1 试验园自然概况
研究所用油橄榄品种材料来自甘肃省陇南市的两个试验园:陇南市经济林研究院油橄榄研究所科研试验园(104°53′28′ E,33°24′13′ N),位于陇南市江南街道办大堡村;大湾沟油橄榄试验示范园(104°47′59′ E,33°26′18′ N),位于陇南市武都区两水镇。两个试验园均地处白龙江干热河谷地带内,海拔1 000~1 300 m;该地区气候温暖,年平均温度14.9 ℃;空气湿度低,全年平均相对湿度仅61%[19]。
1.2 试验材料
本研究内共收集110棵单株用于SSR分析;这些单株属于83个品种,包括国外引种品种61个(表1),国内引种选育品种22个(表2)。由于油橄榄材料采自两个试验园,且存在同一品种多次引种的情况,为鉴定相同品种名下不同单株的基因型是否相同,有些品种存在重复采集。所采集的110棵单株中,来自68个品种的90棵单株已挂果,可用于表型分析(表1和表2);分别收集各单株树冠南侧1.5 m处成熟的完整叶片和结果枝中部完好果实各30个重复,用于叶片和果实表型性状测定;果实剥去果肉洗净阴干后进行果核性状测定。

表1 我国引种油橄榄品种及其起源国Table 1 Imported olive cultivars and country of origin

表2 我国油橄榄引种选育品种Table 2 Introduced domesticated and selected breeding varieties in China
1.3 方法
1.3.1 表型形态性状测定 依据国际植物新品种保护联盟(International Union For The Protection Of New Varieties Of Plants,UPOV)发布的油橄榄新品种测试指南(TG /99 /4 2011-10-20)进行表型性状测定,包括11个数量性状和15个质量性状。利用EPSON扫描仪和ImageJ软件(https://imagej.nih.gov/ij/)扫描叶片图像和测定相关数据,使用精度为0.01 mm的游标卡尺和0.01 g的电子天平测定叶厚、果实和果核数量性状。
1.3.2 表型形态性状数据统计分析 用SPSS V26.0(IBM Corp,Armonk,N.Y.,USA)软件采用箱线图的方法,筛除各单株数量性状30个重复中的异常值,计算平均值用作单株数量性状分析,用Microsoft Excel计算叶形指数(叶长/叶宽)、果形指数(果纵径/果横径)和核型指数(核纵径/核横径),并针对数量性状计算均值、标准差和变异系数等。通过均值与标准差将所有数量性状数据分为10个等级,每等级间相差-0.5σ,原始数据换算后统计出现频率用于多样性指数计算。质量性状参照秦倩[17]方法进行赋值,并统计出现频率。计算所有性状指标的Shannon-Weiner多样性指数[21],公式为 H=−∑(Pi)(InPi),其中,Pi表示某一表型出现频率值。对数量性状分级、质量性状赋值后,用SPSS V26.0(IBM Corp,Armonk,N.Y.,USA)软件基于平方欧氏距离计算两两单株间表型距离矩阵,Ward法进行聚类分析。鉴于少量品种测定了多棵单株的表型性状,简单基于所有单株的表型数据分析多样性,会影响其评估的准确性。因此,在计算表型多样性时,对同一品种名的多棵单株表型数据取平均值进行合并。
1.3.3 SSR标记分析 采集油橄榄单株幼嫩叶片,用植物基因组DNA提取试剂盒(天根生化,北京)提取DNA。从油橄榄已有研究中筛选13对扩增稳定且具多态的SSR引物[22-25],标定荧光后取各油橄榄单株DNA分别扩增;引物详细信息见表3;PCR扩增反应体系和程序参照Trujillo等[7]。利用ABI 3 730测序仪(美国生命技术公司)进行毛细管电泳,检测PCR产物,内标为Liz500。以同批扩增的‘佛奥’品种为阳性对照,去离子水为阴性对照,校准不同批次样品。采用Genemapper V4.0(美国生命技术公司)软件读取SSR数据,校正后获得每单株SSR基因型。
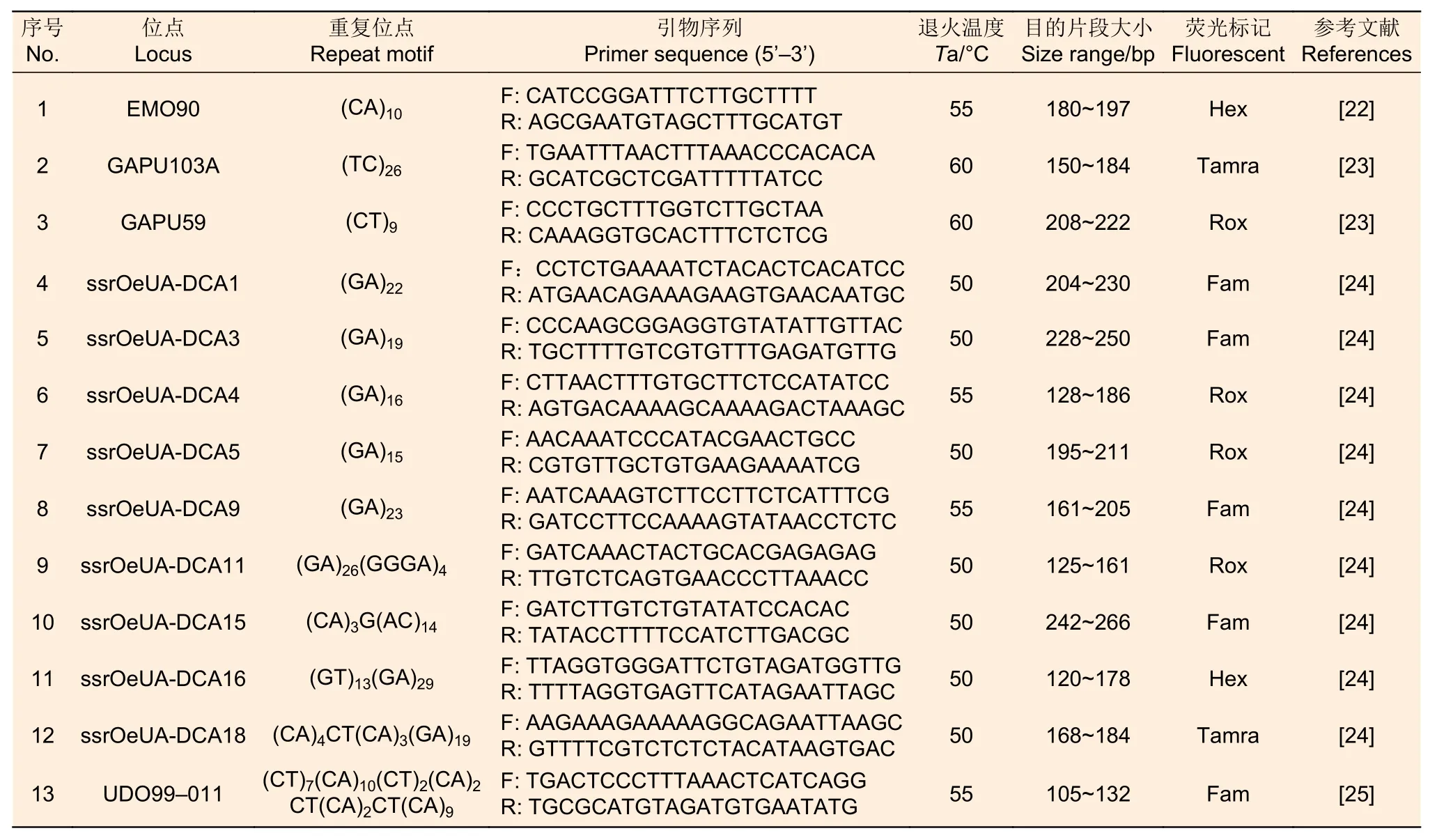
表3 SSR 引物信息Table 3 SSR primer information
1.3.4 SSR标记数据统计分析 利用Genotype软件[20]判断所有110棵单株的SSR基因型数、合并相同基因型;分析选择无限位点模型(Infinite site model),阈值设置为1。基于这些基因型,利用GenAlEX 6.50软件[26]计算遗传多样性参数,观测等位基因数(Na)、有效等位基因数(Ne)、观测杂合度(Ho)和期望杂合度(He);运用Structure 2.3[27]软件推断所有基因型的遗传分组,采用混合模型和等位基因频率关联模型,分组值K设置为 1~10,每个K值重复计算10次,每次运行100 000 次Burnin和1 000 000次迭代。结果上传到在线软件Structure Harvester(http://tay lor0.biology.ucla.edu/structureHarvester/)中,根据lnP(D)、ΔK对应最大原则选择K值;Clumpak(http://clumpak.tau.ac.il/)将10次运行结果合并选择平均相似度(mean similarity)最高对应的K值;Distruct 1.1[28]软件实现分组结果可视化。针对90棵有表型性状的单株,用MSA v4.05[29]软件计算两两单株间的SSR基因型距离;用Phylip 3.695[30]软件中的“Neighbor”程序,以尖叶木犀榄(Olea europaea L.spp.cuspidata (Wall.) Ciferri)为外类群,对单株的基因型构建系统发育树,自展值(bootstrap)设为1 000。
1.3.5 基于表型与SSR基因型矩阵的相关性分析为评估表型性状和遗传变异在品种判定的相关性,利用GenALEX软件[26]对两两单株间表型距离矩阵与SSR基因型的遗传距离矩阵进行Mantel检验,重复数设置为9 999;逐一分析遗传距离矩阵与基于所有表型性状、仅基于质量性状和仅基于数量性状的距离矩阵的相关性。
2 结果与分析
2.1 陇南油橄榄表型性状的品种鉴定
基于叶片、果实和果核表型数量性状与质量性状的分级或赋值数值在90棵单株间均不同,但并不能反应不同单株是否为相同品种。表型聚类结果(图1a)显示:一些品种的单株与其他品种聚为一支,如我国实生选育品种‘鄂植8号’的1号、2号与‘城固53号’、‘城固32号’聚为同一支。相同品种的不同单株并未全部聚为一支,具有3个及以上不同单株的品种如‘小苹果’、‘奇迹’、‘佛奥’、‘皮削利’各仅有2个单株聚为一枝。相同品种的单株间聚类较为混乱,且并未依照来源国家或品种选育记录的亲缘关系聚为一支。
2.2 陇南油橄榄品种表型性状的遗传多样性
对90棵单株中的相同品种取均值后,计算68个品种的表型参数(表4)。数量性状变异系数均值为0.22,范围为0.10~0.58,最大值是叶面积(0.58),其次为叶厚(0.27),叶柄长(0.25);变异系数最小的是果形指数(0.10),其次为核横径(0.14)。多样性指数均值为1.83,范围为0.81~2.05,极值分别对应于果肉率和叶柄长。质量性状变异系数均值为0.32,范围为0.20~0.47,极值分别对应于叶片纵向弯曲度与果核表面粗糙度。所有品种的15个质量性状累积共有42个变异类型,平均变异类型为2.8;多样性指数均值为0.79,范围为0.49~1.40,极值分别对应果实乳突和果核形状。

表4 陇南油橄榄品种表型参数Table 4 Phenotypic parameters of olive varieties in Longnan
2.3 陇南油橄榄品种SSR标记分子鉴定
基于13个SSR标记,Genotype软件[20]结果显示110棵油橄榄单株共有78种不同基因型。单株基因型与对应品种名比较后发现,大多数品种的基因型不同,相同品种不同单株的基因型相同,如‘豆果’、‘鄂植8号’、‘佛奥’、‘胡耶特’、‘莱星’、‘米扎’、‘配多灵’、‘皮削利’、‘奇迹’、‘坦彩’和‘小苹果’(表1、2)。少数品种与其他品种有相同基因型,如‘玉蝉44’与‘莱星’、‘云台14’与‘A33’、‘海口优1与贝拉’、‘科新佛奥’与‘佛奥’为同一基因型。在78个不同的基因型中有39个基因型起源于西地中海国家,21个起源于中地中海国家,16个属于中国本土选育,2个来源未知。基于SSR标记,以尖叶木犀榄为外类群,对表型数据完整的90棵油橄榄单株的聚类分析结果(图1b)显示:金叶橄榄与尖叶木樨榄遗传距离最近,其他油橄榄品种并未有明显的分组;来自同一品种的不同单株大都聚为一枝,如‘皮削利’、‘豆果’、‘奇迹’、‘配多灵’、‘鄂植8号’;不同品种的油橄榄并没有依据起源国家聚类。在我国选育品种中,‘城固24’、‘城固32’、‘城固47’和意大利品种‘塔吉’聚为一支,其他品种则分散在不同支。

图1 基于表型与 SSR 标记的陇南市油橄榄栽培品种聚类结果
2.4 陇南油橄榄品种SSR标记的遗传多样性
基于SSR分子鉴定的78种不同基因型计算遗传多样性参数。陇南市油橄榄种质观测等位基因数Na为14.8,有效等位基因数Ne为5.2,观测杂合度Ho为0.683,期望杂合度He为0.754,近交系数F值为0.107。Structure分析结果显示:lnP(D)在K=3时迅速增大,在K=6时有峰值(图2a);ΔK在K=3时有明显峰值(图2b);Clumpak软件显示:K=3时不同次运行结果的平均相似度最高。因此,所有基因型可以分3组(图2c)或6组(图2d)。分3组时,第一组主要包括18个基因型,其对应品种来源国家为:西班牙8个、法国3个、阿尔及利亚1个、意大利2个、希腊1个、中国2个、未知来源1个;第二组主要包括36个基因型,对应品种来源为:西班牙5个、法国1个、突尼斯1个、意大利4个、阿尔巴尼亚5个、希腊15个、俄罗斯1个、中国3个、未知来源1个;第三组主要包括24基因型,对应品种来源为:西班牙1个、法国2个、阿尔及利亚2个、意大利7个、阿尔巴尼亚1个、中国11个。我国选育品种与意大利品种的遗传组成更相近。分6组时,基因型分组结果较乱。

图2 陇南基于油橄榄不同SSR基因型的遗传分组Fig.2 Genetic structure based on different olive SSR genotypes from Longnan
2.5 基于表型与SSR基因型的矩阵之间相关性
矩阵相关性分析结果显示:基于SSR基因型的遗传距离与基于所有表型数据的距离矩阵存在显著的相关性(R2=0.033 9,P=0.000 1),其中,遗传距离矩阵与基于质量性状得到的距离矩阵的相关性不显著(R2=0.000 8,P=0.244),而与基于数量性状得到的距离矩阵的相关性更明显(R2=0.046 4,P=0.000 1),即数量性状较质量性状与基因型在个体间遗传距离的相关性更好。
3 讨论
3.1 表型性状与SSR标记鉴定陇南油橄榄
在29个表型指标中,数量性状和质量性状均可区分90棵单株,但表型聚类并没有将同一品种不同单株聚为一支,其聚类结果与亲缘关系和起源国也没有明显关联。同一品种表型性状差异较大的多个单株,聚类未能聚为同一支的,SSR聚类仍能将其聚为一枝,且聚类分析与Genotype软件[20]分析结果基本一致。因此,SSR标记较表型聚类能够更准确的判定单株品种。本研究基于SSR标记鉴定出陇南有78种基因型,即可能存在78个不同的品种。大多品种基因型不同,少数品种与其他品种有相同基因型,如‘玉蝉44’与‘莱星’、‘云台14’与‘A33’、‘阿斯-4’与‘克里’、‘海口优1’与‘贝拉’、‘科新佛奥’与‘佛奥’为同一基因型。据徐纬英[19]关于本土选育品种的详细记录,‘玉蝉44’为‘莱星’的品种选优,‘海口优 1’为‘贝拉’实生选优,本研究验证了记录所述。此外,本研究认为,‘科新佛奥’与‘佛奥’为同一品种。在WOGBC数据库中,‘阿斯’这一品种对应有多个不同基因型[7],本研究中的6个‘阿斯’单株也被认为有3个不同基因型。当然,某些表型存在差异的单株可能在遗传上也存在差别,只因本研究仅基于13个SSR标记的遗传变异不够而无法区分。然而,基于不同单株SSR基因型的聚类分析仍可以反映各单株及品种间的亲缘关系(图1)。本研究发现,基于个体SSR基因型的遗传距离与基于表型的距离矩阵之间的相关性虽然显著,但相关系数并不大(R2=0.033 9,P=0.000 1)。这说明基于表型性状并不能完全准确反映品种间遗传关系。表型性状遗传背景的复杂性和环境影响下的表型可塑性都会影响其相关性。遗传距离矩阵与数量性状距离矩阵的极显著相关(R2=0.046 4,P=0.000 1),而遗传距离矩阵与质量性状距离矩阵不相关(R2=0.000 8,P=0.244),对质量性状的赋值不连续且与其遗传背景不相关是该结果的主要原因。
3.2 陇南油橄榄资源表型和遗传多样性
陇南市油橄榄表型遗传多样性较高,数量性状变异系数为0.22(0.10~0.58)。数量性状和质量形状的多样性指数分别是1.83(0.81~2.05)和0.79(0.49~1.40)。秦倩等[17]对陇南17个品种表型分析结果为数量性状变异系数是0.45~0.55,数量性状和质量形状的表型多样性指数分别为1.58~2.09 和0.36~1.09。本研究中,表型变异系数和多样性指数范围较秦倩等研究的大,产生差异的原因可能是本研究分析的品种数远多于秦倩等[17]分析。此外,采用的表型指标有部分差异,不同结果年份(大小年)果实和果核大小有差异,也可能是两个研究存在差异的原因。本研究发现,陇南油橄榄果形指数变异系数最小,而叶面积变异系数最大,说明即使在同一生境下油橄榄品种间叶片差异较大,而果实形状在各品种间较稳定。
陇南市油橄榄的遗传多样性较高,本研究计算的观测杂合度(Ho=0.683)和期望杂合度(He=0.754)均高于耿树香等[13](Ho=0.489,He=0.721 6)和Li等[16](Ho=0.52,He=0.67)对云南油橄榄的遗传多样性计算结果,低于李金花等[14]对适生区内油橄榄遗传多样性数值的计算 (Ho=0.757,He=0.754),低于邵文豪[18]此前对于陇南市50个品种的遗传多样性计算结果(Ho=0.798,He=0.716),这种差异产生的原因可能与SSR标记引物的选取和分析的品种有关。除未知和本土选育品种,陇南市的油橄榄品种起源国均为西部和中部地中海国家,大致对应Diez等[12]研究发现的三个地中海基因库中的两个。中国选育油橄榄品种的遗传构成与地中海中部国家意大利来源的品种相似,此结论与邵文豪结论一致[18]。这些结果表明初期油橄榄引种栽培品种来源有限,且本土选育品种的遗传基础不够多样化。今后引种时为了丰富国内油橄榄品种遗传多样性,可考虑引种起源于地中海东部国家,或者西部和中部其他国家的更多不同基因型的品种。
4 结论
陇南至少有78种不同基因型的油橄榄品种。SSR标记比表型性状鉴定品种更准确,且能反映品种间亲缘关系;陇南油橄榄种质表型多样性和遗传多样性较高,但引种品种主要来自地中海西部和中部国家,地中海东部起源品种几乎没有;我国本土选育品种与地中海中部国家意大利起源的品种相似;为多样化陇南油橄榄品种,可考虑引种地中海东部起源品种,并基于更广泛的品种来源开展本土品种选育。
5 致谢
感谢甘肃省陇南市武都区油橄榄产业办公室在油橄榄品种材料收集中提供的帮助。

