板栗果实内生真菌群落组成及分化特征
闾 星,窦桂铭,汪慧华,李如华,江泽平,李志朋,严东辉*
(1.中国林业科学研究院森林生态环境与自然保护研究所 国家林业和草原局森林保护学重点实验室,北京 100091;2.北京农业职业学院食品与生物工程系,北京 100085;3.北京市怀柔区园林绿化局,北京 101400)
植物根际微生物组与宿主互作机制和调控免疫抗病功能不断被发现,在病害防控技术利用方面取得了突破性进展,显示植物微生物组为病害绿色防控提供了新型途径[1]。植物种实也存在着丰富的微生物多样性,这些微生物组在寄主幼龄阶段的适应性和病害防御中起着重要作用,并且对此后植物的种实健康发育、采后果实生理、品质和安全都有不可忽视的影响[2]。但果实或种子微生物组结构与功能作用还有待探索和了解,目前有报道的多是水果类果实,如苹果[3-4]、芒果[5]、草莓[6]、西瓜[7]、桑葚[8]等,而坚果类微生物组多样性及其功能鲜有报道。内生真菌作为植物微生物组核心类群,遍布植物各个组织器官,参与调控植物组织生长发育、胁迫适应、进化和生态功能演化的作用[9]。探索果实内生真菌组多样性和结构,是揭示微生物组调控果实健康功能和机制的基础。
中国板栗(Castanea mollissima BL.)属于壳斗科Fagaceae栗属Castanea植物,是最古老的驯化树种之一(>3 500年)[10],是我国重要的经济林树种[11],在世界板栗产业和经济中占有重要位置[12],果实为坚果。虽然,利用可培养技术,有限地分析过板栗营养器官根、茎和叶中可培养内生真菌的多样性和作用[13-14],但研究材料主要来自于欧洲栗C.sativa[11]。而在微生物组群落水平上对内生真菌组的结构和多样性的报道不多,尤其在板栗果实器官上的报道未见。鉴于健康板栗果实内生真菌组对于建立绿色防控板栗果腐病技术的重要意义,我们采用ITS扩增子高通量测序的微生物非培养技术结合组织分离微生物可培养技术[15],以中国板栗(燕山早丰、丹东板栗、大红袍、毛板红、泰山板栗和天师板栗)6个品种果实为研究材料,探究了不同品种果实间及其果壳、果肉间的内生真菌群落组成和多样性特征,为寻求和阐明内生真菌组调控板栗果实健康机制,了解和掌握坚果类果实微生物组的作用奠定基础。
1 材料和方法
1.1 板栗果实材料
2020年9—10月在板栗主产区采收6个板栗品种果实材料,分别是燕山早丰、毛板红、丹东板栗、大红袍、天师板栗及泰山板栗(表1)。样品装于干净透气纸袋,不同地8~48小时低温运输至实验室,于4 ℃放置,并在两周内完成样品预处理(核酸提取及分离培养)。
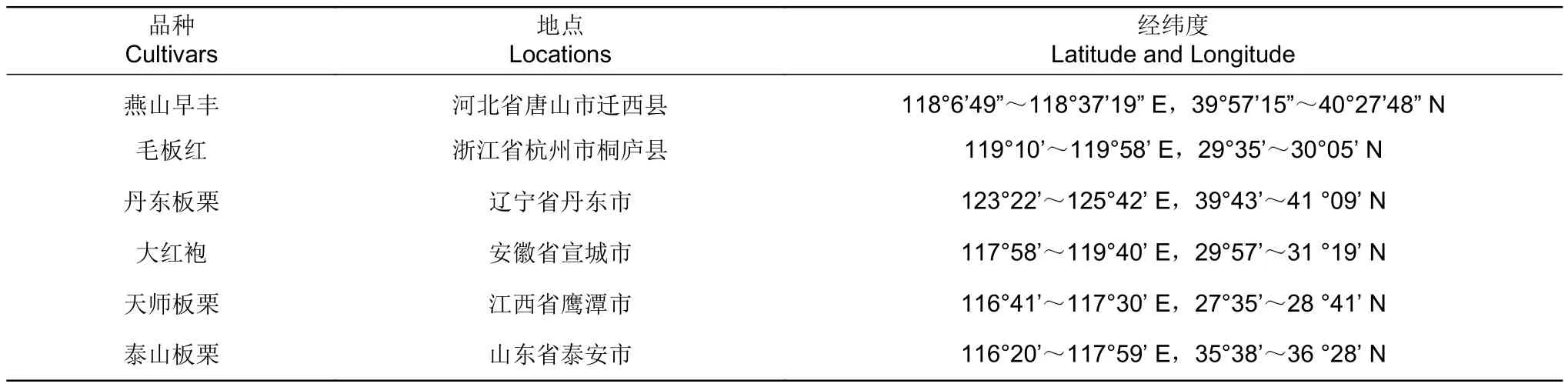
表1 板栗果实样品采集信息Table 1 Collection information of chestnut fruit samples
1.2 果实样品预处理
预处理分为样品分组、表面消毒、组织分组和研磨分装。
样品分组:将果皮表面无虫眼和病害症状的板栗浸泡在自来水中,去掉漂浮果粒(病果)。每品种随机取18~30粒健康板栗,均分为3个组,即每组6~10粒,同品种3组互为生物学重复。
表面消毒:每组经75%酒精浸泡3 min,2%NaClO溶液浸泡5 min,75 %酒精浸泡3 min,无菌水清洗3遍后,用无菌吸水纸吸除板栗表面水分。取最后一次清洗完后的无菌水100 μL涂布PDA平板,以检测消毒是否彻底。
组织分组:无菌超台中,在样品分组的基础上,按果实组织分成果壳(包括种皮)和果肉两亚组。在此过程中,果实的子叶、种皮部位均未发现任何病害症状,表明所取样品均为健康板栗。
研磨分装:来自同一个生物学重复的果壳亚组和果肉亚组的材料分别用表面消毒后的研磨机(泰斯特,天津泰斯特仪器有限公司),高速粗打几秒成碎粒(约5 mm),磨样均分装为两份,一份用于可培养内生真菌的组织分离,另一份打成粉末冻存于−80 ℃用于扩增子高通量测序。磨样过程中,为防样品残留结转,不同组不同亚组样品变换时,研磨机均做充分消毒(超纯水清洗3次+70%乙醇清洗1次+无菌水清洗2次)。
最后形成6个品种、2个组织、每个组织3个重复,共36个样品,样品记号请见正文。
1.3 DNA提取和ITS片段扩增
用于非培养内生真菌组测序的36个样品基因组DNA的提取参照修改后的Aboul-Maaty等人的CTAB法[16]。将冻于−80 ℃的样品材料取50 mg放入无菌研钵中,用液氮充分研磨装于2 mL离心管中,后快速加入800 μL于65 ℃预热的2% CTAB(0.1%β-巯基乙醇)提取液(酷来博)。6 mol.L−1NaCl溶液替换成5 mol.L−1NaCl溶液。其他步骤不变。50 μL 1×TE缓冲液溶解DNA,DNA浓度用NanoDrop ND-2000分光光度计 (Thermo Fisher Scientifific,Waltham,MA,USA)测定,浓度合格后交由北京奥维森公司进行PCR扩增及Illumina MiSeq平台测序,扩增区域为ITS1,引物为ITS1F(CTTGGTCATTTAGAGGAAGTAA)和ITS2R(G CTGCGTTCTTCATCGATGC)[17]。
分离培养获得的真菌材料的基因组DNA采用修改后的CTAB法进行提取[18],ITS扩增引物为ITS1和ITS4或者ITS5和ITS4[19],扩增序列交由上海生物工程有限公司测序。
1.4 Miseq测序及生信分析
下机读段raw data经过QIIME1(v1.8.0)[20]软件根据Barcode序列拆分样本,使用Pear(v0.9.6)软件对数据进行过滤、拼接,去除打分值低于20,含有模糊碱基,引物错配序列。拼接时最小overlap设置为10 bp,错配率为0.1。拼接后使用Vsearch(v2.7.1)软件去除长度小于230 bp的序列,并根据Gold Database数据库用uchime方法比对去除嵌合体序列,形成clean data。基于Unite数据库[21]比对注释后,使用Vsearch(v2.7.1)软件uparse算法对优质序列以97%序列相似度划分分类单元(Operational Taxonomic Units,OTUs)。利用 QIIME1(v1.8.0)软件进行α多样性指数分析(包括Shannon、Chao指数),同时计算beta多样性距离矩阵,综合ANOSIM组间差异检验结果,对样本进行NMDS非度量多维尺度分析。用Phython(v2.7)软件进行LEfSe分析,找出在不同分类水平对样本结构差异产生显著性影响的类群。Miseq测序数据已上传 NCBI(SUB9969166)。
1.5 内生真菌的组织分离培养及分子鉴定
组织分离可培养真菌的培养基为MEA(90 mm皿),每皿7~8块组织、每个样品约350块。25 ℃培养黑暗下生长5~7 d,挑取菌丝在相同培养基和条件下扩培纯化2周。以品种下的组织部位为最小划分单元,单元总数为6(6个品种)×2(2个组织部位)=12个。依据菌落形态特征对同一单元内部的分离菌株进行初期归类和数量统计,每单元中挑选出每类代表性菌落1株进行分子鉴定菌种并相互印证形态归类的一致性。
分子鉴定依据ITS序列在NCBI的BLASTn结果,参数为相似性(Identity>97%)、覆盖率(Coverage>75%),并参考培养菌落性状与模式菌种菌落形态、系统发育树构建(ML法),限于篇幅,本研究鉴定过程数据未列出,直接应用鉴定结果。菌种鉴定序列见NCBI序列号:OM574649-OM574769。
1.6 作图与统计分析
非培养测序分析结果基于OTU物种注释及相对丰度结果和Weighted Unifrace距离等,使用R(v3.6.0)软件对物种组成柱状图,NMDS图,韦恩图进行绘制。分离培养的内生真菌种群多样性组成和结构分析用图,依据数据在Excel(Office 2016)统计分析形成。所有数据在相同总数下进行统计计算形成可比较性,组内组间数据依据分析处理需要或以重复平均值或以组合加减,柱状图形均采用相对丰度。
2 结果与分析
2.1 板栗果实及其组织的内生真菌组多样性
经过序列去噪和质量过滤后,6个品种的果实及其2个组织共36个样本总共产生3 229 205条符合质量的序列,样本序列数最少27 025条、最多 268 176 条,平均 89 700±52 015 (mean±SD)条序列,注释出真菌OTUs 1 557个。
板栗果实内生真菌群落存在丰富的多样性(表2)。36个样本中,Chao指数范围为185.74±31.24(丹东板栗果壳部位)~343.67±34.96(天师板栗果肉部位);Shannon指数范围为1.86±1.12(毛板红果壳部位)~4.97±0.48(燕山早丰果肉部位)。果壳和果肉组织间,果肉具有明显高于果壳的Chao指数和Shannon指数。

表2 基于 Turkey 检验的板栗果实内生真菌群落Alpha多样性指数分析Table 2 Alpha diversity index analysis of endophytic fungal community in chestnut fruit based on Turkey test
基于ANOSIM组间差异检验的NMDS方法分析的Beta多样性结果表明(图1A-B),品种和组织样品的内生真菌群落构成自身聚类,品种间(R=0.686 4,P=0.001)和组织间(R=0.190 7,P=0.002)内生真菌菌群结构均存在显著性差异。
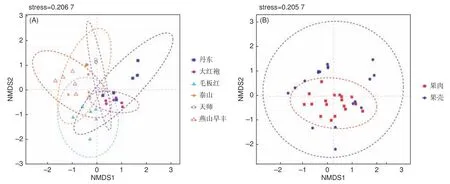
图1 板栗果实内生真菌菌群品种间(A)和组织间(B)Beta多样性Fig.1 Beta diversity analysis of endophytic fungal community between cultivars (A) and tissues (B) in chestnut fruits
2.2 板栗果实及其组织的内生真菌群落组成与结构
2.2.1 果实内生真菌群落 来自于中国板栗6个品种的1 557个OTUs比对到10个门,38个纲,97个目,203个科,350个属。门水平上,子囊菌门Ascomycota真菌为最优势类群,平均相对丰度为80.40%,其次为担子菌门Basidiomycota真菌,平均相对丰度为7.7%(图2门)。38个纲中(图2纲),优势丰度类群主要归于粪壳菌纲Sordariomycetes(平均相对丰度43.00%)、酵母纲Saccharomycetes(平均相对丰度15.10%);203个科单元中(图2科),圆孔壳科Sporocadaceae平均相对丰度(11.59%)位于第一;350个属中(图2属),有近13个属平均相对丰度占比超过1%,包括拟盘多毛孢属Pestalotiopsis、梅奇酵母属Metschnikowia、镰孢属Fusarium、青霉属Penicillium、德巴利酵母属Debaryomyces等,其中拟盘多毛孢属Pestalotiopsis平均相对丰度最高(8.95%)。6个板栗品种果实共享了103个OTUs(图3左),全部来自座囊菌纲Dothideomycetes、古根菌纲Archaeorhizomycetes和一待定名纲的类群,其中座囊菌纲在共有纲类中占据了92%以上的丰度(表3),该纲共有6个目的类群在果实中发现,其中3个目格孢腔菌目Pleosporales、煤炱目Capnodiales和葡萄座腔菌目Botryosphaeriales的丰度占据近85%,格孢腔菌目的真菌丰度最高(55.34%);3个目中,统计有19个科和29个属的真菌丰度,其中丰度大于5%的科7个、丰度大于2%的属有5个。属水平上,枝孢属Cladosporium的丰度最高(5.83%),其次为葡萄座腔菌属Botryosphaeria(3.88%)。

表3 板栗果实品种间共享内生真菌OTUs优势类群分析Table 3 Analysis of dominant groups of endophytic fungi OTUs shared among chestnut fruit varieties

图2 板栗果实品种及组织内生真菌菌群结构分析Fig.2 Analysis of endophytic fungal structure in different cultivars and tissues of chestnut fruit

图3 板栗果实品种及组织内生真菌操作分类单元(OTUs)分析Fig.3 Analysis of endophytic fungal OTUs in different cultivars and tissues of chestnut fruit
板栗果实品种间的内生真菌组成结构不同。从门水平来看(图2门),子囊菌门Ascomycota和担子菌门Basidiomycota类群相对丰度在燕山早丰、丹东板栗、大红袍、毛板红、泰山板栗及天师板栗中都处于第一和第二位置,其相对丰度分别为76.74%和5.07%、85.33%和5.59%、90.15%和3.98%、57.96%和23.71%、87.51%和4.56%、84.73%和3.28%。此外被孢霉门Mortierellomycota、球囊菌门Glomeromycota、罗兹菌门Rozellomycota以及壶菌门Chytridiomycota在这6个品种中也都占据一定丰度。还有4个门类真菌只出现在部分品种中,例如丹东板栗、大红袍、毛板红和泰山板栗中有少量毛霉菌门Mucoromycota真菌,而燕山早丰和天师板栗中则没有;在纲层面(图2纲),粪壳菌纲和座囊菌纲真菌是燕山早丰和天师板栗中的优势纲类群,其中粪壳菌纲相对丰度最高,在两品种中相对丰度分别为29.47%、52.91%。大红袍品种中优势纲由酵母纲(39.21%)、粪壳菌纲(32.52%)和散囊菌纲Eurotiomycetes(16.36%)组成。毛板红品种中优势纲以粪壳菌纲(36.62%)、酵母纲(13.68%)和银耳纲Tremellomycetes(18.82%)为主。粪壳菌纲(46.93%)、座囊菌纲(22.09%)和散囊菌纲(12.19%)真菌是泰山板栗中的优势类群。而丹东板栗中,仅粪壳菌纲真菌(59.56%)的相对丰度就接近60%;从科水平来看(图2科),燕山早丰,泰山板栗和天师板栗品种中圆孔壳科相对丰度最高,其相对丰度分别为11.71%、18.41%和36.90%。而赤壳科Nectriaceae、小丛壳科Glomerellaceae则分别是丹东板栗和大红袍、毛板红品种中相对丰度最高的类群,其相对丰度分别为9.43%和23.62%、27.14%;属水平上(图2属),以相对丰度>10%为界,大红袍中有梅奇酵母属Metschnikowia(20.98%)、镰孢属Fusarium(20.23%)及青霉属Penicillium(12.22%),毛板红中为炭疽菌属Colletotrichum(27.14%)和Guehomyces(12.93%),泰山板栗中为拟盘多毛孢属Pestalotiopsis(18.19%)和青霉属Penicillium(11.30%),天师板栗中则为拟盘多毛孢属Pestalotiopsis(29.76%)和葡萄座腔菌属Botryosphaeria(14.27%)。而燕山早丰和丹东板栗中,所有属的相对丰度均在10%以下。燕山早丰中相对丰度大于5%的属有5个,最高为青霉属Penicillium(6.64%),最低为拟盘多毛孢属Pestalotiopsis(5.15%)。丹东板栗相对丰度大于5%的属有3个,分别是镰孢属Fusarium(8.64%)、拟茎点霉属Phomopsis(7.60%)和梅奇酵母属Metschnikowia(5.59%)。
2.2.2 果实组织的内生真菌群落 果壳和果肉在门水平上内生真菌群落组成结构相似,但同一门内,除子囊菌门的丰度是果肉(72.13%)小于果壳(88.61%)外,果肉中其他门的丰度都明显高于果壳(图2);纲水平上(图2),粪壳菌纲在不同组织中相对丰度均为最高,且果壳(58.69%)是果肉(27.24%)的2倍,而酵母菌纲在果肉中(21.99%)是果壳(8.27%)的近3倍;在科层面(图2),16个科的相对丰度占比超过1%。德巴利酵母菌科在果肉中的丰度最高(9.95%),圆孔壳科在果壳中的丰度最高(18.73%)。属水平上(图2),17个属相对丰度占比超过1%,包括拟盘多毛孢属Pestalotiopsis、炭疽菌属Colletotrichum、梅奇酵母属Metschnikowia、镰孢属Fusarium等。
按照专性分布数目、分类单元、相对丰度>0.5%,列出了各分类阶级水平的真菌群落分布情况(表4)。专性果肉分布的真菌群落多样性均明显高于果壳,并以高级分类阶级门、纲和目最为突出,果肉分别有2、7和15个单元,而果壳中缺乏门和纲的单元,仅在目中出现1个冠囊菌目Cronophorales。果肉专性分布的最优势类群,门以下均为担子菌,银耳纲、红菇目Russulales、红菇科Russulaceae、马拉色菌科Malasseziacea、以及Mycoacia属;而果壳中专性分布的目和科最优势类群均为子囊菌,冠囊菌目、夹孢腔菌科Sporormiaceae,但属中是担子菌酵母Rhodosporidiobolus属丰度最高。
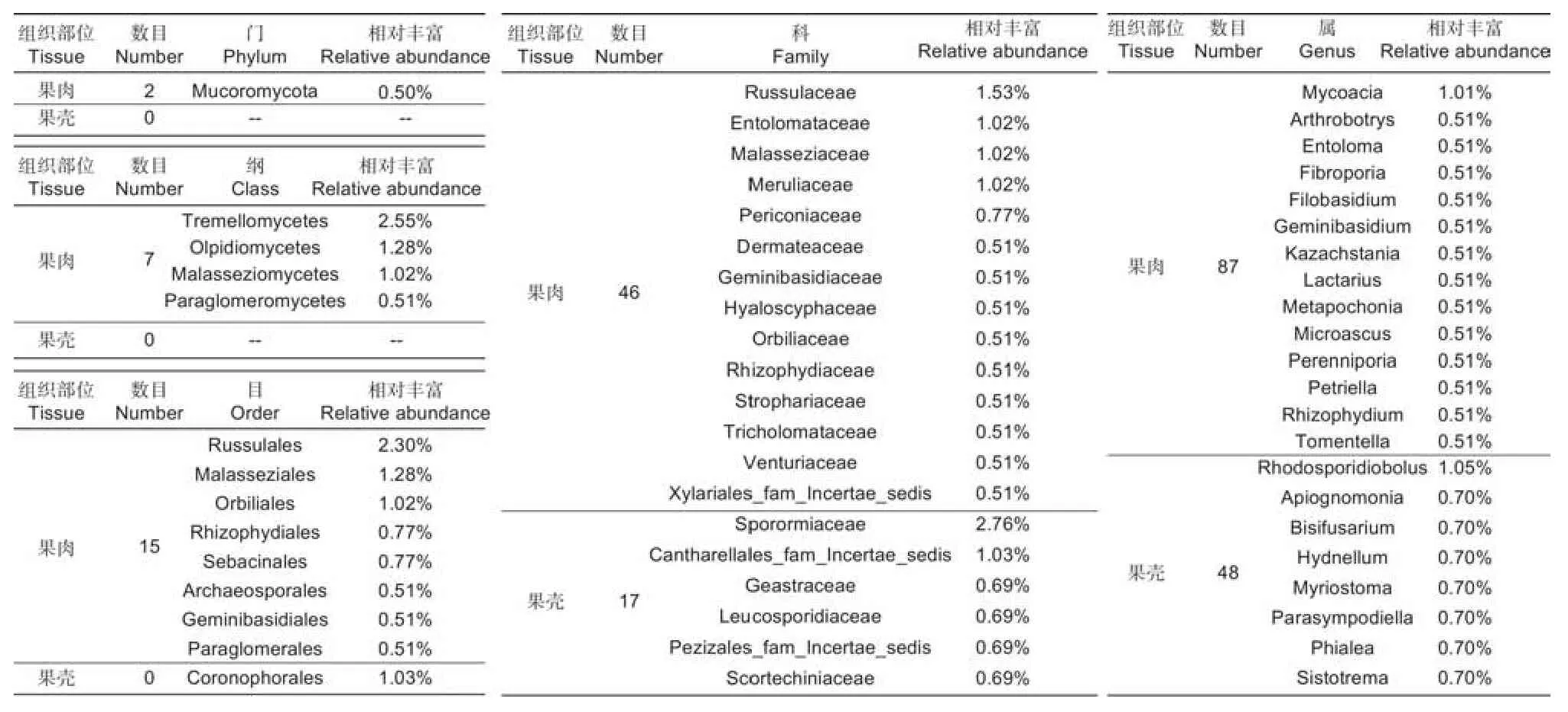
表4 板栗果实组织间共享内生真菌OTUs优势类群分析Table 4 Analysis of dominant groups of endophytic fungi OTUs shared among chestnut fruit tissues
2.2.3 果实组织间显著差异性群落和种群 多级物种层级分析LEfSe显示(图4),板栗果实果壳和果肉在不同分类阶级水平上存在显著性差异群落组成或种群。依LDA score>4及点分支图分析,门水平中的子囊菌门和担子菌门,纲水平的粪壳菌纲、银耳纲和酵母纲,属水平中的镰孢属Fusarium、梅奇酵母属Metschnikowia、迈耶氏酵母属Meyerozyma和德巴利酵母属Debaryomyces以及种水平的梅奇酵母菌Metschnikowia sp.、汉斯德巴利酵母菌Debaryomyces hansenii、卡利比克迈耶氏酵母Meyerozyma caribbica和Fusarium guttiforme,这些群落或种群对果壳和果肉间差异具有显著影响。

图4 板栗果实组织间内生真菌菌群差异分析Fig.4 Analysis of differences in endophytic fungal community among chestnut fruit tissues
2.3 可培养的内生真菌群落
传统组织分离法共获得有效菌株2 346株,代表性菌落共计120株,依ITS序列、菌落形态及系统发育树鉴定出76个种(表5),可归于33属、22科、13目、7纲、3门(图5)。6个品种间的相同分类单元合并并相加分离频次除以有效菌株数作为相对丰度值。依丰度由高到低,形成了板栗果实可培养的内生真菌群落分布情况(图5)。门和纲水平上,分离频次丰度最高的是子囊菌门Ascomycota和粪壳菌纲Sordariomycetes,散囊菌纲Eurotiomycetes、座囊菌纲Dothideomycetes、毛霉菌纲Mucoromycetes也较高频次分离到。目和科水平上,间座壳目Diaporthales和夹孢腔菌科Sporocadaceae的丰度分别最高;新拟盘多毛孢属Neopestalotiopis在属阶级中分离频次丰度最高。果肉和果壳组织分离到的最高频次的类群或种群基本一致(表6),门、纲、目水平中,分别为子囊菌门、粪壳菌纲、间座壳目,但果壳(40.13%~71.34%)中的丰度明显高于果肉(10.82%~19.52%);科和属水平中,果壳是日规壳科Gnomoniaceae(21.34%)和梨孢日规壳属Apiognomona(16.29%)、果肉是间座壳科Diaporthaceae(8.57%)和间座壳属Diaporthe(8.57%)。各阶级中的组成单元数上,门、纲、目水平,果肉多于果壳;科和属水平,果壳多于果肉;同一分类单元,果壳的丰度往往高于果肉。
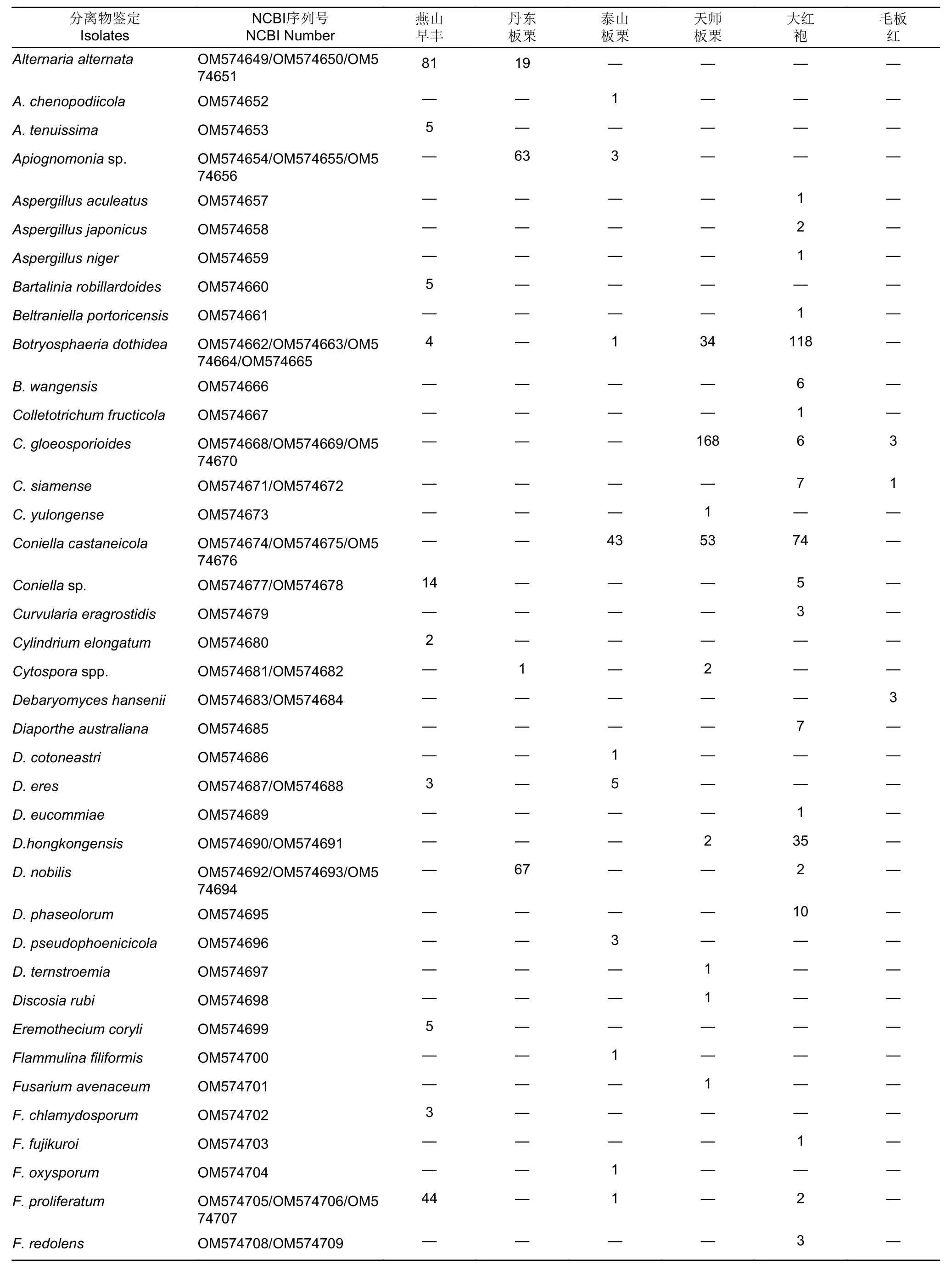
表5 板栗果实可培养内生真菌分离结果Table 5 Isolation results of cultrable endophytic fungi from chestnut fruit

续表5
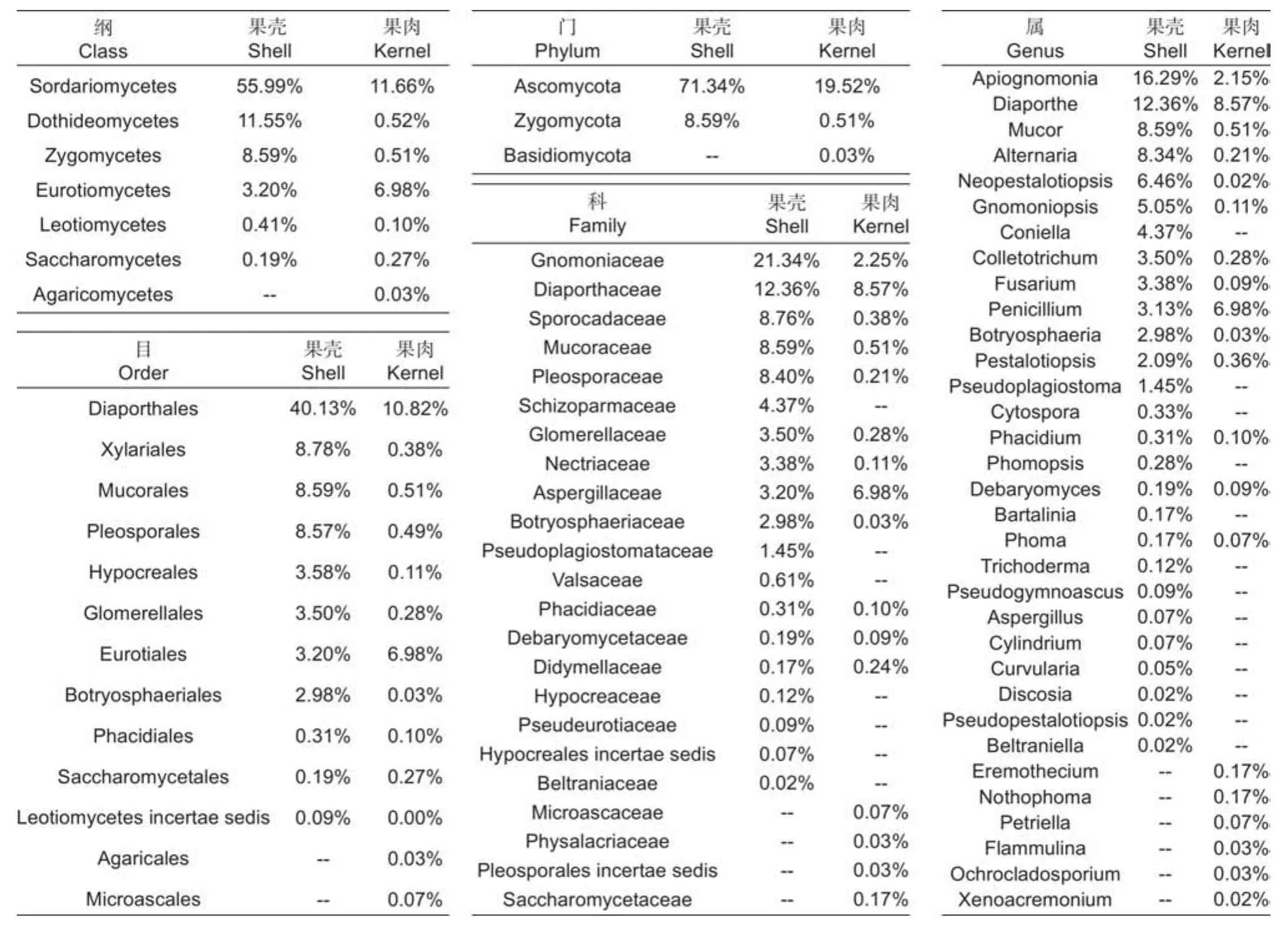
表6 板栗果实组织间可培养内生真菌在各分类阶级上的分布情况Table 6 Distribution of culturable endophytic fungi among chestnut fruit tissues in different taxonomic classes

图5 板栗果实可培养内生真菌在各分类阶级上的分布情况Fig.5 Distribution of cultrable endophytic fungi from chestnut fruits in different taxonomic classes
3 讨论
3.1 板栗果实内生真菌组群落结构及其组成
中国板栗果实具有丰富的内生真菌群落多样性(表1),且其内生真菌群主要以子囊菌门和担子菌门(门水平)、粪壳菌纲和酵母纲(纲水平)、圆孔壳科(科水平)以及包括拟盘多毛孢属Pestalotiopsis在内的13个属(属水平)等为优势类群的群落构成。该结果与其他果实的研究报道一致[3,8],并被认为是子囊菌真菌具有更快的进化速率和适应性从而形成更高多样性的结果[22]。6个品种间果实共有(shared)种群则全部为子囊菌,其中优势纲类和优势目类分别是座囊菌纲(丰度>90%)和格孢腔菌目(丰度近50%)(表3);优势种群(>2%)可能来自枝孢属Cladosporium、葡萄座腔菌属Botryosphaeria、弯孢属Curvularia、球腔菌属Phaeosphaeria 和亚球壳属Sphaerulina(表3)。这些来自上述共有优势属的种群可能是中国板栗果实内生真菌的建群种群。
数据显示板栗果实品种间的内生真菌群落组成结构具有明显差异(图2),不同品种板栗果实均以子囊菌门为最优势类群(图2门),其次是担子菌门,但包括毛霉菌门在内的其他4个门的真菌只出现在丹东板栗、大红袍、毛板红和泰山板栗中。纲水平开始优势类群出现不同,毛板红品种中相对丰度最高的是酵母菌纲真菌,而另外5个板栗品种中最丰富类群为粪壳菌纲真菌(图2纲)。在科水平(图2科),圆孔壳科是燕山早丰,泰山板栗和天师板栗中最丰富的类群,而赤壳科、小丛壳科则分别是丹东板栗和大红袍、毛板红品种中相对丰度最高的类群。在属层面,品种间的群落组成结构差异更大(图2属)。优势属(相对丰度>10%)在大红袍中为梅奇酵母属Metschnikowia、镰孢属Fusarium及青霉属Penicillium,毛板红中为炭疽菌属Colletotrichum和Guehomyces,泰山板栗中为拟盘多毛孢属Pestalotiopsis和青霉属Penicillium,天师板栗中则为拟盘多毛孢属Pestalotiopsis和葡萄座腔菌属Botryosphaeria。燕山早丰中优势属(相对丰度>5%)由包括青霉属Penicillium在内的5个属组成,而以镰孢属Fusarium为首的3个属则是丹东板栗中的优势属。这些材料来自从北到南的华北和华东板栗主产区或分布区,因此,我们认为这些差异代表了地理区域性或品种的遗传属性[23-25]。
可培养方法得到的结果进一步证实了上述论证,在分离获得的内生真菌种类中,有80%的种类属于子囊菌门,11%的属于毛霉菌门,余下种类属于担子菌门;纲和科水平上,丰度最高的分别是粪壳菌纲(>60%)和圆孔壳科(>20%);属阶级上丰度>5%的优势种群来自包括有拟盘多毛孢属Pestalotiopsis、青霉属Penicillium、炭疽菌属Colletotrichum、葡萄座腔菌属Botryosphaeria、镰孢属Fusarium等(图5)。另一方面,缺失高通量测序技术检测的优势酵母菌种群,说明了可培养方法的局限性,需要增加酵母类选择性培养基予以改进[26]。
3.2 板栗果实组织内生真菌群落组成特点
板栗果实果肉组织多样性高于果壳组织,这与苹果果实的研究结果相反,苹果果实的果皮(外果皮)组织中真菌多样性要高于果肉(中果皮)组织[3]。果实不同组织部位具有不同的真菌群落[3,27],如苹果果实不同部位(茎末端、花萼末端、果皮和果肉)中真菌类群组成显著不同[3]。板栗果实根据形态差异分为果壳(果皮)、种皮和子叶、胚轴等部分,本研究将果皮和种皮合并为果壳材料,将子叶(含胚轴)称为果肉材料。这些组织部位不同的物理和化学性质可能对栖息在该微环境中的真菌物种产生影响[24]。我们的研究发现板栗果肉比果壳具有更高的特有内生真菌多样性(图3右),一是专性分布果肉组织的内生真菌OTUs数多出果壳组织102个(图3右),二是专性分布的真菌在各级分类水平中,果肉中内生真菌组成单元数明显均高于果壳(表4),三是特有优势类群在果肉和果壳中不同(表4),果肉为毛霉门、担子菌的红菇目、红菇科和马拉色菌科、Mycoacia;而果壳属于子囊菌的冠囊菌目、夹孢腔菌科,属却属于担子菌的Rhodosporidiobolus。
LEfSe分析表明(图4),在具有显著差异群落中,镰孢属Fusarium、梅奇酵母属Metschnikowia、迈耶氏酵母属Meyerozyma和德巴利酵母属Debaryomyces真菌在果肉组织中占据显著性优势。板栗果肉组织中具有显著性优势的酵母真菌种群或其群落组成与结构,可能在板栗果实健康中起着重要的作用。梅奇酵母属Metschnikowia[28-30],德巴利酵母属D.hansenii[31]和迈耶氏酵母属M.caribbica[29]真菌,报道为具有益生和生防作用的功能菌。粪壳菌纲和酵母纲的真菌在板栗果肉果壳组织中,丰度高,而这两类真菌中,多为促生[32-33]和拮抗种群[34-35]。板栗果实腐烂病发生在果肉(子叶)组织上,是由多种病原真菌在果实生长发育期潜伏侵染、成熟期和采后内在或环境诱发因子作用下形成发病高峰期的复合侵染性病害,病原种类高达几十种[36-38]。这些病原菌的同种或相似种类,在无症状板栗果实中,经高通量测序技术的非培养技术和组织分离的可培养方法中,都检测或分离到。
4 结论
本研究利用非培养技术结合可培养方法,对板栗果实及其组织的内生真菌群落多样性进行了研究报道。板栗果实具有丰富的内生真菌群落多样性,优势群落来自子囊菌的粪壳菌纲和酵母菌纲,但建群种类来自座囊菌纲。板栗果实品种间的内生真菌群落组成结构具有明显差异。果肉组织中种类丰度和群落多样性显著高于果壳。同时板栗果肉和果壳组织内生真菌群落组成具有明显分化,果肉内生真菌群落的特有类群由担子菌的银耳纲等构成,镰孢属Fusarium、梅奇酵母属Metschnikowia、迈耶氏酵母属Meyerozyma和德巴利酵母属Debaryomyces真菌在果肉组织中具有显著优势。上述研究结果为利用微生物组技术改造和构建板栗果实健康微生物组奠定了基础,也为研究坚果类微生物组与宿主互作机制提供了认知,拓展了种子微生物组的知识。同时,各分类水平中存在的高丰度未鉴定OTUs,为挖掘新的内生真菌生物资源奠定了基础。

