不同居群黑骨藤种子特性研究
龙金兰, 黎前利, 杨武海, 吴 媛, 张 娜, 吴之坤
(贵州中医药大学, 贵阳 550025)
种子的萌发特性对后期幼苗的存活能力以及个体间的适合度都会产生影响,还会影响植物生活史的表达[1-5]。种子萌发率是植物种群繁殖能力的体现,种子萌发对物种的繁衍与生存起决定作用[6]。然而,种子萌发是一个复杂的过程,容易受内外因素的影响,内因包括种子自身的萌发以及解除休眠的能力,如种子大小、种子活力、成熟度等[7],外因主要为环境条件,如光照、温度和水分等[8-11]。
黑骨藤(PeriplocaforrestiiSchltr.)为萝藦科(Asclepiadaceae)杠柳属(Periploca)植物,俗称西南杠柳,《中国植物志》称黑龙骨[12]。黑骨藤多生长于海拔2 000 m以下的阴湿杂木林、山地灌丛中,主要分布于贵州、四川、云南、广西等省区[12]。一般缠绕在周边乔木、灌木或者高大的草本植物上,具有白色的乳汁,有一定的毒性。近年来,有关黑骨藤的研究主要集中在化学及药理等方面,尤其是化学方面的研究,在种子生物学,特别是不同居群种子生物学比较方面未见详细的研究。因此,本研究选择不同居群黑骨藤种子作为研究对象,比较不同居群黑骨藤种子的生物学特性差异,并建立黑骨藤种子活力最佳测定方法。
1 材料与方法
1.1 材 料
野外采集9个居群(详见表1)的黑骨藤种子,进行种子特性和萌发特性比较。在蓇葖果完全成熟刚开始开裂时采集,及时置于自然通风处晾干后,人工剥出种子,去除种毛及杂质,选取颗粒饱满的种子,放4 ℃的短期种子库中保存,为后续实验做好准备。实验所用种子经贵州中医药大学鉴定教研室主任吴之坤副教授鉴定为黑骨藤种子,其凭证标本存放于贵州中医药大学中药材种植(养殖)及加工研究所。
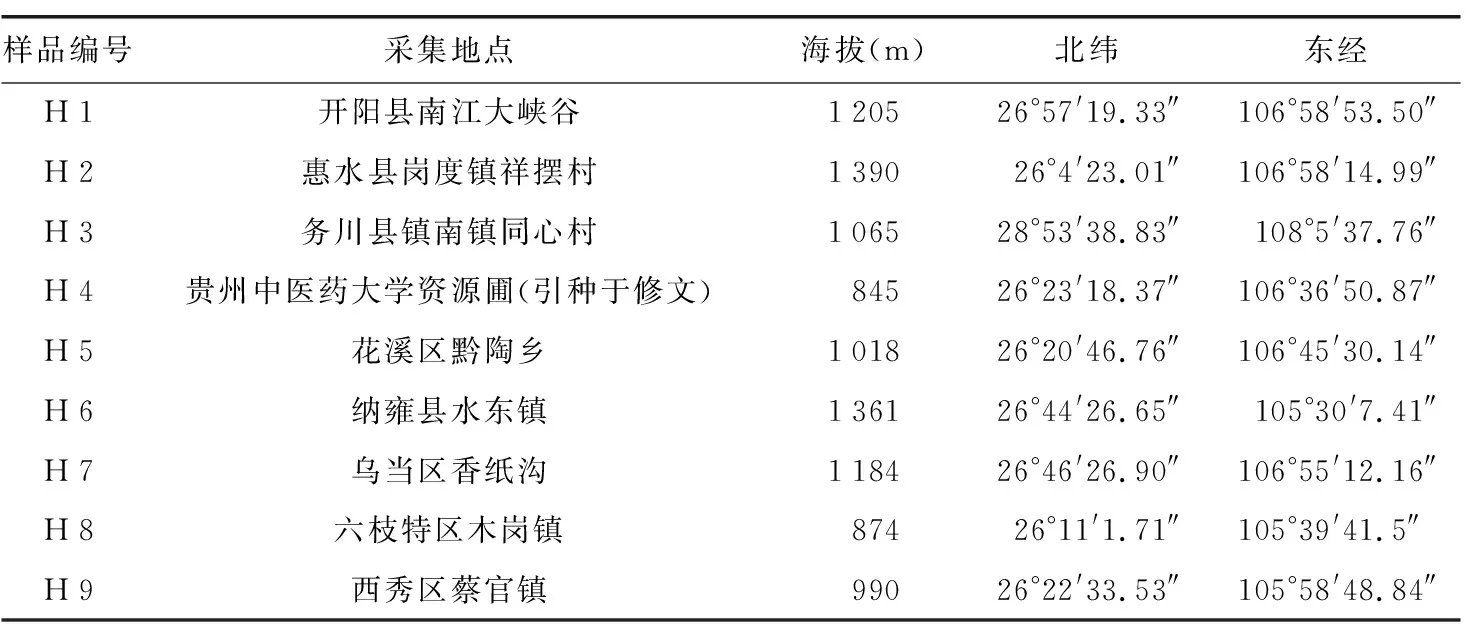
表1 样品采集信息Table 1 Collection information of samples
1.2 方 法
1.2.1种子形态观察与测定
随机选取不同居群的黑骨藤种子100粒,置于体式显微镜下观察种子形态特征,并分别用游标卡尺测定各居群黑骨藤种子的长径和宽径,拍照记录并整理数据。
1.2.2种子百粒重测定
按《农作物种子检验规程》进行测定[13],采用“百粒重”法,将全部已除杂的种子充分混合后,分别随机数取不同居群的黑骨藤种子100粒,用万分之一的分析天平称其百粒重,3次重复,记录数据。
1.2.3种子吸水率测定
称取不同居群的黑骨藤种子1.0 g,分别置于装有蒸馏水的烧杯中,室温下浸泡吸水,每间隔2 h取出种子,用吸水纸吸干种子表面的水分后称量,重复如上操作,直至连续两次称量的差异不超过0.03 g为止,平行操作3次。
1.2.4种子活力测定
1) 磷酸缓冲溶液的配制:按2∶3的比例将溶液甲与溶液乙进行混合(溶液甲:9.078 g KH2PO4溶于1 000 mL的纯化水所得;溶液乙:9.472 g Na2HPO4溶于1 000 mL纯化水中所得)即可。
2) TTC溶液的配制[14]:称取0.1 g C19H15ClN4溶于100 mL磷酸缓冲液中,配制成0.1% TTC溶液,按此法分别配制0.2%、0.3%、0.5%、0.7%、1.0%、1.5%、2.0% TTC溶液,置于棕色瓶中,于冰箱4 ℃避光保存备用。
3) 种子染色与观察:将黑骨藤种子置于培养皿中,加入无菌水于25 ℃的恒温箱内浸泡24 h;取出浸泡后的种子,用滤纸吸干表面的水分,用解剖刀将种子沿种毛脱落处纵切,挑出胚,以不损伤胚为佳,选取胚保留好的一半种胚,放在装有TTC溶液的培养皿内,用锡箔纸包裹培养皿,将培养皿置于恒温箱内避光染色。染色结束,取出培养皿,倾倒出TTC染色液,并用无菌水冲洗3次种胚,再用滤纸吸干种胚表面的水分,观察种胚的染色情况及染色效果,记录数据并拍照(具有活力的种子胚和胚乳会被染成红色[15])。
1.2.5种子活力测定单因素考察
随机选取香纸沟黑骨藤种子,分别设置不同TTC溶液浓度(0.2%、0.3%、0.5%、0.7%、1.0%、1.5%、2.0%)、不同染色时间(1、2、4、8、12、16 h)、不同染色温度(20、25、30、35、40、50 ℃)按1.2.4方法进行染色实验,每个处理3组重复,每组30粒种子。统计并分析种子的染色情况,筛选种子活力测定条件。
1.2.6不同居群黑骨藤种子活力测定
随机选取不同居群的饱满黑骨藤种子各90粒,以最佳的种子活力测定条件进行染色实验,统计并分析种子的染色情况。
1.2.7不同居群黑骨藤种子萌发实验
将不同居群的黑骨藤种子以5.0%次氯酸钠浸泡消毒8 min后,分别置于铺有湿润脱脂棉,光照16 h/黑暗8 h,25 ℃恒温条件下培养,观察种子的萌发情况。萌发标准以胚根突破种皮1 mm以上视为萌发,以连续3 d萌发数不再增加即停止实验,记录数据并计算发芽势和萌发率等,3个重复,每个重复30 粒,比较在相同萌发条件下,不同居群的黑骨藤种子的萌发差异。
1.3 指标测定
吸水率(%)[16]=(种子吸水t时间后的重量/种子未吸水前的重量)×100%;
染色率(%)=(被染种子数/供试种子总数)×100%;
发芽势(%)=(发芽高峰期发芽的种子数/供试种子总数)×100%;
萌发率(%)=(试验结束后萌发种子的总粒数/供试种子总数)×100%;
发芽指数[17-18]=∑(Gt/Dt),Gt为在第t天发芽的种子数,Dt为相应的发芽天数;
萌发时滞[19]:从萌发试验开始到第1粒种子开始萌发所需要的天数;
萌发历期[20]:从萌发试验开始到结束萌发需要的天数(结束萌发即以萌发数不再增加的第1天为计)。
1.4 数据处理
采用 Microsoft Excel 软件进行统计,用SPSS 23.0 软件进行单因素方差分析,比较不同处理之间的差异性。
2 结果与分析
2.1 不同居群黑骨藤种子形态观察
成熟度判断,成熟的黑骨藤种子外观饱满且有光泽,未成熟的种子干瘪,易断。通过水试,成熟的种子沉于水下,未成熟的种子则是浮于水面。以手掐试,成熟的种子手掐不折,未成熟的种子则轻掐即断。
黑骨藤果实为蓇葖果双生。种子呈不规则纺锤形,由种皮和胚组成,属双子叶无胚乳种子;种皮坚硬,表面无毛,粗糙不光滑,具光泽;顶端具白色绢质种毛,颜色多数呈褐色或棕色;具不规则的突起,沟壑明显,且大多为3~4条,顶端狭尖;子叶和胚根白色,子叶2片,对称。不同居群黑骨藤种子仅颜色和大小有差别,外观形态变异稳定。详见图1。

注:A为黑骨藤果实(蓇葖双悬果);B为黑骨藤种子(a为种子,b为种毛);C为开阳县;D为惠水县;E为务川县;F为贵中医资源圃;G为黔陶乡;H为纳雍县;I为乌当区;J为六枝特区;K为西秀区。图1 黑骨藤种子形态Fig.1 Seeds morphology of P. forrestii
由表2可看出,不同居群的黑骨藤种子的长径和宽径均有极显著差异,种子长径均值为12.241 2 mm,变化范围在10.89~13.60 mm之间,组间差异极显著;种子宽径均值为2.213 6 mm,变化范围在1.98~2.44 mm之间,组间差异极显著。种子长径表现为:H 1>H 5>H 3>H 6>H 7>H 8>H 2>H 4>H 9;种子宽径表现为:H 3>H 9>H 2=H 5>H 4>H 8>H 6=H 7>H 1。
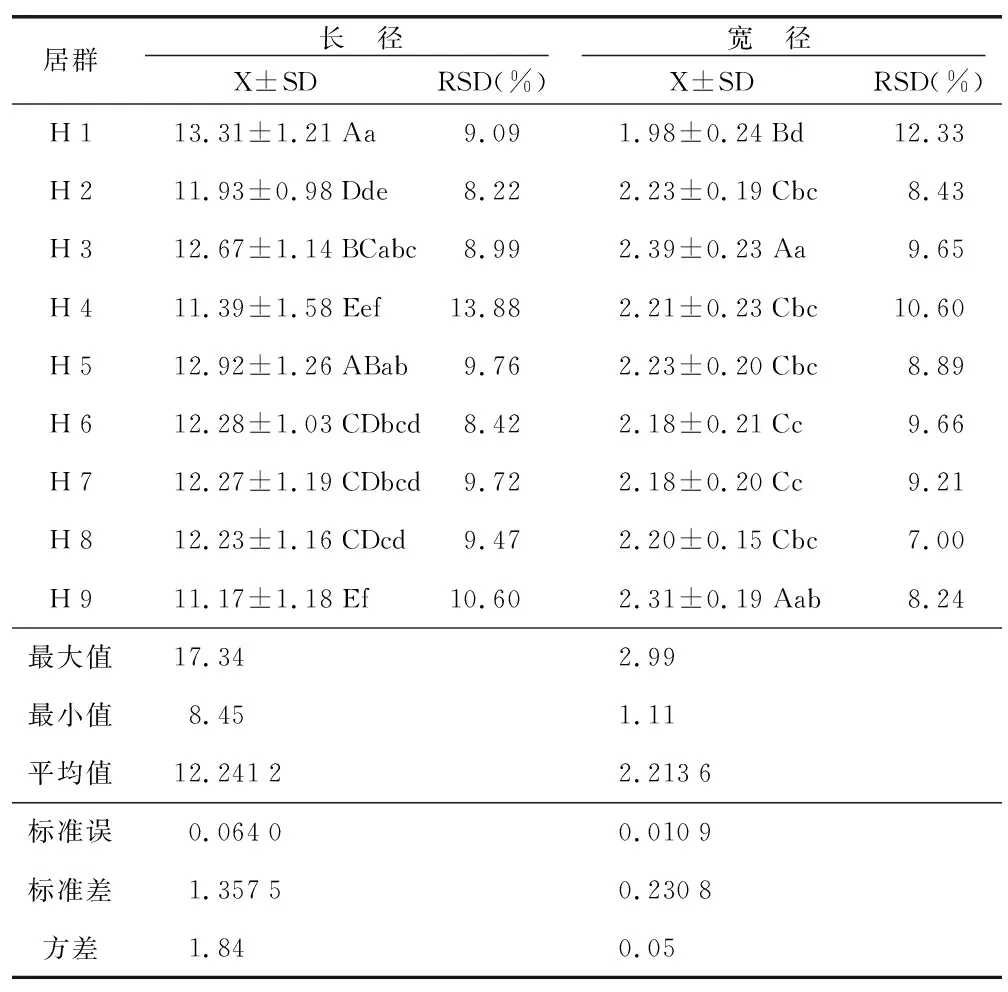
表2 不同居群黑骨藤种子大小测定结果Table 2 Test results for P. forrest from different populations
H 1的黑骨藤种子最长,平均值在13 mm以上,其种子长径除与H 5种子的无显著差异外,与其余7个居群的长径差异均达极显著性。H 3的种子整体外观相对较大,而H 5的次之。
2.2 不同居群黑骨藤种子特性测定结果
由表3可知,吸水率在70%以上的有H 4、H 5、H 7 和H 9共4个居群;吸水率在60%~70%之间的有H 1、H 6和H 8共3个居群,吸水率在50%~60%之间的有H 2和H 3两个居群,组间差异显著。不同居群吸水率依次为:H 5>H 4>H 7>H 9>H 8>H 1>H 6>H 2>H 3。由此可知,生长环境的不同,种子的吸水能力也有所差异。
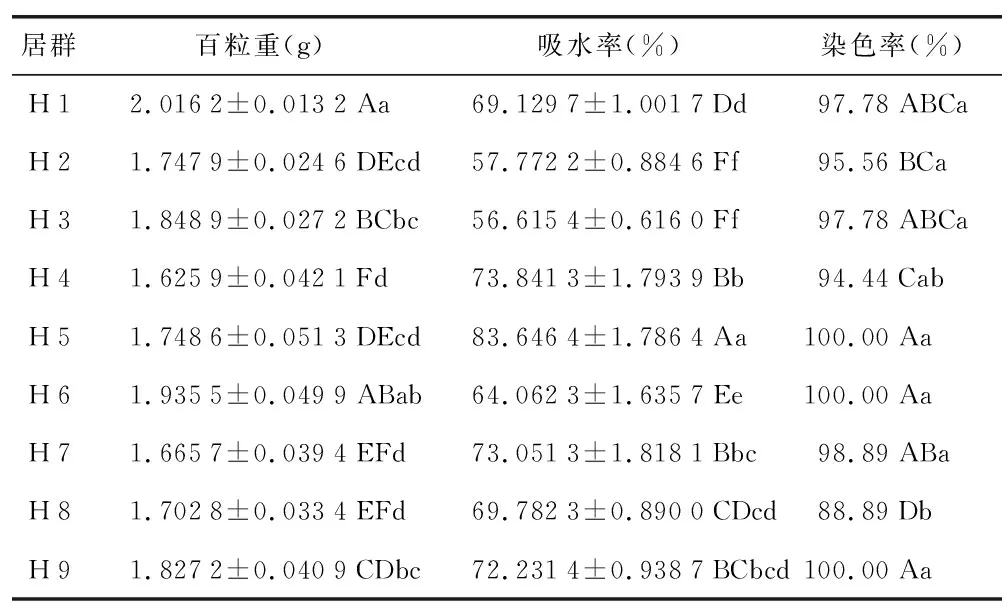
表3 不同居群黑骨藤种子百粒重、吸水率、染色率测定结果Table 3 Test results for 100-grain weight,water absorption rate and dyeing rate of P. forrestii from different populations
由表4可知,黑骨藤种子百粒重均值为1.791 0 g,变化范围为1.625 9~2.016 2 g,各居群的组间差异均达显著水平。H 1的种子百粒重最高(2.016 2 g),说明H 1的黑骨藤种子饱满度最好,且除与H 6的百粒重差异不显著外,与其他7个居群间的百粒重均具极显著差异。不同居群黑骨藤种子百粒重依次为:H 1>H 6>H 3>H 9>H 5>H 2>H 8>H 7>H 4。
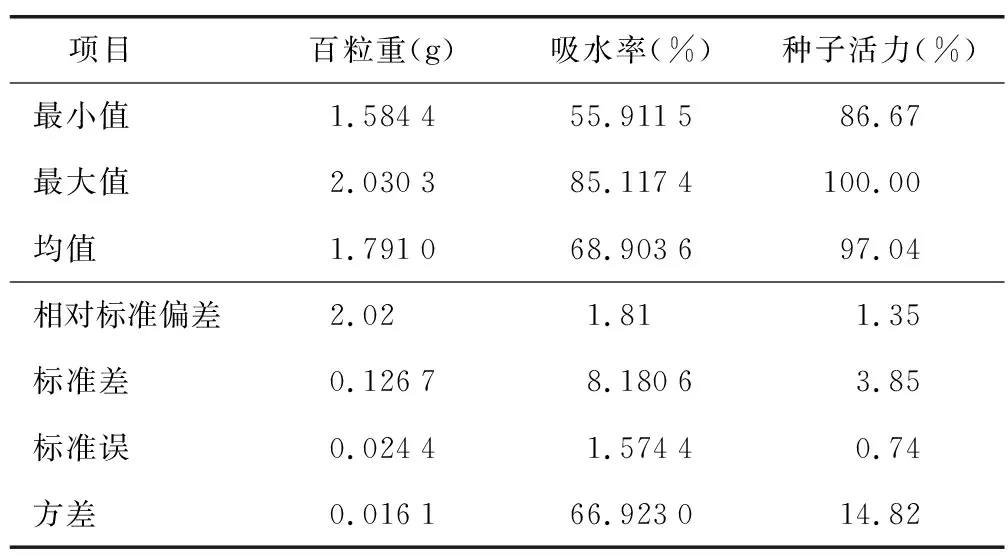
表4 黑骨藤种子百粒重、吸水率及种子活力描述统计分析结果Table 4 Analysis results with descriptive stastics of 100-grain weight,water absorption rate and seed vigor of P. forrestii seeds
2.3 不同染色条件对黑骨藤种子染色的影响
2.3.1不同TTC染色浓度对黑骨藤种子染色的影响
由图2 A可知,在不同浓度TTC溶液处理下,随着浓度的升高,黑骨藤种子的染色率呈先升后降的趋势。TTC浓度达到1.0%时,染色率最高(95.56%),与0.7% TTC浓度无显著差异,与2.0% TTC浓度差异极显著外,与0.2%、0.3%、0.5%、1.5%均具有显著差异。故而选择1.0%TTC浓度进行后期的黑骨藤种子染色实验。
2.3.2不同染色时间对黑骨藤种子染色的影响
由图2 B可知,在不同染色时间处理下,随着染色时间的增加,黑骨藤种子的染色率呈先升后降的趋势。在染色时间为8 h时,染色率达最高(98.89%),随着染色时间增加,染色率反而降低。经SPSS 23.0软件进行两两比较,除与染色4 h差异不显著外,与染色1 h、2 h、12 h、16 h的差异均达极显著。故而选择8 h作为黑骨藤种子的最佳染色时间,继续后续的种子染色实验。
2.3.3不同染色温度对黑骨藤种子染色的影响
由图2 C可知,在不同染色温度处理下,随着染色温度的升高,黑骨藤种子的染色率呈先升后降的趋势。在25 ℃时,染色率达最高(95.56%),之后,随着温度的升高,染色率逐渐降低,与20 ℃差异不显著外,与30 ℃、35 ℃均达显著差异,而与40 ℃、50 ℃具有极显著差异。故而选择25 ℃作为最佳的种子染色温度,进行后续的染色实验。
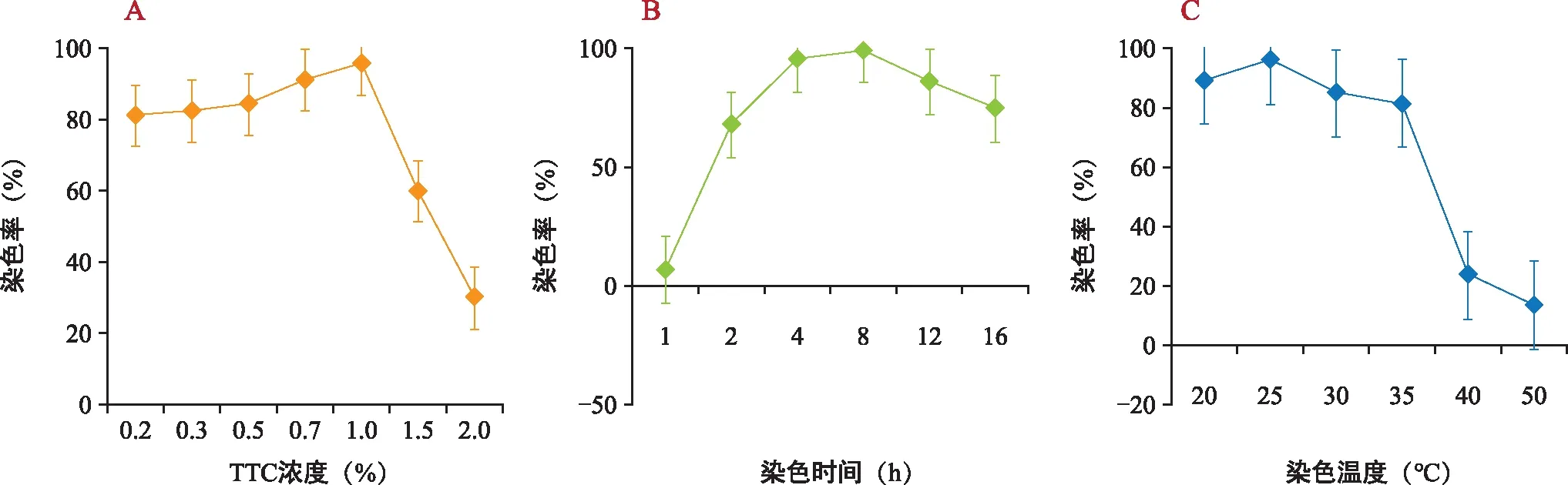
图2 不同染色条件处理下染色率变化Fig.2 The dyeing rate changes under different dyeing conditions
2.4 不同居群黑骨藤种子的染色率差异
由表3可知,染色率在90%以上的居群有8个,其中H 5、H 6、H 9等3个居群的黑骨藤种子活力高达100.00%,染色率低于90%的居群仅有H 8。H 8的种子活力最低,与H 2差异显著,与H 1、H 3、H 5、H 9等6个居群均具有极显著差异。不同居群的黑骨藤种子的染色率之间虽存在一定的差异性,但都具有较高的活力,均达85%以上。
不同居群的黑骨藤种子均具有活力,且活力值都较高。除用染色法进行检测外,还结合萌发实验对不同居群的黑骨藤种子进行种子活力检测,比较其萌发差异。
2.5 不同居群黑骨藤种子萌发特性的差异
2.5.1不同居群黑骨藤种子发芽势的差异
不同居群黑骨藤种子在萌发过程中存在一定差异,H 7在第1天就开始萌发,H 6第4天开始萌发,H 2、H 4、H 5、H 8、H 9均在第5天开始萌发,H 1、H 3在第6天开始萌发。
由表5可知,发芽势在80%以上的居群仅有H 3,与H 7不具显著差异外;与H 1、H 4、H 5、H 7等4个居群之间差异极显著;与H 2、H 4之间的发芽势差异显著。发芽势在70%~80%之间的居群有H 2、H 6、H 8和H 9,4个居群与各居群间的组间差异极显著;发芽势在60%~70%之间的居群仅有H 1,与H 3、H 6、H 8、H 9四个居群之间的发芽势均具有极显著性差异;与H 2、H 4具有显著性差异。发芽势在60%以下的居群有H 4、H 5和H 7。发芽势表现为H 3>H 9>H 6>H 8>H 2>H 1>H 7>H 5>H 4。
2.5.2不同居群黑骨藤种子萌发率的差异
由表5可知,萌发率在90%以上(不含90%)的居群有H 3、H 6、H 8和H 9,组间差异极显著;萌发率在80%~90%之间的居群有H 1、H 2、H 4、H 5,组间差异显著。萌发率在80%以下的居群仅有H 7。不同居群萌发率表现为:H 9>H 3>H 6>H 8>H 2>H 1、H 4>H 5>H 7。除H 5外,H 7与其他居群萌发率差异均达显著水平。
2.5.3不同居群黑骨藤种子发霉率的差异
由表5可知,H 1的黑骨藤种子发霉率最高(5.56%),其次是H 7(4.44%)、H 6(2.22%),而H 2、H 3、H 4、H 5、H 8和H 9等6个居群的黑骨藤种子发霉率均为0,不同居群间的发霉率也存在一定差异。
2.5.4不同居群黑骨藤种子发芽指数的差异
由表5可知,发芽指数在22以上的居群有H 3、H 9;发芽指数在20~22之间的居群有H 6、H 8;发芽指数在18~20之间的居群有H 1、H 2、H 7;发芽指数在16~18之间的居群有H 4、H 5,各居群间的组间差异显著。发芽指数表现为:H 9>H 3>H 6>H 8>H 2>H 7>H 1>H 4>H 5。
2.5.5不同居群黑骨藤种子萌发时滞和萌发历期的差异
由表5可知,H 7的萌发时滞最短(3.67 d),而H 1和H 5的最长(6.33 d);H 6的萌发历期最短(13.67 d),而H 2、H 7萌发历期最长(14.67 d)。
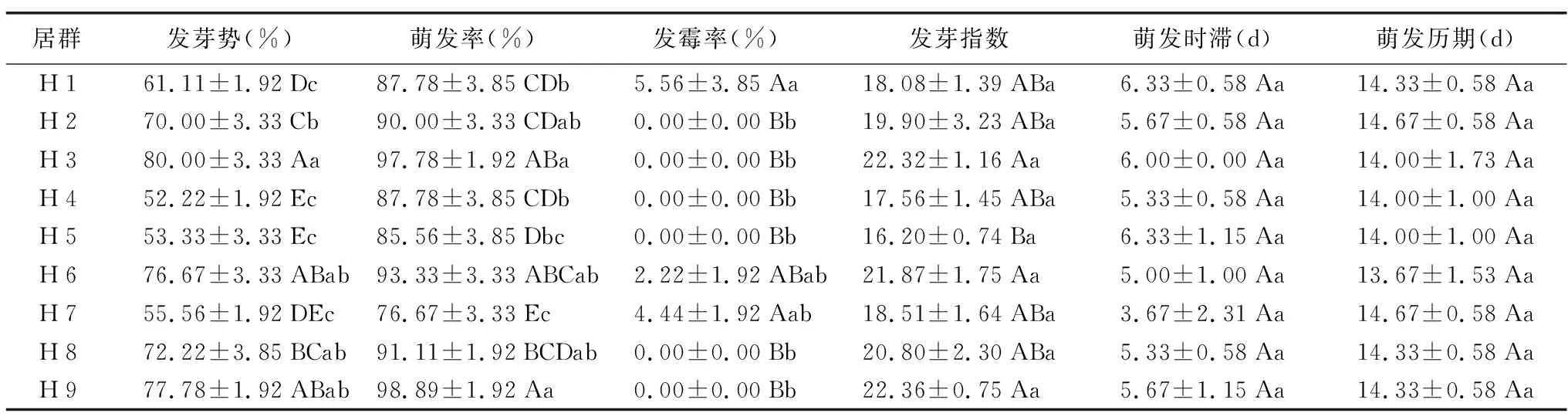
表5 不同居群黑骨藤种子萌发特性的差异Table 5 Seed germination characteristics of P. forrestii among different populations
不同居群黑骨藤种子在萌发过程中,萌发时滞和萌发历期有差异,H 7第1天便开始萌发,H 6第4天萌发,而H 2、H 4、H 5、H 8、H 9均在第5天萌发,H 1与H 3第6天开始萌发,萌发最晚。但不同居群均在第14、15天萌发数不再增加,萌发结束。
2.6 不同居群黑骨藤种子萌发特性相关性分析
由表6可知,种子长径与宽径呈显著负相关,与萌发时滞呈显著正相关;宽径与吸水率呈显著负相关,与发霉率呈显著负相关。
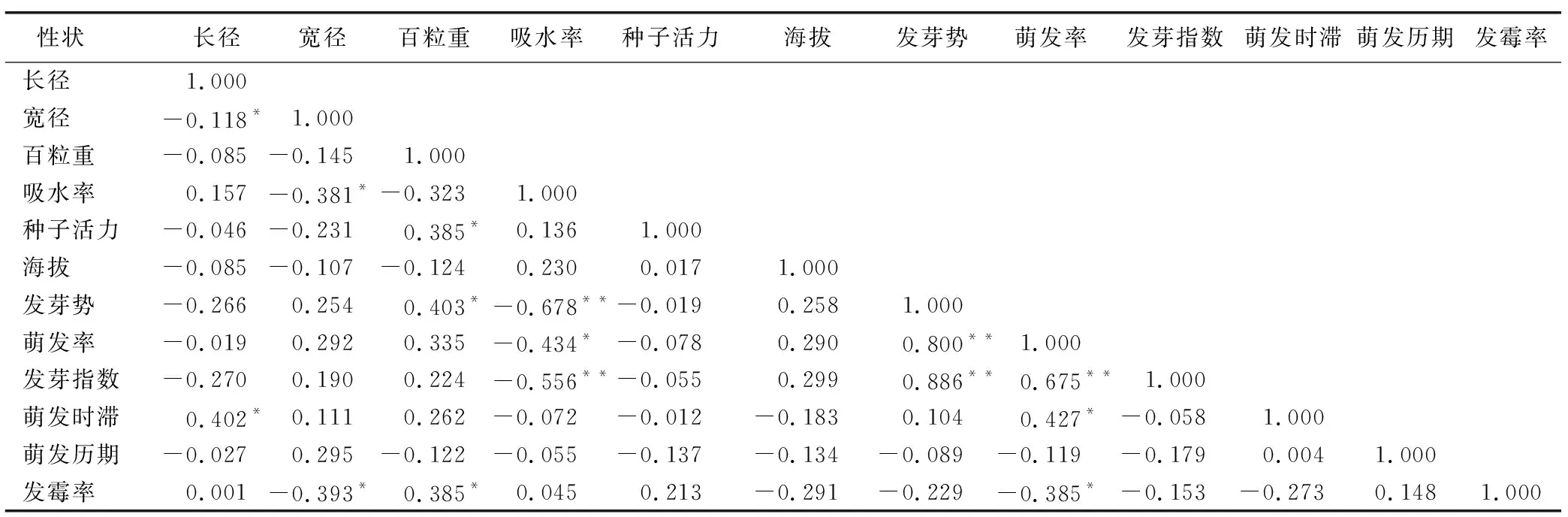
表6 不同居群黑骨藤种子特性相关性分析Table 6 Seed characteristics correlation analysis of P. forrestii among different populations
百粒重与种子活力呈显著正相关,与发芽势也呈显著正相关,与发霉率呈显著正相关,与吸水率、海拔和萌发历期之间呈负相关,与种子活力、萌发率、发芽指数、萌发时滞呈正相关,但关系均不显著。
吸水率与萌发率呈显著负相关,与发芽势、发芽指数均呈极显著负相关,而与种子活力、海拔、发霉率之间呈正相关,与萌发时滞、萌发历期之间呈负相关,且关系均不显著。
发芽势与萌发率、发芽指数之间均呈极显著正相关;萌发率与发芽指数呈极显著正相关,与萌发时滞呈显著正相关,与发霉率呈显著负相关。
3 结论与讨论
3.1 不同居群黑骨藤种子形态特征
黑骨藤种子顶端具白色绢毛,种皮坚硬,表面粗糙具光泽,有深浅不同的沟壑。种子呈不规则纺锤形,具3~4条明显沟壑。种子的长宽略有差异,其中H 3的种子整体最大,其次是H 5,种子最小的是H 4。
种子质量是药材产量和品质的重要前提和基础,而种子大小、百粒重、萌发率等是检测种子质量的重要指标[19]。种子大小对种子的萌发、传播及幼苗成长等均有一定影响。一方面,种子大小是植物生活史的重要特征之一,既受遗传控制,也受环境影响。如随着生境破碎化的加剧,伊犁郁金香的种子体积变小,质量变轻[21]。而另一方面,种子大小对幼苗的存活和生存竞争力也有影响。有学者研究发现,大种子在逆境条件下通过产生较大的幼苗来提高其竞争能力,而小种子形成的幼苗较小,死亡率高[22],但是较小的种子在逃避动物采食等方面具有优势[23]。百粒重是影响种子萌发率的一个重要因素,百粒重越重,说明种子越饱满,也说明种子具有活力,具有萌发潜力。不同居群的种子由于生长环境的不同,其百粒重存在一定差异性。本研究中,种子大小与百粒重关系不显著,H 1的黑骨藤种子虽不是最大,但其百粒重最高,为(2.016 2±0.013 2)g,说明H 1的种子较饱满。本研究中不同居群的黑骨藤种子间百粒重存在一定的差异性,同时,百粒重与海拔高度呈不显著负相关,造成差异的原因可能跟所生长地理环境或遗传变异有关,具体差异机制还需进一步验证。
3.2 不同居群黑骨藤种子吸水率特性
种子萌发是植物生长的开端,种子吸水又是种子萌发的重要条件之一。种子萌发吸水是一个动态的过程,是种子由休眠状态到生活状态的转变过程[20]。种子萌发需要吸收一定的水分,测定吸水率可检测种子吸水是否受种皮的阻碍影响,吸水障碍会对种子的萌发产生一定的影响。在外界条件满足生长需求时,种子能否达到其吸水饱和点对其萌发至关重要,这对幼苗的成功定植和环境适应具有重要的生态学意义[24]。黑骨藤种子种皮虽坚硬,但对种子吸水的阻碍不大,其种子在0~6 h吸水量大而迅速,此过程主要是靠吸胀作用完成,而后吸水量较慢,趋于平缓,吸水达到饱和后,吸水量不再变化。不同居群的黑骨藤种子在吸水饱和后,H 5的黑骨藤种子吸水率最高,为(83.646 4±1.786 4)%,而H 3的吸水率最低,为(56.615 4±0.616 0)%。不同居群黑骨藤种子的吸水率与种子形态没有明显的规律性,造成不同居群吸水率差异的原因可能与种子的生长环境差异有关,具体原因还需进一步验证。
3.3 黑骨藤种子活力测定
活力测定是检测种子质量最直接,也是最快捷的方式。TTC法检测种子生活力是一种能快速判断种子萌发潜力和质量的有效方法[25],目前,已广泛应用于许多药用植物的活力检测中,但不同植物采用的TTC条件会有所不同。本研究采用该法测定黑骨藤种子活力,首先对TTC浓度、染色时间和染色温度进行了单因素考察,建立了黑骨藤种子活力测定最佳的染色条件,即染色浓度1.0%、染色温度25 ℃、染色时间8 h,然后以此条件对不同居群的黑骨藤种子进行活力测定,结果表明,不同居群的种子活力无明显差异,种子均具较高活力。相关性分析结果显示,百粒重与种子活力呈显著正相关。
3.4 不同居群黑骨藤种子萌发特性
除测定种子活力外,还可通过种子萌发来判断种子萌发潜力和种子质量,只是此过程相对于活力测定历时较长,往往需要几天,甚至几个月。本研究黑骨藤种子萌发的结果与活力测定结果一致,通过萌发结果可知,不同居群的黑骨藤种子均具有萌发活力,但不同居群间的萌发率存在显著差异,以H 7居群的萌发率最低(76.67%),H 9的最高(98.89%),这两居群间的萌发率差异最大,其余各居群间均有一定程度的差异性。造成种子萌发率差异的原因很多,生长的地理环境、海拔高度、土壤、光照、温度、湿度(水分)、遮阴程度等,甚至是伴生植物也会对其造成一定的影响。此外,种子百粒重和种子大小也是影响种子萌发率的重要因素。由实验结果可知,种子百粒重与种子活力、发芽势、萌发率均呈正相关,即百粒重越大,种子活力越高,发芽势和萌发率也就越高;种子活力与发芽势、萌发率呈负相关,种子活力高,发芽势和萌发率不一定高,这也与实验结果一致,H 7活力高达98%,但种子萌发率最低(76.67%),且发芽势也不高(55.56%)。本研究中,黑骨藤种子的吸水率与萌发率具显著负相关。石福高、王渭玲[26]对桔梗种子的吸水特性及萌发条件的研究结果表明,适量的水分供应是种子萌发的必要条件,但水分供应过多,会造成桔梗种子发霉,从而降低种子的萌发率。本研究结果与之一致,黑骨藤种子吸水率与发霉率呈正相关,表明水分摄入过多会造成种子霉变;而黑骨藤种子发霉率与萌发率呈显著负相关,表明吸水率通过影响种子的霉变,进而影响黑骨藤种子的萌发率。研究表明,发芽势的高低,可以衡量种子萌发率的高低[27-30]。本研究结果表明,黑骨藤种子的发芽势与萌发率呈极显著正相关,所以在判断种子的萌发潜力时,发芽势也可作为衡量的指标之一。本研究结果表明,黑骨藤种子发芽指数与萌发率极显著正相关,这与朱莹等[31]的研究结果一致,H 9发芽指数最高(22.36),其萌发率最高(98.89%)。
4 总结与展望
在自然状态下萌发的种子,除受温度、光照、水分等的影响,还受土壤盐分、埋藏深度、土壤微生物等环境因子的影响[32]。黑骨藤为多年生木质藤本植物,攀附生长在灌木及小乔木上,其在不同生态环境中均有分布。研究表明,不同居群的黑骨藤种子在种子特性及萌发特性方面均存在一定程度上的差异,其原因可能与种子自身条件、生长环境(海拔、经纬度、土壤、湿度、伴生植物等)、气候条件(阳光、温度、光照、降水量等)有关,综合各项指标分析,黔产黑骨藤以务川县(H 3)和西秀区(H 9)两个居群的黑骨藤种子萌发潜力大、且萌发率高,可作为育苗优质的种源。但关于土壤因子、气候因子等对不同居群黑骨藤种子的影响本研究未涉及,也是今后研究的方向。以期为筛选黑骨藤优质种源及种子育苗的相关研究提供理论和技术参考。

