妊娠合并自发性卵巢过度刺激综合征一例
周多,李亨静,路广美,黄秋芳,张毅
自发性卵巢过度刺激综合征(spontaneous ovarian hyperstimulation syndrome,sOHSS)通常发生在妊娠8~14周[1]。现报告1例海南医学院第一附属医院(我院)收治的双胎自然妊娠、无任何潜在病因及相关危险因素发生sOHSS的病例,并总结sOHSS的病因、诊断和治疗原则,为临床提供一些参考。
1 病例报告
患者 女,28岁,因停经16+6周,无明显诱因出现持续性下腹痛4 h,于2021年2月7日收入我院。患者已婚,孕1产0,平素月经规律,末次月经2020年10月12日,预产期为2021年7月19日。此次妊娠系自然妊娠,为单绒毛膜双羊膜囊双胎妊娠。患者正常产前检查,孕7周在我院产科门诊产检行甲状腺功能检查未见异常;性激素水平检查示:孕激素120.7 nmol/L,雌二醇(estradiol,E2)3 883 pmol/L,人绒毛膜促性腺激素(human chorionic gonadotropin,hCG)79 635.38 U/L;经阴道超声未见异常。反复追问病史,患者妊娠前未使用促排卵药,既往无多囊卵巢综合征、甲状腺功能减退等病史。入院查体:体温36.9℃,脉搏102次/min,呼吸20次/min,血压156/84 mmHg(1 mmHg=0.133 kPa)。全身浅表淋巴结无肿大,心肺未闻及异常,腹膨隆,腹肌紧张,全腹无压痛、反跳痛,未扪及包块,肝脾肋下未及,双下肢轻微浮肿。产科检查示:宫高27 cm,腹围83 cm,胎心音140~145次/min,子宫张力大,偶可扪及不规律宫缩,强度中下,胎膜未破。实验室检查示:纤维蛋白降解产物(fibrin degradation product,FDP)20.2 μg/mL,D-二聚体8.76 mg/L。肝功能检查示:丙氨酸转氨酶43 U/L,白蛋白23.6 g/L。肿瘤标志物检查示:甲胎蛋白(alpha fetoprotein,AFP)143.08 ng/mL,糖类抗原125(carbohydrate antigen 125,CA125)102.5 U/mL。血常规、超敏C反应蛋白、肾功能、尿液分析和凝血四项等未见明显异常。附件彩色超声示:左侧卵巢大小约123 mm×72 mm,右侧卵巢大小约141 mm×92 mm,卵巢内可见多个囊性区回声,双侧卵巢明显增大(见图1);腹腔积液,最深约42 mm。入院初步诊断:①孕1产0,宫内妊娠16+6周;②单绒毛膜双羊膜囊双胎妊娠;③妊娠合并sOHSS;④肝功能受损;⑤腹腔积液;⑥低蛋白血症。入院后监测患者血压,血压波动在149~162/73~98 mmHg。予护肝、疏松子宫平滑肌、补充白蛋白和抗凝等对症治疗。2021年2月10日患者病情加重,血压升高至160/95 mmHg,出现胸闷、气促,患者要求放弃保胎治疗。2021年2月13日03:00胎膜自破,2021年2月14日00:40娩出一无生机儿,男,体质量225 g,羊水清,00:50娩出一无生机儿,男,体质量285 g。产后第3天患者症状好转出院。产后1个月门诊复查,经阴道彩色超声示:左侧卵巢大小约65 mm×39 mm,右侧卵巢大小约67 mm×36 mm,卵巢内可见多个囊性区回声。
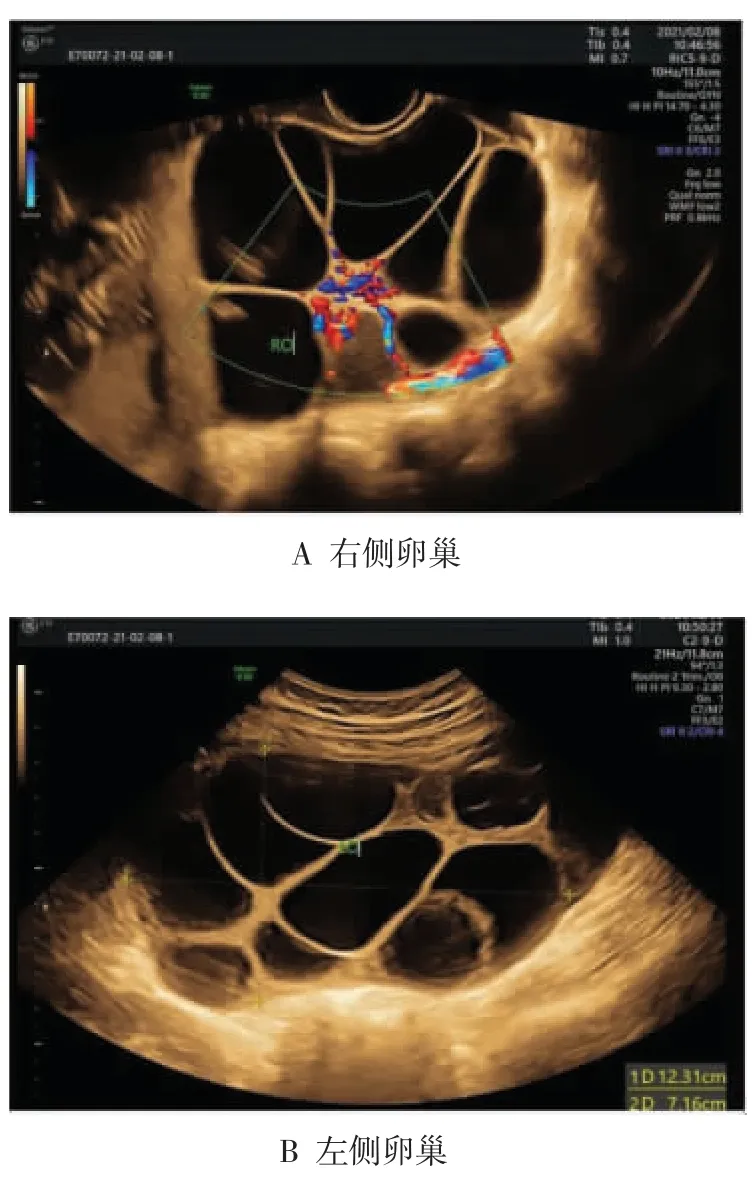
图1 双侧卵巢多发性囊肿彩色超声图
2 讨论
2.1 sOHSS的病因Panagiotopoulou等[2]根据病因将sOHSS分为4型,Ⅰ型为卵泡刺激素(folliclestimulating hormone,FSH)受体突变引起的sOHSS,可导致sOHSS反复发生;Ⅱ型为hCG高分泌型,包括妊娠滋养细胞性疾病及多胎妊娠;Ⅲ型为促甲状腺激素(thyroid-stimulating hormone,TSH)高分泌型,包括原发性甲状腺功能减退症及妊娠合并甲状腺功能减退症;Ⅳ型为促性腺激素高分泌型,包括FSH高分泌型促性腺激素瘤及黄体生成素(luteinizing hormone,LH)高分泌型促性腺激素瘤。hCG、LH、FSH和TSH均是由一个共同的α亚基和一个受体特异性β亚基组成的糖蛋白激素,糖蛋白激素的受体也有相似的结构,是G蛋白耦联受体,包含七个α螺旋组成的跨膜结构域,这些结构域将受体分割为膜外N端(N-terminus)和膜内C端(C-terminus)[3]。
2.1.1 sOHSS与FSH受体突变有关研究表明sOHSS与FSH受体突变有关,FSH受体突变可分为激活型和非激活型,激活型可导致sOHSS的发生,非激活型可通过降低卵巢对性激素的敏感性而导致不孕[4]。目前已经发现8种杂合子激活型FSH受体突变导致sOHSS发生[5-12]。其中6种突变位于FSH受体的α螺旋跨膜结构域,其作用将激活的信号传导到细胞内。这6种FSH受体突变导致配体的结合特异性降低,允许hCG或TSH与突变的受体结合产生交叉反应,从而激活α螺旋跨膜结构域,导致下游信号被激活,引起卵巢过度刺激。还有1种杂合突变位于细胞外FSH受体的氨基末端结构域,导致受体的特异性降低,对hCG高度敏感且能高亲和力地与之结合[9]。最后1种FSH受体突变位于FSH受体细胞质的末端,FSH受体突变导致配体的特异性降低,可被hCG激活[12]。相关文献汇总见表1。
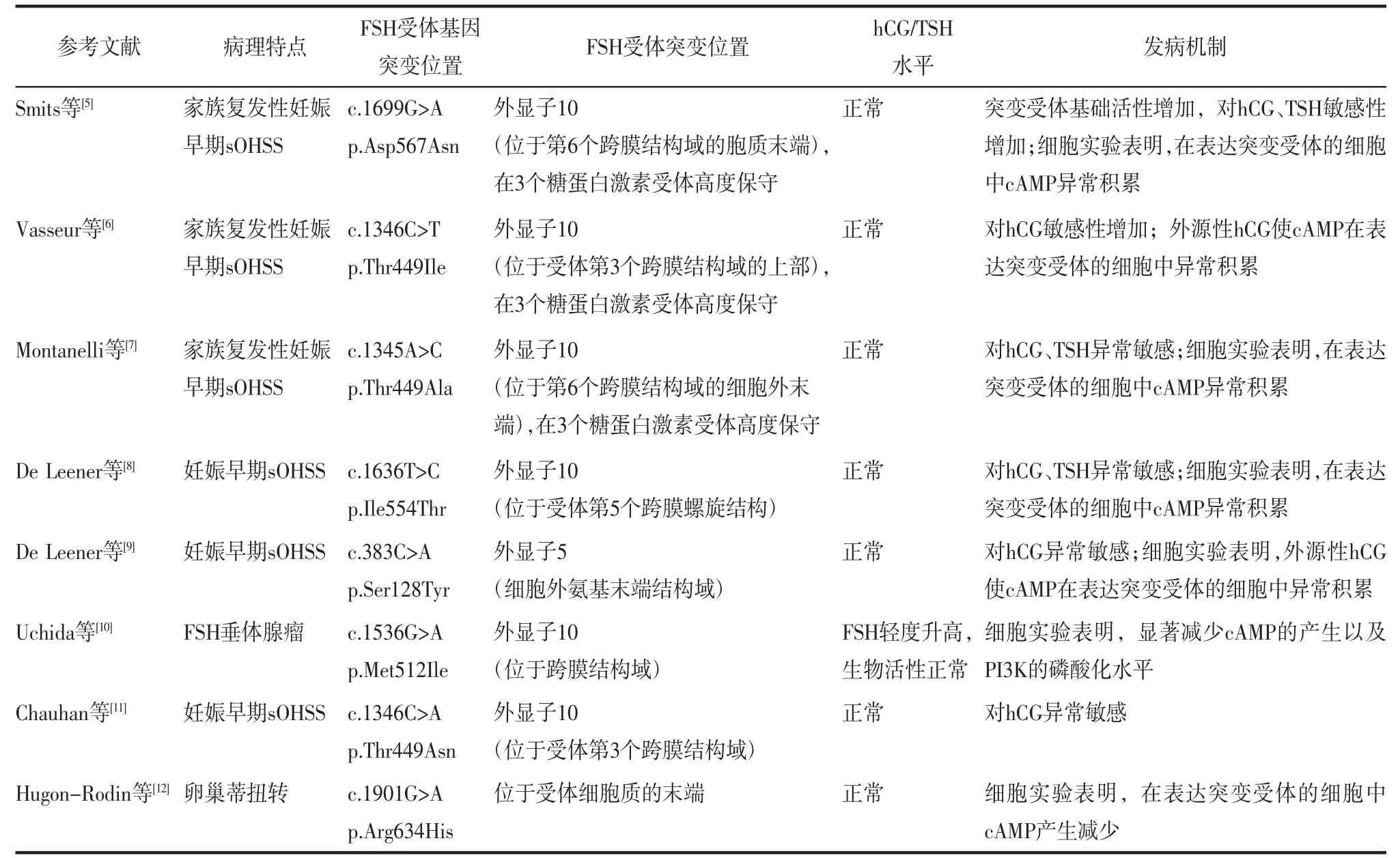
表1 FSH受体突变导致sOHSS的文献汇总
2.1.2 sOHSS与hCG的高分泌有关hCG在sOHSS的发展中起着至关重要的作用。在多胎妊娠[13]或妊娠滋养细胞疾病中(如葡萄胎妊娠[14-15]、侵袭性葡萄胎[16]或绒毛膜癌[17])存在内源性hCG水平升高。细胞实验表明,高浓度的hCG可刺激FSH受体表达,导致sOHSS的发生[18-19]。
2.1.3 sOHSS与TSH的高分泌有关sOHSS与TSH的高分泌有关,导致TSH高分泌的疾病包括原发性甲状腺功能减退症[20-21]和妊娠合并甲状腺功能减退症[22]。动物实验表明,药物引起甲状腺功能减退的小鼠出现卵巢多囊泡状态[23]。围生期暴露于体内和体外促甲状腺激素会持久地放大对促卵泡激素受体结合的反应[24]。在甲状腺功能减退患者中,雌三醇通过16-羟基化途径优先生成,而不是正常的2-羟基化途径,雌三醇对促性腺激素分泌的反馈调节作用不如E2,促性腺激素释放不当可能导致卵巢过度刺激[25]。
2.1.4 sOHSS与促性腺激素的高分泌有关sOHSS与促性腺激素的高分泌有关,其中包括FSH高分泌的垂体腺瘤[26-27]或LH高分泌的垂体腺瘤[28-29]。FSH垂体腺瘤分泌的FSH水平高或在正常范围内,而LH分泌减少,E2或催乳素(prolactin,PRL)的分泌显著增加,高PRL使卵巢更容易受到促性腺激素的作用,在高雌激素的共同作用下使卵巢过度刺激。
2.2 sOHSS的诊断sOHSS的诊断跟OHSS诊断一致,主要根据临床表现、体征、实验室检查及影像学检查。sOHSS的主要症状和体征是腹痛、腹胀、腹水甚至胸腔积液和全身性水肿。实验室检查提示低蛋白血症、血液高凝、电解质紊乱和激素水平的异常。影像学检查提示发病前双侧卵巢无异常,发病时双侧卵巢增大及卵巢呈多囊状态。
2.3 sOHSS的治疗原则Ⅰ型和Ⅱ型sOHSS患者采用系统性对症治疗,包括纠正低蛋白血症、电解质紊乱和低血容量等,还应预防血栓的形成。对于胸腔、腹腔积液导致呼吸困难以及明显腹胀、腹痛的患者,可进行腹腔穿刺和胸腔穿刺引流。若患者症状加重,且卵巢明显增大,或穿刺引流治疗无效,可进行卵巢囊肿的抽吸治疗。若对症治疗后,症状仍不能缓解,应及时终止妊娠。Ⅲ型sOHSS患者在系统性对症治疗的同时,可行甲状腺激素替代治疗。研究表明,适当补充甲状腺激素可使卵巢囊肿明显减小[30]。经蝶窦肿瘤切除术是Ⅳ型sOHSS患者的首选手术方法,术后可观察到卵巢囊肿消退,激素水平恢复正常[31]。Ⅳ型患者药物治疗通常无效[32]。
综上,本病例患者无诱因妊娠中期出现腹水、高血压、肝功能损伤、低蛋白血症、肿瘤标志物异常和血液高凝状态等,符合双胎妊娠合并sOHSS的诊断。但本例sOHSS患者的病因尚不明确,入院时未检测该孕妇的激素水平(如TSH、hCG、E2、孕激素、FSH、LH),也未检测FSH受体基因。今后临床上遇到OHSS患者,应详细询问此次妊娠情况、是否使用过促排卵药物等现病史,甲状腺功能减退病史、多囊卵巢综合征病史和既往出现相同疾病等病史以及家族史,还需进行激素水平等实验室检查。对于激素水平正常者,需行FSH受体基因检测;对于高泌乳素或高雌激素患者,需行磁共振成像检查有无垂体腺瘤可能;对于TSH升高患者,需评估甲状腺功能情况。

