卵巢Sertoli-Leydig细胞瘤13例临床诊治分析
许阡,成九梅
卵巢Sertoli-Leydig细胞瘤(Sertoli-Leydig cell tumor,SLCT)是卵巢性索间质肿瘤的一种亚型,十分罕见,其发生率占所有卵巢肿瘤的0.2%~0.5%[1]。卵巢SLCT好发于20~30岁的年轻女性,临床表现差异较大,三分之一的患者可表现为男性化的症状,如多毛、声音变粗、月经稀发甚至闭经、阴蒂肥大等[2-3]。因缺乏特异性表现,卵巢SLCT术前误诊率和漏诊率较高,确诊主要依靠术中探查、术后病理及免疫组织化学结果。手术是卵巢SLCT的主要治疗方法,部分患者术后需辅助化疗且需长期密切随访。总结首都医科大学附属北京妇产医院(我院)收治的13例经手术、病理确诊的卵巢SLCT患者的病历资料,并复习相关文献,以期为临床诊疗提供参考。
1 对象与方法
1.1 研究对象回顾性分析2014年6月—2021年7月我院收治的13例卵巢SLCT患者的临床资料,所有患者的病历资料完整,术后于我院定期随访。
1.2 研究方法收集13例患者的年龄、临床表现、内分泌水平、影像学检查、手术情况、术后石蜡病理、免疫组织化学结果及预后,对这些资料进行回顾性分析。
1.3 统计学方法由于病例数较少,主要为描述性分析。正态分布的定量资料用均数±标准差(x±s)表示,非正态分布的定量资料用中位数和四分位数[M(P25,P75)]表示,定性资料用例(%)表示。
2 结果
2.1 一般情况13例卵巢SLCT患者年龄13~72岁,中位年龄31.0(26.5,46.5)岁,10例(76.9%)患者≤40岁,3例(23.1%)患者已绝经,年龄分别为56岁、58岁和72岁。
2.2 临床表现及实验室检查13例患者中,8例(61.5%)表现为雄激素过多症状:月经周期延长、月经量减少,甚至继发闭经,血清睾酮水平均升高,最高可达30.41 nmol/L,其中1例患者出现面部痤疮、腹部体毛加重和声者变粗的表现;3例(23.1%)患者表现为异常子宫出血,其中2例患者表现为绝经后阴道出血;另2例(15.4%)患者无明显临床症状。13例患者均行肿瘤标志物检查,所有患者癌胚抗原(carcinoembryonic antigen,CEA)及 糖 类 抗 原125(carbohydrate antigen 125,CA125)均正常,仅2例患者CA19-9轻度升高(分别为32.23 kU/L、32.83 kU/L)。
2.3 影像学表现所有患者术前均行盆腔超声检查,8例(61.5%)为附件区囊实性肿物,其中4例为多房性改变;5例(38.5%)为附件区实性肿物,边界清,内部及周边可见血流信号。8例患者术前行盆腔磁共振成像(magnetic resonance imaging,MRI)增强检查,5例MRI表现为附件区囊实性肿物(3例考虑卵巢性索间质肿瘤可能性大),其中4例实性成分为主,呈等T1、稍长T2信号,增强后实性成分轻度至显著强化,弥散加权成像(diffusion weighted imaging,DWI)呈高信号,病变与卵巢血管关系密切;另1例囊实性肿物,囊性成分为主,多房,内见多发厚薄不规则分隔,较明显强化(见图1);另3例MRI表现为附件区实性肿物,形态较规则,增强后不均匀强化。4例患者术前行盆腔CT增强检查,表现为附件区实性或囊实性肿物,边界清,增强扫描后实性部分呈明显强化。
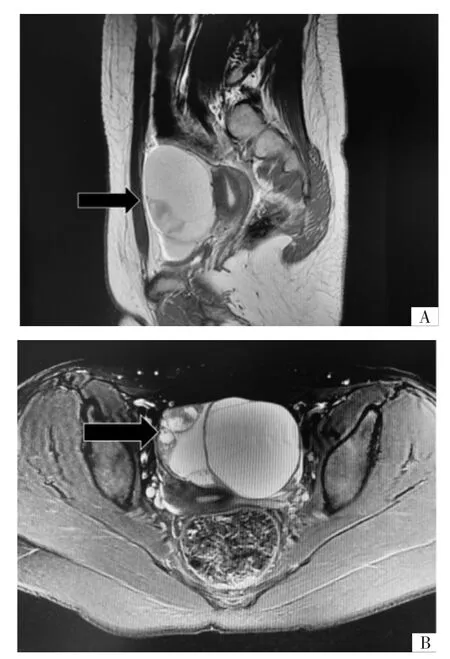
图1 卵巢SLCT盆腔MRI图
2.4 术中探查及手术方式13例患者均行开腹或腹腔镜探查术,术中探查均为单侧卵巢肿瘤,肿瘤直径3~15 cm,表面光滑,其中囊实性肿物8例,实性肿物5例。10例绝经前患者中8例行患侧卵巢肿瘤切除术,2例行患侧附件切除术;3例绝经后患者中2例行腹腔镜全子宫及双侧附件切除术,1例因合并症不能耐受手术,仅行腹腔镜患侧附件切除术。
2.5 病理学特征术中肉眼见肿物表面光滑、包膜完整,实性成分剖面为黄色或暗红色组织,部分质地糟脆,呈鱼肉样或胶冻样,囊性成分为透明黏液或黄色清亮液体(见图2)。所有13例患者均经石蜡及免疫组织化学确诊为卵巢SLCT,根据2014年国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)卵巢癌分期,11例患者为ⅠA期,2例患者为ⅠC期。其中高分化1例,高-中分化3例,中分化4例,中-低分化5例(其中1例伴有异源成分,为黏液上皮)。2例绝经后患者全子宫切除后病理均提示子宫内膜不规则增生。免疫组织化学结果,13例患者的抑制素α(inhibin-α)和钙视网膜蛋白(calretinin)表达均为阳性,12例患者CD99及细胞角蛋白(cytokeratin,CK)表达阳性,9例患者波形蛋白(vimentin)表达阳性,6例患者黑色素A(Melan-A)表达阳性,11例患者上皮膜抗原(epithelial membrane antigen,EMA)均为阴性。3例患者于外院行DICER1基因检测,其中2例检出DICER1基因突变。
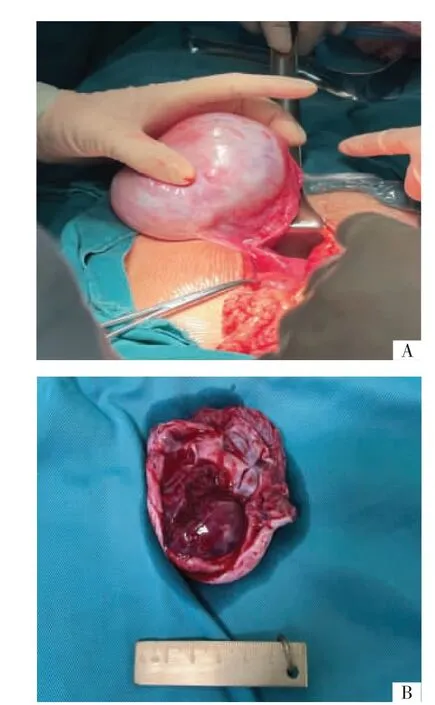
图2 卵巢SLCT术中所见及剖面肉眼观
2.6 后续治疗本研究中5例中-低分化卵巢SLCT患者(3例ⅠA期,2例ⅠC期),其中4例患者分别行患侧附件切除及盆腹腔多点活检的二次手术治疗,与前次手术间隔1~2个月,1例ⅠA期患者因13岁,患者家属坚决要求保留患侧卵巢,拒绝补充手术。其中2例ⅠC期患者术后行博来霉素+依托泊苷+顺铂(BEP)方案化疗,3或4个疗程。1例ⅠA期患者病理提示异源成分(黏液上皮),因合并症较多未予化疗。
2.7 随访及预后13例患者随访5~78个月,中位随访时间33(9,42)个月。随访内容包括妇科检查、内分泌检查、盆腔超声、盆腔CT或盆腔MRI检查。13例患者随访至今均未复发,无瘤生存。
3 讨论
3.1 卵巢SLCT的发病机制目前卵巢SLCT的发病机制尚不明确,其发生可能与DICER1基因突变有关。研究表明,60%的卵巢SLCT患者可检测到DICER1基因突变[4]。绝大多数发现DICER1基因突变的患者为中、低分化,高分化卵巢SLCT的发病机制可能有别于中、低分化的卵巢SLCT,需要进一步大规模研究[5]。DICER1综合征是由DICER1基因突变导致的罕见的家族性肿瘤易感综合征,常见的DICER1综合征相关肿瘤除卵巢SLCT外,主要包括胸膜肺母细胞瘤、多发性结节性甲状腺肿、甲状腺癌、囊性肾瘤和横纹肌肉瘤等[6]。研究表明,DICER1基因突变的患者平均年龄更低,且更易表现为雄激素过多的症状[7]。本研究2例患者检出DICER1基因突变,分别为13岁和31岁,均出现雄激素过多症状,且术后病理均提示中-低分化,与文献描述相符[5,7]。因此,对于基因筛查检测到DICER1基因突变的卵巢SLCT患者,需警惕DICER1综合征的可能,同时行多学科会诊,以期更早发现其他DICER1基因相关的肿瘤及家庭成员的发病,尽早干预,提高患者的生存质量及生存时间。
3.2 卵巢SLCT的临床特点卵巢SLCT可发生于任何年龄,但好发于20~30岁的女性,不到10%的患者可发生在初潮前或绝经后[8]。绝大多数(>95%)卵巢SLCT病灶是单侧的,且仅局限于卵巢,在诊断时几乎90%的患者处于FIGO分期Ⅰ期[2-3]。
卵巢SLCT患者约三分之一会出现雄激素过多的临床症状[9]。早期表现为去女性化症状,如月经减少、闭经和乳房萎缩等,继续发展可表现为男性化,如多毛症、痤疮、声音变粗、前额头发稀疏、喉结增大和阴蒂肥大等[5]。少数患者仅表现为雌激素过多的临床症状,如月经过多、阴道出血、月经紊乱或绝经后阴道出血。子宫内膜诊刮病理通常提示子宫内膜增生、不典型增生,甚至子宫内膜癌[9-10]。约50%的患者临床症状可表现腹部包块相关症状,如腹痛、腹胀及下腹部包块等[11]。对于DICER1基因突变的患者,更需警惕DICER1综合征相关易感肿瘤的临床表现,如甲状腺肿大、甲状腺功能亢进、肺囊肿、呼吸困难、气胸、血尿、腰痛和腹部包块等[12]。本研究13例患者中8例表现为雄激素过多的表现,其中1例患者进一步发展为男性化表现;3例患者为异常子宫出血,其中2例患者表现为绝经后阴道出血,子宫病理提示子宫内膜不规则增生,与文献相符。对于盆腔肿物的患者,若出现月经减少、闭经、多毛症、痤疮和声音变粗等症状,尤其是20~30岁的年轻女性,应及时考虑卵巢SLCT的可能性,以期术前制定更为合理的治疗方案,提高诊疗水平。对于检测出DICER1基因突变的卵巢SLCT患者,需警惕其他系统症状的发生。
3.3 卵巢SLCT的诊断血清睾酮是卵巢SLCT重要的标志物,可辅助卵巢SLCT的诊断。影像学检查亦可作为卵巢SLCT的术前辅助诊断,多表现为囊实性或实性肿物[13]。本研究13例患者中,8例(61.5%)患者血清睾酮水平升高,最高可达30.41 nmol/L。影像学检查表现均为囊实性或实性肿物,因此术前应结合肿瘤标志物及影像学检查,充分考虑此疾病可能性并制定最优化诊疗方案。
诊断卵巢SLCT的金标准主要为组织病理学和免疫组织化学检测。在肉眼观上,卵巢SLCT多表现为实性、表面光滑的肿物,切面多呈黄色,也可呈暗红色或褐色,质地柔软、肉样感。肿瘤较大时,常具有多房囊性成分,内含透明的液体[10,14]。根据组织学形态的不同,世界卫生组织(2020)女性生殖系统肿瘤分类将卵巢SLCT分为高分化、中分化、低分化和网状型[15]。在后3种类型中,20%的肿瘤中可出现异源成分,最常见的是胃肠型黏液上皮[4,16]。在免疫组织化学中,通常将inhibin-α和calretinin联合用于卵巢SLCT的诊断,inhibin-α特异度高,calretinin敏感度高[8,10]。此外,vimentin、CK、CD99和Melan-A多表现为阳性,EMA是卵巢SLCT特异性阴性标志物[10,17]。本研究13例患者均经组织病理学及免疫组织化学证实为卵巢SLCT。这些患者均建议行DICER1基因突变的筛查,首先行基因序列分析,检测是否有DICER1基因杂合突变或可疑DICER1基因功能丧失,如未发现致病性突变,再行缺失或重复序列分析,除外DICER1综合征[12]。但仅3例患者进行了DICER1基因检测,2例检出DICER1基因突变,需充分提高对此疾病的认知,增加相应基因检测及后续管理能力。
3.4 卵巢SLCT的治疗由于卵巢SLCT的罕见性,目前尚无标准化的治疗方案,治疗取决于患者的年龄、生育要求、肿瘤分期及分化程度[1]。
3.4.1 手术治疗手术是卵巢SLCT的主要治疗方法,手术范围取决于肿瘤的分期、分化程度以及生育要求[18]。FIGO分期为Ⅰ期、无生育要求的患者,建议行全子宫及双侧附件切除术,有生育要求的年轻患者可行保留生育能力(单侧附件切除)手术[19]。对于分化良好的ⅠA期患者,可仅行肿瘤切除的保守性手术[20]。绝经后或晚期的患者,应行全子宫及双侧附件切除术,术中探查并应行盆腹腔多点活检明确分期[16]。鉴于卵巢SLCT很少发生淋巴结转移,因此术中盆腔淋巴结及腹主动脉旁淋巴结取样或切除不是必须的[10]。本研究13例患者均为FIGO分期Ⅰ期患者,手术原则与文献描述相符。
3.4.2 化疗卵巢SLCT术后辅助化疗的作用尚有争议。低危FIGO分期Ⅰ期患者建议观察,高危FIGO分期Ⅰ期患者(如分化差、有丝分裂指数高、含有异源成分、肿瘤破裂、FIGO分期ⅠC期)以及FIGO分期Ⅱ~Ⅳ期的患者推荐以铂类为基础的辅助化疗[8,19]。有文献表明,含有异源成分虽然是预后不良的因素之一,但是胃肠型黏液上皮对不良预后的影响较小[9]。化疗周期取决于肿瘤的分期,ⅠC期患者建议化疗3~4个疗程,Ⅱ~Ⅳ期患者推荐4个疗程,转移性肿瘤可升级至6个疗程[21]。最常用的化疗方案是BEP方案,替代方案包括紫杉醇+顺铂(TP)方案、长春新碱+放线菌素+环磷酰胺(VAC)方案和异环磷酰胺+依托泊苷+顺铂(VIP)方案等[9]。本研究患者总体化疗方案与文献相符。
3.5 卵巢SLCT的预后及随访据文献报道,卵巢SLCT的预后与肿瘤的分期有关,ⅠA期的复发率仅为7%,ⅠC期的复发率可高达30%,Ⅱ~Ⅳ期预后较差,复发率为73.7%[16]。与其他卵巢性索间质肿瘤相比,卵巢SLCT复发一般较早,95%的患者在术后5年内复发[22]。因此,卵巢SLCT患者需密切随访,建议术后第1年每3个月随访1次,第2年每4个月随访1次,第3年每6个月随访1次,此后每年随访1次,随访包括妇科检查、内分泌检查、盆腔超声、盆腔CT或MRI检查[8]。对于DICER1突变患者,需多学科联合随访,每年对患者进行多系统的评估和体格检查,包括呼吸系统、消化系统、泌尿系统、运动系统、中枢神经系统和内分泌系统等[12]。本研究13例患者随访5~78个月,考虑11例为ⅠA期患者预后较好,2例为ⅠC期患者,术后BEP方案标准化疗,预后较好,因随访时间较短,尚未见复发。此后将继续严密随访,及时发现复发、及时治疗。
3.6 卵巢SLCT复发患者的治疗目前尚无复发患者治疗的最佳方案,手术治疗是复发患者治疗的基础,需尽早行肿瘤细胞减灭术[23]。术后建议行3个疗程的BEP方案化疗或6个疗程的紫杉醇联合卡铂方案化疗[22]。此外,贝伐珠单抗可能作为一种有前景的药物治疗复发性卵巢SLCT,已有研究表明其在复发性卵巢性索间质肿瘤的治疗中具有一定效果[1],但仍需长期大样本临床研究。
综上,卵巢SLCT是一种罕见的卵巢性索间质肿瘤,好发于20~30岁的年轻女性。其发病机制目前尚不明确,可能与DICER1基因突变有关。治疗以手术为主,术中和术后病理可明确SLCT诊断,酌情可联合化疗,建议术后多学科联合随访。治疗方案亦需更多大样本的研究,以期制定最优的标准化治疗方案,提高患者的预后。

