高危型人乳头瘤病毒阴性宫颈癌的研究进展
李玉兰,刘晓,韩逢皎,岳玲,许飞雪
宫颈癌(cervical cancer)是女性生殖系统中最常见的恶性肿瘤之一,2020年全球癌症统计数据显示,宫颈癌的发病率和死亡率位于女性恶性肿瘤的第4位,在发展中国家,宫颈癌的发病率和死亡率仍位于女性恶性肿瘤的第2位[1]。据统计数据显示,2018年全球确诊宫颈癌约569 000例,死亡约311 000例,约85%的死亡病例发生于发展中国家[2]。目前公认的导致宫颈癌的确切病因是一种或多种高危型人乳头瘤病毒(high-risk human papillomavirus,HR-HPV)的持续感染。理论上,所有宫颈癌患者均合并HR-HPV感染,但几乎在所有的HPV检测方法中,均有部分检测结果呈阴性[3]。国内外将宫颈癌中HPV检测结果为阴性者称为HPV阴性宫颈癌或HR-HPV阴性宫颈癌,发病机制不明,预后相对较差[4]。现从发病原因、临床特征、分子生物学等方面综述近年关于HR-HPV阴性宫颈癌的研究进展,以期为该病的发病机制研究、诊断及治疗提供新的思路。
1 HR-HPV阴性宫颈癌的发病原因
尽管学者们认为HR-HPV感染是导致宫颈癌的必要条件,但有相当一部分宫颈癌患者HR-HPV的检测结果为阴性,且其阴性率因地域、组织学类型、年龄和标本储存时间而异[4]。HR-HPV阴性结果可归因于多种原因,其中大多数为假阴性。但不管检测范围及检测方法如何变化,均有HR-HPV阴性宫颈癌存在,所以从理论上来说,HR-HPV阴性宫颈癌是存在的。
1.1 HPV已被免疫机制清除,但细胞异型性已经形成尽管50%以上的女性一生中均会感染HPV,但约90%的感染者可通过自身免疫在数月至两年内将其清除,只有约15%的HR-HPV持续存在。HPV主要感染宫颈鳞状上皮内的基底角质形成细胞,因其有多种病原体识别受体,能够识别入侵的病原体并提醒区域免疫细胞,故又称为“免疫哨兵”[5],即使在健康状态下,基底角质形成细胞也会分泌一系列细胞因子来维持免疫监视。而HPV则通过干扰基底角质形成细胞中的多种信号通路来逃避这种监视[6]。在HPV感染早期,病毒在基底角质形成细胞中的表达较低,从而使病毒复制的风险降至最低;在疾病发展过程中,病毒基因组整合,HPV中E6和E7癌蛋白表达增加,从而干扰角质形成细胞的免疫报警功能和抗原呈递机制[7]。此外,抑制性免疫细胞通过产生多种抑制因子而发挥作用,限制效应T淋巴细胞的增殖和自然杀伤细胞的功能,并以直接或间接方式诱导调节性T细胞的募集和扩增[8]。所有这些策略均为免疫逃逸创造了有利的环境。
1.2 由HR-HPV以外的其他原因引起的宫颈病变虽然长期持续性HR-HPV感染是引发宫颈癌的主要原因,但并非唯一原因。宫颈癌的高危因素还有低危型HPV持续感染、早婚、早育、多孕、多产、吸烟、性传播疾病、长期服用口服避孕药、糖尿病、体质量指数较高或较低、教育程度较低、营养不良、卫生条件较差和防癌普查意识不够健全等[9]。口服避孕药包括雌激素和孕激素,研究表明,甲羟孕酮可以阻止宫颈上皮内瘤变发展为浸润性宫颈癌,而雌激素则可与致癌基因共同作用促进宫颈癌的发生发展[10]。
1.3 其他部位的恶性肿瘤转移至宫颈若宫颈以外的其他生殖系统恶性肿瘤及生殖系统以外的恶性肿瘤转移至宫颈,且HPV检测结果为阴性,则可能会误诊为HR-HPV阴性宫颈癌[11]。如Ⅱ期及以上的子宫内膜癌,宫颈受累且伴有鳞状分化的子宫内膜样癌可能被误诊为宫颈腺鳞癌;高级别浆液性输卵管癌或小细胞肺癌转移至宫颈,则有可能会被误诊为HPV阴性宫颈癌。
2 HR-HPV阴性宫颈癌的临床特征
2.1 发病年龄及临床症状研究表明,HR-HPV阴性宫颈癌在全球范围内约占宫颈癌的1%左右[12]。与HR-HPV阳性宫颈癌相比,HR-HPV阴性宫颈癌患者发病年龄较大,多集中在41~55岁,且大多数患者以腹痛和不规则阴道出血为首发症状[13]。
2.2 患病率及组织类型HR-HPV阴性宫颈癌患病率在不同组织学类型中有所不同[14],其中宫颈鳞癌几乎均为HR-HPV阳性,HR-HPV阴性较少见;腺鳞癌的HR-HPV阴性率不足15%;腺癌的HR-HPV阴性率因病理学类型而异,国际宫颈腺癌分类标准(International Endocervical Adenocarcinoma Criteria and Classification,IECC)将腺癌分为HPV相关腺癌(human papillomavirus-associated adenocarcinoma,HPVA)和伴或不伴HPVA特征的非HPV相关腺癌(nonhuman papillomavirus-associated adenocarcinoma,NHPVA)[15]。HPVA包括普通型、黏液型(非特殊型、肠型、印戒细胞型、浸润性复层产黏液的癌)和腺癌(非特殊型)。NHPVA包括胃型、中肾管型、子宫内膜样型、透明细胞型和腺癌(非特殊型)。不同类型腺癌在NHPVA中的比例及HPV阴性率均不同(见表1),其中HPV阴性率高的亚型有胃型、中肾管型和子宫内膜样型。
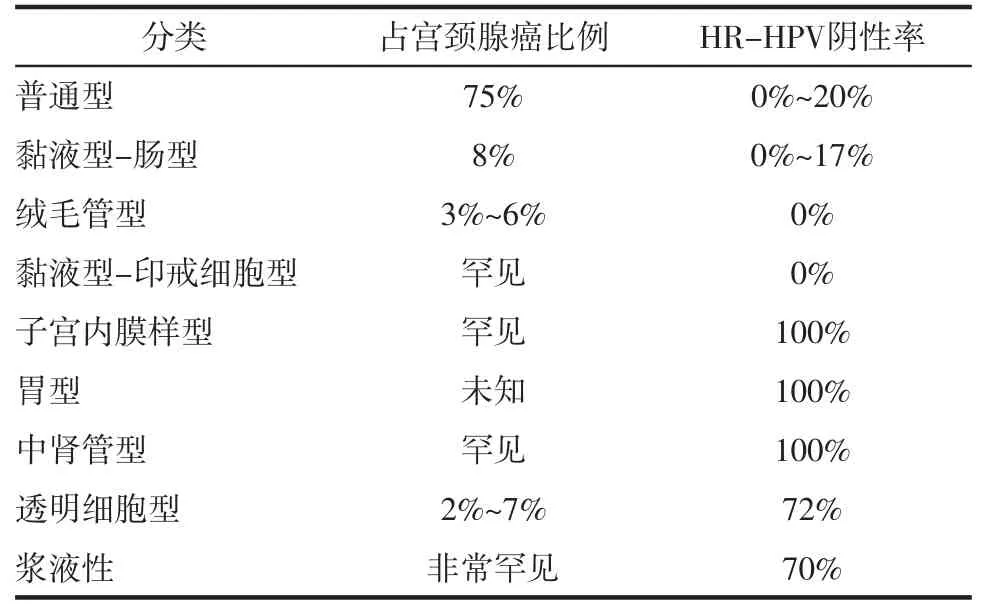
表1 不同类型腺癌的比例及HR-HPV阴性率
2.3 发病机制目前认为NHPVA的发病与HPV无关,而与基因突变相关[16]。TP53基因的改变使肿瘤抑制因子p53丧失抑癌功能是癌症中的常见事件,且p53突变与肿瘤预后不佳有关[17]。Nicolás等[13]发现HR-HPV阴性宫颈癌中72%的患者发生了p53突变,且预后均较差,推测p53突变促进NHPVA的生长、侵袭及转移。50%的透明细胞型腺癌中磷酸化蛋白激酶B(p-protein kinase B,p-AKT)和磷酸化哺乳动物雷帕霉素靶蛋白(p-mammalian target of rapamycin,p-mTOR)免疫组织化学染色均为阳性,推测磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)/AKT通路可能参与了透明细胞型腺癌的发生;在透明细胞型腺癌老年患者中,多达50%的病例PTEN表达缺失,50%的病例表皮生长因子受体2表达升高[18-19]。胃型腺癌与家族性黏膜皮肤色素沉着胃肠道息肉病(Peutz-Jeghers综合征)、STK11突变和TP53突变有关[20]。在中肾管型腺癌中,80%的患者为KRAS或NRAS突变,62%的患者为ARID1A、ARID1B或SMARCA4突变[18-19]。
2.4 预后通过对比HR-HPV阳性和阴性宫颈癌病灶大小、分期、治疗效果等发现,HR-HPV阴性宫颈癌肿瘤病灶较大,国际妇产科联盟(International Federation of Gynecology and Obstetrics,FIGO)分期较晚,对放疗及化疗的敏感性较低,更容易出现复发和淋巴结转移,无病生存期及总生存期较短,预后较差[4]。
3 HR-HPV阴性宫颈癌的分子生物学研究进展
3.1 与HR-HPV阴性宫颈癌相关的长链非编码RNA(long noncoding RNA,lncRNA)
3.1.1 表达下调的lncRNA随着基因组高通量测序技术的不断发展,lncRNA从最初被认为是基因组的“附属物”到如今被证实有独特的生物学特性,已成为分子生物学的研究热点。Zheng等[21]研究发现lncRNA snaR在HR-HPV阴性宫颈鳞癌中表达下调,通过上调转化生长因子β1(transforming growth factor-β1,TGF-β1)的表达,促进肿瘤细胞增殖、侵袭和转移,lncRNA snaR在远处复发和转移患者中的表达进一步下调。Ju等[22]发现lncRNA NEF在HR-HPV阴性宫颈癌中表达明显下调,其通过上调TGF-β1的表达,促进肿瘤细胞增殖、侵袭和转移;进一步分析发现,lncRNA NEF表达下调对HR-HPV阴性宫颈癌具有诊断价值、对伴有远处转移的HR-HPV阴性宫颈癌的预后具有预测价值。Liu等[23]发现lncRNA SRA1在HR-HPV阴性宫颈癌中表达下调,并与上调的微小RNA9(microRNA-9,miR-9)共同促进p53上调,进而促进肿瘤细胞增殖、侵袭和转移。上述研究表明lncRNA snaR/TGF-β1、lncRNA NEF/TGF-β1及lncRNA SRA1/miR-9/p53通路可能是HR-HPV阴性宫颈癌发病的新机制。
3.1.2 表达上调的lncRNA研究表明,lncRNA LINC01305在HR-HPV阴性宫颈鳞癌中表达上调,通过介导PI3K/AKT信号通路促进癌细胞增殖、侵袭、转移及上皮-间质转化[24]。Huang等[25]发现LINC01305在HR-HPV阴性宫颈癌中通过与RNA结合蛋白KHSRP相互作用而促进肿瘤细胞增殖、侵袭和转移,同时抑制细胞凋亡,其与HR-HPV阴性宫颈癌生存率较低密切相关。提示LINC01305在HR-HPV阴性宫颈癌的诊断和预后方面具有重要应用价值。
3.2 与HR-HPV阴性宫颈癌相关的基因
3.2.1 黑色素瘤特异性抗原(preferentially expressed antigen in melanoma,PRAME)研究表明,PRAME在宫颈癌中通过诱导胱天蛋白酶(caspase)非依赖性细胞死亡,使肿瘤细胞出现细胞质空泡化,随后解体为凋亡小体[26]。Liu等[27]发现,PRAME在HR-HPV阴性宫颈癌中呈特异性过表达,且经PRAME转染的HR-HPV阴性C33A细胞系出现细胞质空泡化和气泡现象,进而促进细胞凋亡,抑制细胞增殖、侵袭和转移。
3.2.2 高迁移率族蛋白A2(high mobility group A2,HMGA2)Wang等[28]发现HMGA2在宫颈鳞癌和腺癌中过表达与FIGO分期较晚、淋巴结转移、预后不良及总生存率较低有关。研究发现HMGA2在HRHPV阴性宫颈癌中过表达可触发TGF-β和Wnt/β-连环蛋白(β-catenin)信号通路、激活ATR/Chk1信号通路,从而促进肿瘤细胞增殖、侵袭及转移,并抑制细胞凋亡[29]。
3.2.3 E26转录因子变异体4(E26 transformationspecific variant 4,ETV4)ETV4是多瘤病毒增强子激活因子3(polyomavirus enhancer activator 3,PEA3)的亚家族成员之一,在HR-HPV阴性宫颈癌中过表达可促进肿瘤细胞增殖、侵袭、转移和耐药,其在晚期及转移性宫颈癌中反复被激活,且与预后不良和侵袭性更强的肿瘤表型密切相关[17]。
3.2.4 7次跨膜超蛋白家族成员2(transmembrane 7 superfamily member 2,TM7SF2)研究发现,TM7SF2在HR-HPV阴性宫颈癌中过表达,敲除TM7SF2基因后HR-HPV阴性宫颈癌的细胞活力和集落形成能力均受到强烈抑制,迁移细胞数量减少,G0/G1期延长,S期缩短,凋亡标志物Cleaved caspase-3和BimEL上调,细胞凋亡抑制因子B细胞淋巴瘤2(B cell lymphoma-2,Bcl-2)下调,进一步研究发现TM7SF2通过激活C-Raf/细胞外信号调节激酶(extracellular signal-regulated kinase,ERK)信号通路促进HRHPV阴性宫颈癌细胞增殖、迁移和侵袭,并抑制细胞凋亡[30-31]。
3.3 与HR-HPV阴性宫颈癌相关的细胞周期蛋白依 赖 性 激 酶4/6(cyclin dependent kinase 4/6,CDK4/6)抑制剂CDK4/6与细胞周期蛋白D(cyclin D)共同催化视网膜母细胞瘤基因(Rb)磷酸化,使细胞由G1期进入S期。CDK4/6-clyclin D轴在包括HRHPV阴性宫颈癌在内的多种恶性肿瘤中均失衡,导致CDK4/6活性增强,使细胞不可逆地进入S期。目前已通过美国食品药品监督管理局认证的CDK4/6抑制剂包括瑞博西尼(Ribociclib)、玻玛西尼(Abemaciclib)和帕博西尼(Palbociclib)等。Xiong等[32]发现瑞博西尼通过靶向HR-HPV阴性宫颈癌中的Rb-E2F途径抑制肿瘤细胞增殖、侵袭、转移及异种移植模型肿瘤的生长,促进凋亡,且无明显不良反应,但瑞博西尼对HR-HPV阳性宫颈癌在体内及体外均无抗肿瘤作用。Liu等[33]发现,玻玛西尼通过抑制HR-HPV阴性宫颈癌中的CDK4/6-Rb-E2F和mTOR通路,抑制肿瘤细胞增殖、侵袭及转移,并促进细胞凋亡;与其联用时的抗肿瘤效果较单独使用紫杉醇和顺铂时明显加强,且无明显不良反应。Fujiwara等[34]观察玻玛西尼对包括晚期宫颈癌在内的12例晚期和(或)转移性癌症患者的疗效发现,200 mg(每12 h一次)的玻玛西尼表现出较强的抗肿瘤活性。提示CDK4/6抑制剂有可能成为治疗HR-HPV阴性宫颈癌的新型药物。
4 结语与展望
PRAME、HMGA2、ETV4和TM7SF2基因可能成为HR-HPV阴性宫颈癌新型标志物,CDK4/6抑制剂有可能为HR-HPV阴性宫颈癌患者的治疗带来福音,但这仍需要大量临床研究来证实。未来需对HRHPV阴性宫颈癌进行更加深入的研究和分析,尤其是这些基因的表达水平对肿瘤组织的生物学行为、放化疗敏感性等的影响,以及与HR-HPV阴性宫颈癌发病相关的特异性信号通路,力求为HR-HPV阴性宫颈癌的早期筛查、早期诊断和有效治疗提供新的思路。

