VSMC源KLF5对腹主动脉瘤形成中作用及机制的研究*
孟 丽 朱 艳 徐彦楠 马 冬 周晨明
河北医科大学 1 电镜实验中心 2 教学实验中心,河北省石家庄市 050017; 3 华北理工大学公共卫生学院
腹主动脉瘤(Abdominal aortic aneurysm, AAA)是一种常见的老年退行性血管疾病,大多数AAA患者常无症状,然而瘤体一旦破裂预后极差,病死率高达90%,目前其发病机制仍不明确,未见有效预防和治疗的药物[1-2]。转录因子KLF5是血管重塑相关重要因子[3]。课题组前期研究发现,小鼠髓系细胞KLF5表达缺失能够抑制AAA的形成[4],而细胞血管平滑肌细胞(Vascular smooth muscle cell, VSMC)中KLF5表达缺失将对AAA的表型产生何种影响尚鲜有研究报道。因此,本研究采用CaPO4诱导VSMCKLF5-/-小鼠和野生型小鼠(Wild type,WT)AAA模型并对瘤体组织进行病理分析、基因芯片筛查和差异表达基因的生物信息学分析及验证,探讨VSMC中KLF5表达在早期AAA发病中的分子机制,为寻找潜在治疗靶点提供实验依据。
1 材料与方法
1.1 实验动物 健康雄性的C57BL/6小鼠,SPF级,由河北医科大学实验动物中心提供。实验分为VSMCKLF5-/-组和WT组。VSMCKLF5-/-组为3只6~8周龄雄性VSMCKLF5-/-小鼠;WT组为3只6~8周龄雄性WT小鼠,均由本实验室繁殖提供。购买血管平滑肌特异性表达Cre重组酶工具小鼠与引进的KLF5flox/flox转基因小鼠交配,获得Cre-flox/+/KLF5-cre小鼠。再利用Cre-flox/+/KLF5-cre小鼠互相交配,获得血管平滑肌特异性KLF5基因条件敲除(VSMCKLF5-/-)小鼠。鼠尾采血PCR法鉴定基因型,Western blot证实血管组织中KLF5表达的缺失。
1.2 方法
1.2.1 CaPO4诱导小鼠AAA模型[5]:将小鼠进行持续麻醉,无菌条件下进行腹部手术,暴露腹主动脉血管,分离肾动脉分支至髂总动脉血管,先后包裹浸有CaCl2和PBS的无纺布条10min和5min,取出布条后用生理盐水冲洗,缝合。术后14d,再次以10%水合氯醛腹腔注射麻醉小鼠,剖腹,分离小鼠腹主动脉,并测量腹主动脉最大直径(d2)和瘤旁血管直径(d1),以计算出d2/d1小鼠腹主动脉直径膨胀度,此比值≥2为模型构建成功的客观指标。随后取出腹主动脉组织进行石蜡包埋和液氮冻存。
1.2.2 苏木精—伊红染色(Hematoxylin-Eosin staining):对石蜡包埋组织进行切片,厚度4μm。取主动脉瘤部位切片,将切片脱蜡至水。参考试剂盒说明书稀释染液并进行染色,乙醇梯度脱水,二甲苯透明,中性树胶封片。采用×50和×400放大倍数进行镜检。
1.2.3 血管组织总RNA的提取及mRNA表达谱的检测:剪碎小鼠损伤腹主动脉组织,置于RNA-Solv的匀浆套管中匀浆(冰盒中操作),试剂盒提取总RNA浓度>1μg,OD260/280比值在1.8~2.0范围内。基因芯片检测由康成生物有限公司完成。
1.2.4 差异表达基因的富集分析:将芯片筛查的Fold Change Absolute>2的全部上调基因或下调基因输入Metascape在线分析网站,对差异表达基因进行GO和KEGG pathway富集分析,分别得到差异基因在生物学过程、分子功能和细胞成分三个方面的富集分析和KEGG通路富集分析(P值分别设为0.01和0.05)。
1.2.5 Western blot检测蛋白表达:取瘤样病变血管组织50mg,加入蛋白裂解液和蛋白酶抑制剂冰浴匀浆,离心取上清,BSA法测定总蛋白浓度。取蛋白样品加5×电泳缓冲液,加热至变性,后凝胶电泳,转膜,脱脂牛奶封闭,一抗采用兔抗Stk3、Rassf4、Wwtr1抗体4℃孵育过夜(Proteintech),HRP标记羊抗兔二抗孵育,洗脱、发光,曝光显色。采用Image J软件进行光密度扫描进行半定量分析。
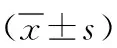
2 结果
2.1 HE染色观察VSMC中KLF5基因缺失对AAA的膨胀变化 HE染色结果显示VSMCKLF5-/-组和WT组小鼠膨胀度均达到AAA标准,VSMCKLF5-/-组术后膨胀度明显大于WT组(3.25±0.35 VS 2.31±0.27),差异有统计学意义(P<0.01),见图1~2。

图1 腹主动脉HE染色切片a.WT组(第一张×50, 第二张×400) b.VSMCKLF5-/-组(第一张×50, 第二张×400)
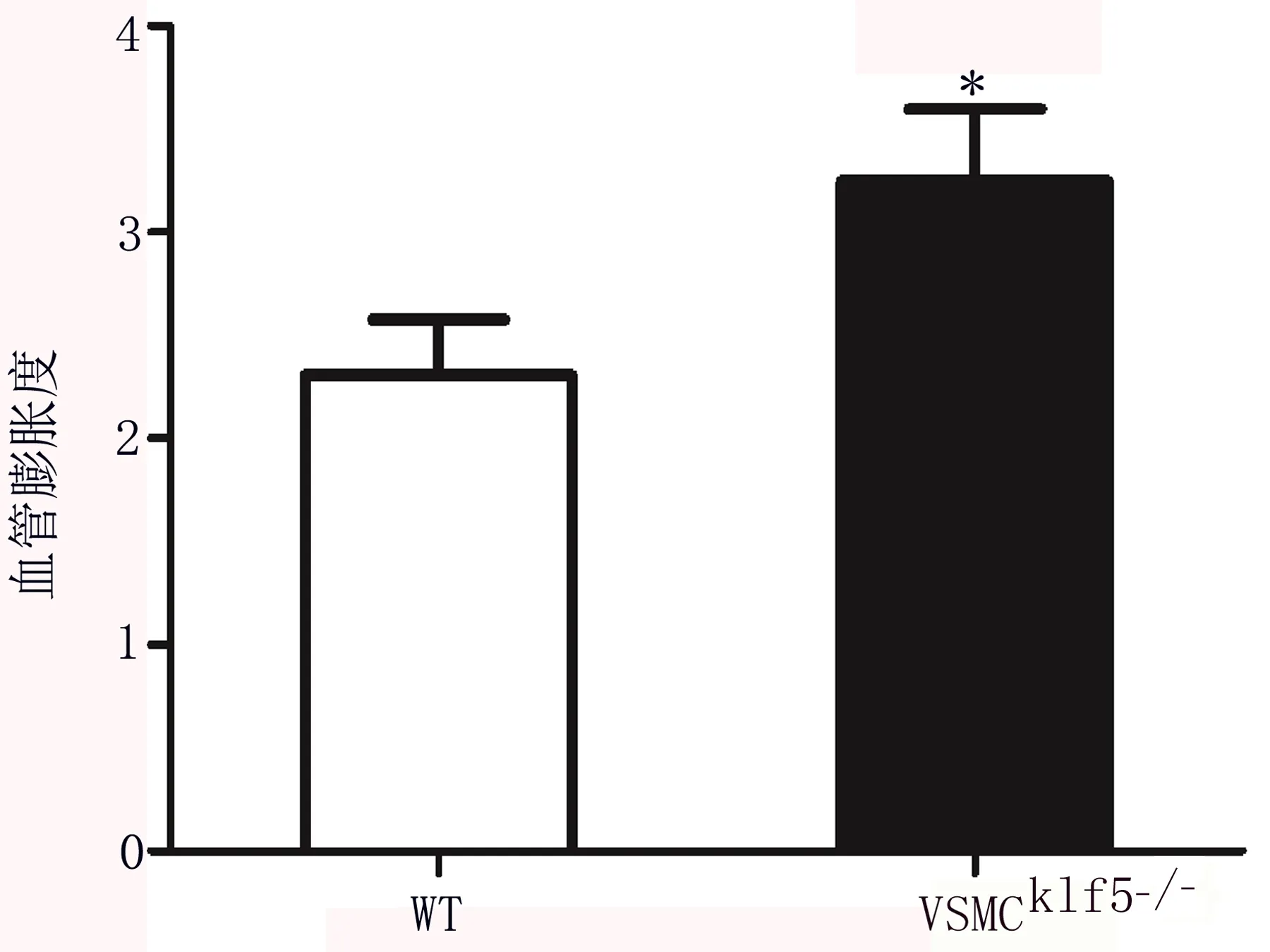
图2 腹主动脉直径膨胀度测量结果与WT组相比,*P<0.01,n=3
2.2 CaPO4损伤小鼠腹主动脉组织中mRNA表达谱分析 mRNA表达谱前50个基因表达差异热图分析结果如图3所示,排名前10的上调和下调差异基因的表达倍数见表1。组织芯片结果显示:与WT组比较,VSMCKLF5-/-组Hippo信号通路失调相关基因Stk3、Rassf4、Wwtr1分别表达上调3.73、2.34、2.06倍。

表1 VSMCKLF5-/-和WT小鼠AAA组织mRNA表达谱
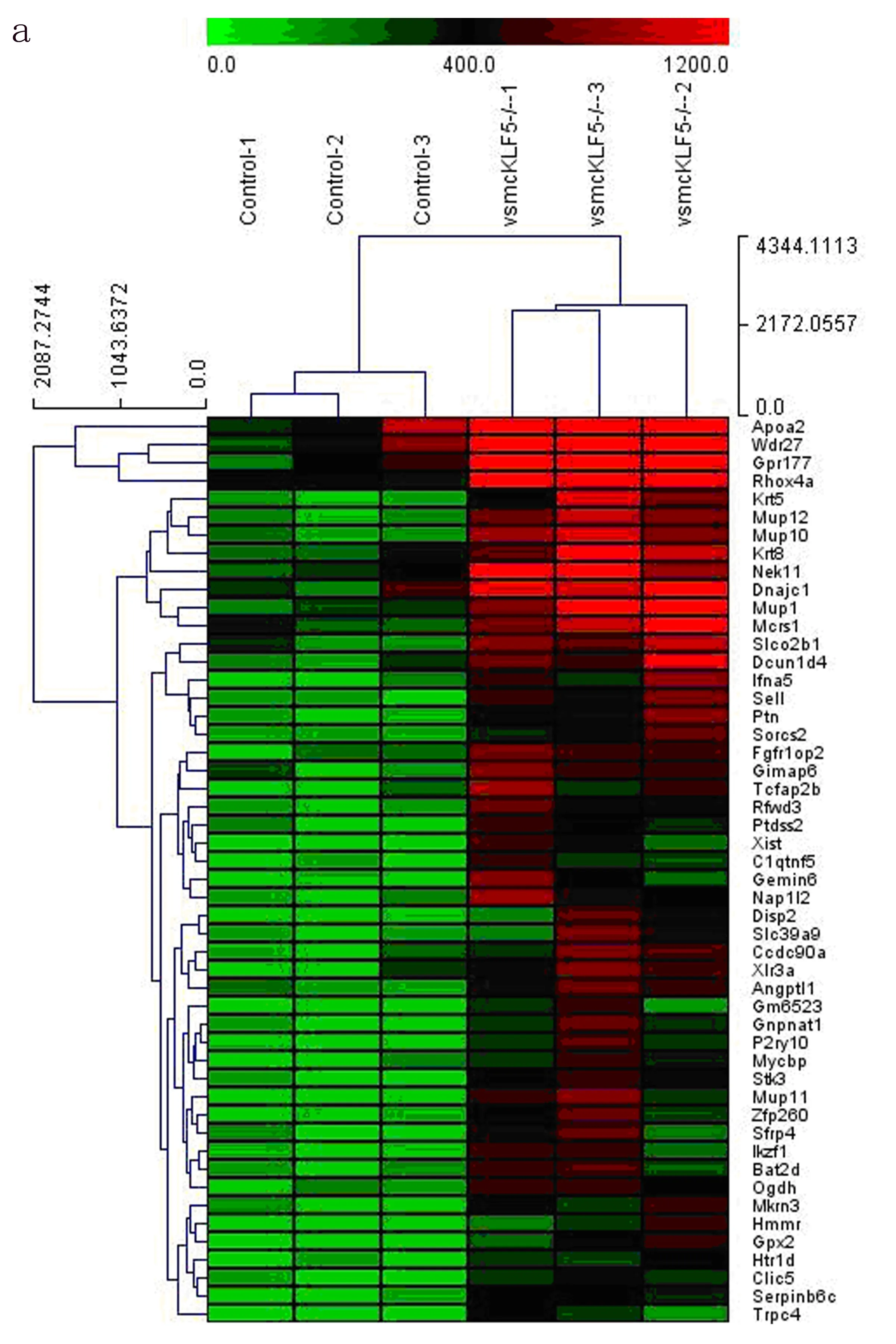

图3 CaPO4诱导VSMCKLF5-/-和WT小鼠AAA组织差异表达基因热图分析a.前50个上调差异基因表达的热图 b.前50个下调差异基因表达的热图
2.3 GO功能和KEGG pathway富集分析 为了探讨VSMC中KLF5调节差异表达基因在AAA形成中的生物学功能,利用Metascape在线数据库进行GO富集分析。分析发现,上调差异表达基因的生物学功能主要富集在转录共激活因子活性、细胞骨架重塑等。下调差异表达基因的学功能主要富集在前体代谢产物和能量的产生等。为了筛查VSMC中KLF5调节相关基因参与AAA形成中的信号通路,笔者对差异表达基因进行KEGG pathway分析,结果如图4所示:上调差异基因KEGG分析中,Hippo信号通路富集最为显著;下调基因KEGG分析中,碳代谢、丙酮酸代谢、线粒体代谢、柠檬酸循环、磷酸戊糖途径等与细胞能量代谢相关的通路富集显著。

图4 差异基因的KEGG pathway分析a.上调基因KEGG的pathway分析 b.下调基因KEGG的pathway分析
2.4 Hippo信号通路相关基因的蛋白表达分析 为了进一步证实VSMC中KLF5调节相关基因影响AAA形成的重要分子通路,采用Western blot 进一步证实,与CaPO4诱导的WT小鼠AAA组织比较,Stk3、Rassf4、Wwtr1在CaPO4诱导的VSMCKLF5-/-小鼠AAA血管组织中表达明显升高,差异具有统计学意义(P<0.05),见图5。

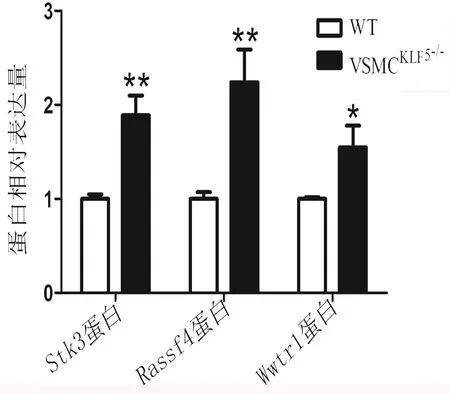
图5 Western blot检测来自小鼠CaPO4损伤的血管组织中Stk3、Rassf4、Wwtr1蛋白表达与WT组比较,*P<0.05, **P<0.01,n=3。
3 讨论
KLFs家族作为基础转录因子,广泛存在于真核生物中,在细胞发育、分化、生长及凋亡等过程中发挥重要的调控作用[6]。KLF5属于其中一员,调控多种与心血管相关基因的表达,先前的研究表明KLF5在应对外部压力及心血管重构中起着重要的作用[7]。也有研究证实 KLF5在巨大的未破裂动脉瘤中高表达[8]。提示KLF5与AAA的形成和发展有关。VSMC在维持动脉功能方面起着重要的作用,其结构功能的失调导致正常收缩状态的丧失以及增殖与凋亡动态平衡的打破均是促进动脉瘤形成的原因[9]。本课题组通过前期的研究发现,小鼠髓系细胞KLF5表达缺失能够抑制AAA的形成[4],而VSMC中KLF5表达缺失将对AAA表型产生的影响尚未有报道。因此,本研究通过CaPO4诱导VSMCKLF5-/-和WT小鼠产生的AAA模型进行KLF5 在VSMC中表达的作用机制的研究。
HE染色结果显示,VSMKLF5-/-组和WT组小鼠膨胀度均达到AAA标准,且血管正常结构破坏,中膜变薄,VSMCKLF5-/-组术后膨胀度明显大于WT组。提示VSMC中KLF5表达缺失可促进AAA的形成。通过mRNA芯片筛查并对差异基因进行生物信息学分析,并发现证实了Hippo信号通路中Stk3、Rassf4、Wwtr1蛋白表达参与AAA的形成。通过GO分析显示上调差异基因在生物学功能方面富集于转录共激活因子活性、微管正端结合、细胞骨架、纺锤体等;下调基因在生物学过程中富集在前体代谢产物和能量的产生等。KEGG分析发现Hippo信号通路在AAA形成中受KLF5调节影响最为显著,该通路主要通过调节细胞增殖、分化、凋亡、能量代谢在器官生长、发育、干细胞稳态、癌症和心血管疾病发生发展中发挥着重要作用[10],Hippo信号通路主要由MST1/2、LATS1/2、YAP、TAZ(WWTR1)组成[11],其中YAP诱导VSMCs表型转换,参与主动脉壁的重构,促进由收缩表型的 VSMCs向合成表型的VSMCs转化,主要改变为收缩功能消失,粗面内质网和高尔基体等细胞器增多,合成和分泌功能增强[12-14],导致胶原蛋白和基质金属蛋白酶的合成增加,而这两者都可以促进胶原蛋白的沉积和弹性蛋白的降解,因而造成主动脉壁的弹性下降,最终导致主动脉瘤[15]。为了进一步证实VSMC中KLF5调节相关基因影响AAA形成的重要分子通路,本研究选择Hippo信号通路相关基因蛋白Stk3、Rassf4、Wwtr1进行分析。MST激酶(MST1/2,其中MST2即STK3)通过调控LATS激酶促进心血管细胞凋亡[16-17],并且影响YAP的磷酸化;Rassf4通过激活MST1[18-19]来对主动脉瘤起作用;Wwtr1和YAP功能相似[20],Wwtr1表达上调可能会影响YAP的表达及磷酸化,但尚未有研究证实。通过Western blot证实Stk3、Rassf4、Wwtr1在VSMCKLF5-/-组中表达明显升高,提示VSMCKLF5-/-组小鼠VSMC中敲除KLF5后通过上调Hippo信号通路相关基因蛋白Stk3、Rassf4、Wwtr1促进AAA的形成。
另外,本研究结果与课题组前期关于小鼠髓系KLF5缺失研究结果正好相反,提示不同细胞中KLF5基因表达变化在AAA形成中的生物学功能是不同的。因此,在进行关于KLF5的表达和细胞生物学功能在心血管疾病中的研究中应考虑到异种细胞的差异性。
综上所述,本研究利用VSMCKLF5-/-小鼠、高通量基因芯片筛查和生物信息学分析方法,并通过实验证实血管平滑肌细胞中敲除KLF5后,通过上调Stk3、Wwtr1和Rassf4的表达参与Hippo信号通路的调节,进而促进AAA的发生,即血管平滑肌细胞中KLF5可能通过调控Hippo通路维持血管稳态并抑制AAA的形成。这也为AAA的发病机制及靶向药物的研发提供实验依据。

