基于磁共振成像的全身脂肪分布特征与人体学参数相关性研究*
戚玉龙 赵琴琴 程传力邹 超 刘 新 郑海荣成官迅,*
1.广东省汕头大学医学院(广东 汕头 515041)
2.广东省北京大学深圳医院医学影像科(广东 深圳 518036)
3.中国科学院深圳先进技术研究院劳特伯生物医学成像研究中心 (广东 深圳 518055)
4.武汉理工大学信息工程学院(湖北 武汉 430070)
随着经济社会的发展和生活方式的改变,近年来中国肥胖人群的数量逐渐增加,肥胖人数约达9000万[1],已经超过美国成为了肥胖人口最多的国家,成为我国人民面临的重大健康挑战[2-3]。研究显示,肥胖更容易增加Ⅱ型糖尿病、非酒精性脂肪肝、心肌梗塞、高血压等多种疾病的患病风险,以及冠心病和血管粥样硬化等重症与肥胖症也存在一定的关系[4]。
传统的身体质量指数(body mass index,BMI)被广泛的应用于评估人体的肥胖程度[1]。然而近年来,诸多研究发现,仅根据BMI来测量和分析肥胖与否及对患病风险评估缺乏特异性[5]。腰臀比(waist-to-hip ratio,WHR)是另外一个广泛用于衡量人体脂肪分布的指标,它定义为腰围与臀围的比值,能够很好的反映出腹部脂肪的百分比[6]。WHR与高血压、高血脂和高血糖等疾病存在紧密的联系,在评估Ⅱ型糖尿病和血脂异常时,WHR指标的精准度明显优于BMI[7]。然而李俊晴等人的研究表明,WHR预测心血管疾病危险因素的能力较弱[8]。
尽管BMI和WHR等人体学参数获取简便,但其均只能在总体上大致反映人体肥胖程度,其对预测疾病风险的价值极为有限。这其中的根本原因在于,人体不同部位的脂肪体积与肥胖相关疾病发生和进展的风险相差极大[9]。例如,人体腹腔内脂肪组织(visceral adipose tissue,VAT)的代谢危害性远大于皮下脂肪组织(subcutaneous adipose tissue,SAT),脂肪在身体各部位的分布特征对于预测肥胖相关的心血管疾病具有更好的相关性[10-11];此外,正常体重性肥胖(normal weight obesity,NWO)与正常人的人体学指标无异,其代谢危害性十分隐匿,临床中难以鉴别[12-13]。因此在肥胖相关疾病的诊疗和动态管理中,亟需发展一种能精准反映全身脂肪分布特征的方法。
计算机断层扫描(CT)和磁共振成像(MRI)等医学成像技术均能够精确显示全身脂肪分布[14],而MRI由于无电离辐射,丰富的软组织对比等优势,是研究全身脂肪分布的首选工具[16]。近年来发展的磁共振化学位移编码成像技术,能够同时定量反映全身脂肪分布特征和脏器沉积情况[17]。本文从磁共振质子密度脂肪分数成像技术出发,利用基于深度学习的全身脂肪分布特征自动提取技术同时对全身脂肪、皮下脂肪及内部脂肪的分布进行定量分析,并研究了脂肪分布特征与传统人体学指标(BMI和WHR)之间的关联性。
1 资料与方法
1.1 研究对象本文回顾性研究人体全身脂肪分布特征。共招集了37名年龄在20~40岁之间的健康志愿者。在实验开始之前,分别对37位志愿者进行身高、体重以及年龄等信息进行采集。对每位志愿者进行10分钟左右的全身磁共振质子密度脂肪分数成像扫描。本研究得到北京大学深圳医院人体伦理道德委员会的批准。
1.2 检查方法所有志愿者的磁共振图像采集均使用由上海联影医疗科技有限公司生产的3.0T磁共振临床扫描仪(uMR790,上海联影,上海,中国)。志愿者扫描中采用1个4通道的颈部线圈、2个12通道体线圈和1个32通道的脊柱线圈配合扫描,磁共振质子密度脂肪分数成像采用六回波的梯度回波成像序列进行图像采集,具体参数如下:重复时间T=10.5ms,回波时间TE=1.67/3.15/4.63/6.11/7.59/9.07ms,双极性采集,采集带宽为900Hz/pixel,翻转角设置为3°,成像视野FOV=300mm×400mm,成像分辨率为126×244,层厚为6mm,每层块层数为20层,并行成像加速倍数为2倍。每个志愿者扫描覆盖颈部至膝盖部位,根据志愿者身高不同,扫描8~9个层块。在扫描胸腔和上腹等部位时,需要志愿者屏气配合(~14.7秒)。
1.3 数据处理采集得到的多回波数据首先经过涡流校正去除奇偶回波间相位的不一致[18],然后使用自校正多分辨率区域增长水脂分离算法分离水脂信号[19],得到水图像和脂肪图像。由于成像参数中使用小翻转角(3°),因此水脂的信号比例可以近似为水脂的质子密度比例,质子密度脂肪分数图像(PDFF)=脂肪图像/(脂肪图像+水图像),其计算由系统中的FACT(fat analysis and calculation technique)产品自动完成。
本课题组前期开发了基于深度学习的全身脂肪自动分割工具[20],该网络能将输入的全身各部位PDFF图像进行自动分割,将全身脂肪组织(TAT)区分为皮下脂肪组织(SAT)与内部脂肪组织(IAT),其中内部脂肪组织被定义为皮下脂肪组织以外的脂肪组织:IAT=TAT-SAT。图像自动分割在Python 3.9中进行。
1.4 统计学分析根据上述自动分割的结果统计每一位志愿者的脂肪组织体积,包括:全身脂肪组织(TAT)体积、皮下脂肪组织(SAT)体积、内部脂肪组织(IAT)体积、腹部皮下脂肪(abdominal subcutaneous fat, ASF)体积、腹内脂肪(abdominal visceral fat , AVF)体积,并基于多回波图像估算志愿者全身总体积(whole body, WB)。进一步地,得到以下三个归一化定量指标:全身脂肪体积比(TAT/WB)、内部脂肪占比(IAT/SAT)和腹腔内部-皮下脂肪比(AVF/ASF)。根据性别分组,将上述三个定量指标分别与BMI和WHR进行Pearson线性相关分析,P<0.01被定义为统计显著性。上述统计学分析均在SPSS v25.0(IBM,芝加哥,美国)中进行。
2 结 果
本研究共采集了37位志愿者(年龄范围:22~37岁,25.78±3.55),其中女性志愿者17位(年龄范围:22~37岁,26.59±3.49),男性志愿者20位(年龄范围:22~32岁,25.10±3.05)。
图1显示了一名女性志愿者和一名男性志愿者的全身各个部位质子密度脂肪分数图像。进一步地,本研究通过全身脂肪分布特征自动提取与分析方法得到了各部位皮下脂肪(SAT)和内部脂肪(IAT)的分布图。
根据性别分类, 37位志愿者的人体学参数BMI与腰臀比(WHR)、脂肪组织体积(TAT、SAT与IAT)、分布特征指标内部脂肪占比(IAT/SAT)、全身脂肪体积比(TAT/WB)和腹腔内部-皮下脂肪比(AVF/ASF)的完整信息如表1所示。根据性别分组后,统计分析结果显示,女性志愿者的BMI为 (21.29±4.41)kg/m2,男性志愿者的BMI为(24.22±3.83)kg/m2,二组之间无显著性差异(P=0.04)。
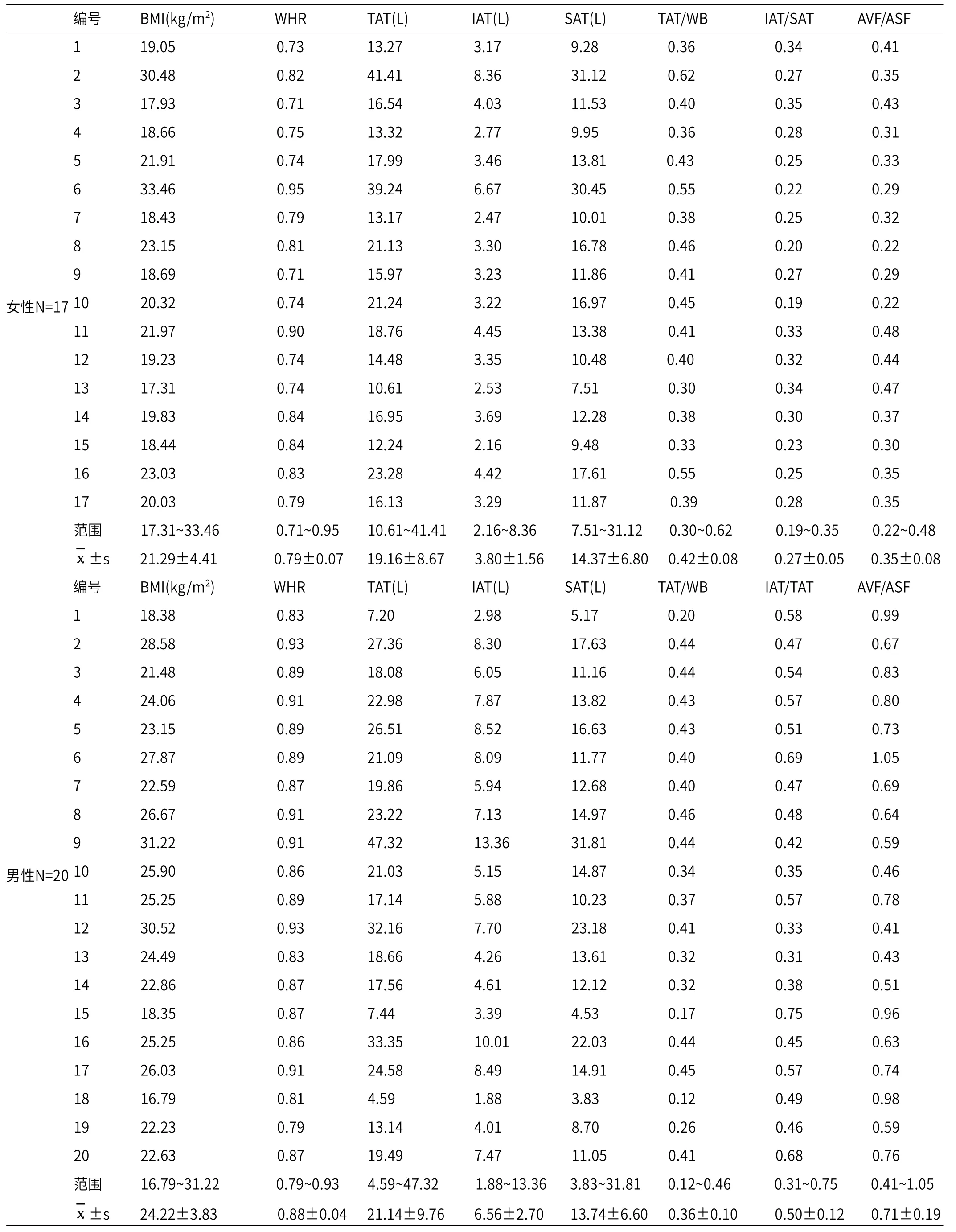
表1 全身脂肪体积及分布特征的定量结果
人体学参数BMI与WHR在所有志愿者(n=37)、女性志愿者分组(n=17)和男性志愿者分组(n=20)中均具有显著的线性相关性(P<0.01),线性相关系数分别为0.699,0.674和0.682,如图2所示。

图2 人体学参数BMI与WHR的相关分析结果。其中r代表Pearson线性相关系数,*代表统计显著性(P<0.01)
将所有志愿者(N=37)BMI与全身脂肪分布特征TAT/WB,IAT/SAT以及AVF/ASF对比发现,BMI仅与TAT/WB呈现显著的线性相关性(r=0.593),与IAT/SAT和AVF/ASF两个脂肪分布指标几乎没有线性关系(P值分别为0.70和0.86),如图3所示。这种线性相关性同样分别存在于女性和男性分组中:BMI仅与TAT/WB呈现显著的线性相关性(女性r=0.861,男性r=0.742),但与IAT/SAT和AVF/ASF均无显著相关性。另一方面,尽管女性组和男性组在BMI指标上没有显著性差异,但在脂肪分布特征上具有显著的差异:女性组中IAT/SAT为0.20±0.03,男性组中IAT/SAT为0.33±0.06(P<0.001);女性组中AVF/ASF为0.35±0.08,男性组中AS/ASF为0.71±0.18(P<0.001)。这些结果均说明了脂肪囤积的模式在女性和男性之间呈现出较大的差异,而这种差异均难以从BMI这一指标中体现出来。
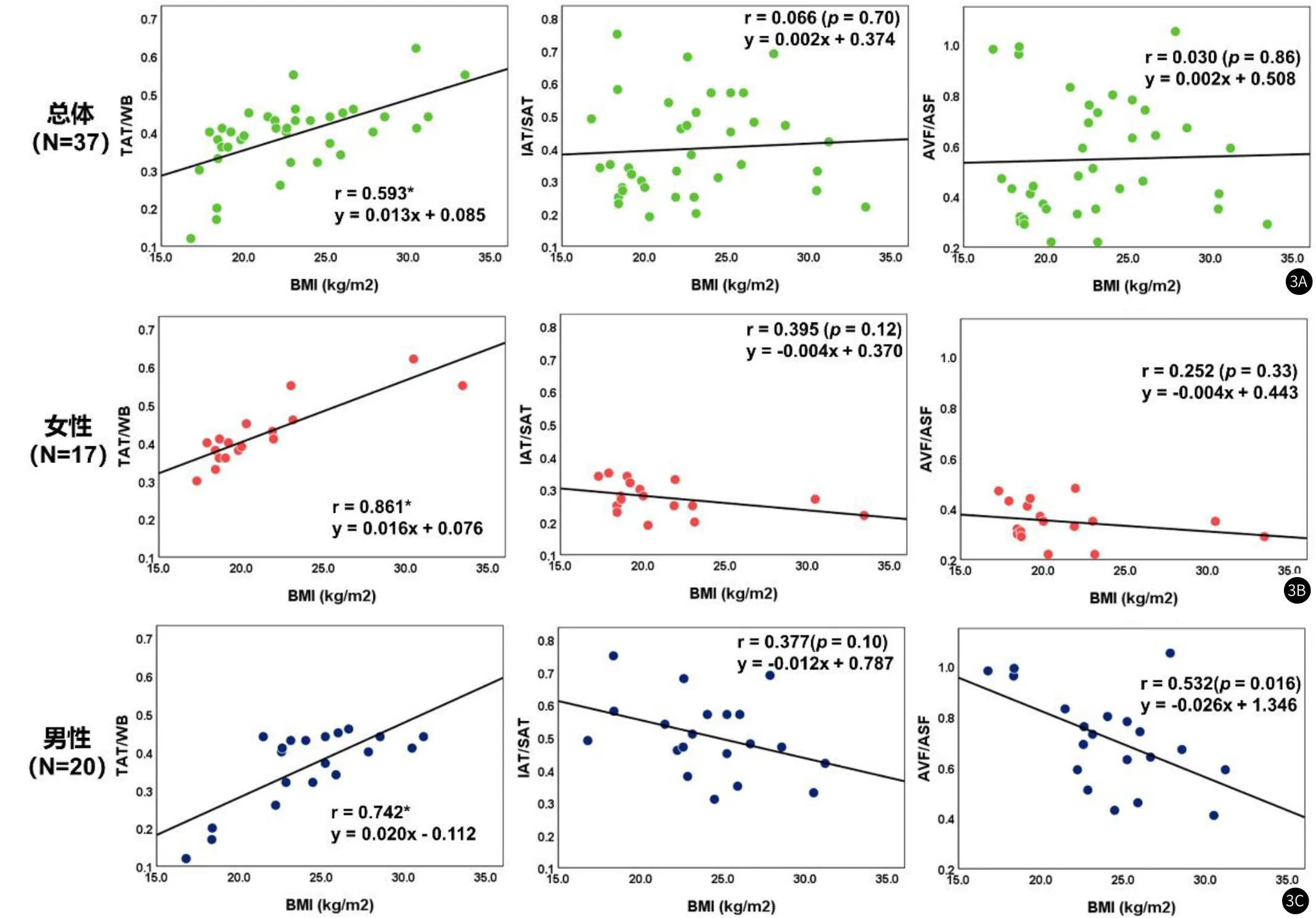
图3 人体学参数BMI与脂肪分布特征TAT/WB,IAT/SAT以及AVF/ASF的线性相关性分析,其中r代表Pearson线性相关系数,*代表统计显著性(P<0.01)
腰臀比(WHR)被认为在反映代谢相关疾病风险上的准确度与特异性上好于BMI。我们发现,WHR仅在男性组中与TAT/WB指标有显著的线性相关性(r=0.745),如图4所示。在女性组中,WHR与TAT/WB、IAT/SAT以及AVF/ASF三个指标相关性都不大。而在总体样本中,WHR与IAT/SAT和AVF/ASF也仅仅呈现出中度的线性相关性。从上述分析中可以看出,WHR与全身脂肪体积比例的关联性不如BMI高;在反映局部脂肪分布时,要好于BMI。
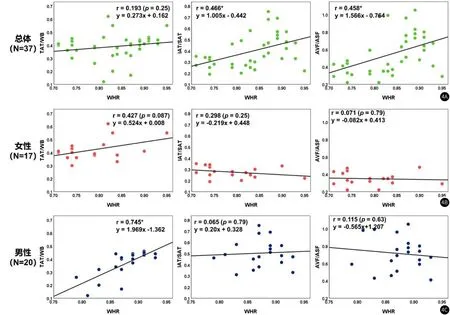
图4 人体学参数WHR与脂肪分布特征TAT/WB,IAT/SAT以及AVF/ASF的线性相关性分析,其中r代表Pearson线性相关系数,**代表统计显著性(P<0.01)
3 讨 论
本文从磁共振质子密度脂肪分数成像出发,利用基于深度学习网络的全身脂肪分布特征自动分析工具,提取人体全身脂肪分布特征参数,并与传统的人体学指标BMI和WHR在37名志愿者中进行了对比研究。
近年来的诸多研究显示,BMI和WHR等人体学指标在研究代谢相关疾病方面显示出极大的缺陷,其原因在于人体学指标在无法准确描述人体脂肪分布特征,而某些代谢相关疾病患病风险与人体脂肪分布特征高度相关[5,12-14]。基于影像学的手段则能很好地弥补人体学指标在描述脂肪分布上的不足。现有的双能X线吸收人体成分分析法(dual-energy x-ray absorptiometry,DXA)基于组织对X光吸收率不同的原理来测量体内不同成分质量,实现全身脂肪分布定量[15]。DXA的优势在于扫描速度快,对身体成分定量精准,但DXA具有电离辐射,不利于长期纵向研究,也不适用于儿童和老年人研究。相比而言,磁共振成像具有无电离辐射这一优势,在实施安全性上具有DXA无可比拟的优势。传统上磁共振多基于T1加权成像序列实现全身成像[22],利用脂肪短T1的特点实现全身脂肪分割,这种基于信号强度的加权成像对射频发射与接收均匀性提出较高的要求。袁灵提出使用Dixon成像序列,利用两点Dixon算法得到全身水和脂肪图像,并得到脂肪分数的定量信息[23]。这种定量成像的手段很好地避免了射频均匀性对图像分割造成的问题,然而两点Dixon方法仅能用于区别脂肪组织,对于脂肪在肝脏、胰腺、肌肉和骨骼中的沉积难以准确定量[24]。本文提出的磁共振质子密度脂肪分数全身成像兼顾了脂肪组织识别和脂肪沉积定量两大需求,实施简便, 5分钟之内即可完成从颈部至膝关节的全身扫描,仅需要志愿者在胸腔和腹部等3-4个床位扫描期间配合15秒以内的屏气。随着磁共振快速成像技术的不断发展,扫描速度也能逐步与DXA靠近。
人体全身扫描图像数据量大,人工分析耗时费力,且容易受主观因素影响。黄泽弟等人通过手动勾画方式对脂肪进行分割,但由于工作量巨大,仅通过手动方式分析了L2-L3段断面的脂肪分布情况[25]。半自动的分割方法通过人机互动能高效率识别脂肪边界[26],但半自动方法基于迭代算法,需要大量的计算时间,且对脂肪轮廓的初始值较为敏感。本文使用课题组前期开发的一种基于深度学习网络的全自动分割工具,能对全身皮下脂肪和内部脂肪实现精准分割,该网络分割精度达到0.976,处理速度达到0.08秒/幅图像[20],能为临床研究中大规模人体数据分析提供简便实用的工具。
本文基于各部位脂肪体积进一步提取了TAT/WB,IAT/SAT以及AVF/ASF等三个全身脂肪分布特征。TAT/WB指标表示了全身脂肪总体积与全身体积的比值,该比值与传统意义上的体脂率类似。从相关分析也可以看出,该指标与BMI高度相关,能够对人体肥胖程度进行整体评估。IAT/SAT指标表示了人体内部脂肪与总脂肪的比值,表现了脂肪在皮下或者内脏中囤积的倾向性,对于预测代谢性疾病风险具有较高的价值[9-10]。然而从线性回归分析结果来看,该指标在女性组中与BMI线性关联性低;在男性组中IAT/SAT与BMI呈弱负相关,说明在本文的志愿者男性人群中,脂肪在BMI较高的个体中更倾向于分布在皮下,这种分布倾向主要存在于健康年轻人群中[9],也符合本文志愿者的年龄范围(男性:25.1±3.0岁)。AVF/ASF与IAT/SAT指标类似,更聚焦于反映脂肪在腹腔内部和腹腔皮下的比例,与BMI的关联关系也与IAT/SAT指标类似。总体而言,传统人体学指标BMI和WHR与全身脂肪特征TAT/WB有一定的线性关系,但与反映脂肪囤积倾向性的IAT/SAT及AVF/ASF等指标的关联性不大,也说明了全身脂肪特征能够提供BMI和WHR等人体学指标难以反映的新特征。
由于全身各部位脂肪体积和分布均已知,技术上可提取更多更精细的分布特征,例如腹侧脂肪与背部脂肪比例、腹部脂肪与肢体脂肪比例等指标。此外,脏器中的脂肪沉积也是脂代谢异常的重要指征[27-29],在本文使用的全身脂肪成像中也能体现。例如本研究中发现有5名肝脏脂肪含量超过6.4%(女性1名,男性4名),达到轻度脂肪肝的诊断标准[28-29],但由于个体数较少,因此未对该指标进行统计分析。此外,当前研究仅在一台磁共振系统上进行数据采集,未来将会在不同场强,不同供应商的系统中进一步验证本文方法的适用性。另外,本文使用的扫描方式仅覆盖了颈部到膝关节部位,覆盖范围略小于DXA,因此在全身脂肪体积占比等指标原理上要略低于DXA。磁共振与DXA的全身脂肪定量结果之间的关系将在未来进行进一步探索。
本文的缺陷和不足主要在于纳入研究的人群数较少,而且仅针对20~40岁的中青年健康志愿者,因此,主要结论也仅能部分适用于年轻的健康志愿者中。另外,本文的研究中未将血液生化、血糖和血脂等指标与人体脂肪分布特征进行对比关联分析。未来将招募更多数量的志愿者,并设计按照性别、年龄范围、地域和民族等分组方式,将纳入临床上明确的肥胖、非酒精性脂肪肝、糖尿病等疾病患者,进一步探索磁共振全身脂肪定量方法在代谢性疾病诊断、治疗和动态管理方面的价值。
综上所述,本文基于深度学习网络发展了一种用于磁共振脂肪分布特征自动提取和分析的方法,并在中青年健康志愿者中分析了全身脂肪分布特征与人体学指标的相关性。结果显示基于磁共振的全身脂肪特征能够提供BMI和WHR等人体学指标难以反映的新特征,将成为研究肥胖相关疾病的新工具。

