MRI联合血清肿瘤标志物对BOT及Ⅰ期EOC的鉴别诊断价值*
张俊梅 刘洁梅 李琳可 郭晓云
西北妇女儿童医院妇科 (陕西 西安 710061)
卵巢交界性肿瘤(borderline ovarian tumors,BOT)又可以称为低度恶性潜力肿瘤[1]。1929年,Taylor首次提出这类肿瘤,1971年、1973年FIGO和WHO分别确定交界性肿瘤有别于良性、恶性肿瘤,为另一独立病理和临床类型的肿瘤[2]。BOT占所有卵巢恶性肿瘤的4%~15%。卵巢癌是妇科三大恶性肿瘤之一,预后最差。根据病理分型可分为:卵巢上皮癌、卵巢生殖细胞肿瘤、卵巢性索间质肿瘤,其中以卵巢上皮癌(epithelial ovarian cancer,EOC)最为多见[3-4]。既往有研究表明,BOT的临床症状与浸润性卵巢癌,尤其是Ⅰ期EOC及其相似,但是两者生物学行为及预后均有所差异,故手术方案也存在一定的差异,所以术前准确鉴别诊断BOT和Ⅰ期EOC尤其重要[5]。临床上诊断卵巢疾病主要依赖于影像学检查、肿瘤标志物[6]。故本研究选取58例BOT患者和49例EOC患者作为研究对象,研究MRI联合血清肿瘤标志物对BOT及Ⅰ期EOC的鉴别诊断价值。
1 资料与方法
1.1 一般资料回顾性分析本院2017年6月至2019年9月收治的经手术病理证实的58例BOT患者和49例EOC患者的临床资料。58例BOT患者中,年龄21~74岁,平均(54.64±6.97)岁。49例EOC患者中,年龄40~78岁,平均(58.94±9.67)岁。根据患者疾病性质分为BOT组和EOC组。临床表现:腹痛、腹胀患者31例,月经紊乱患者27例,阴道不规则流血19例,腹部或盆腔包块18例,其他12例。
纳入标准:均无MRI检查禁忌症;影像学、实验室资料完整;MRI图片质量清晰,不影响诊断;患者均签署知情同意书。排除标准:伴其他恶性疾病者;伴全身急慢性感染性疾病;痴呆、癫痫等特殊人群;既往存在卵巢手术史;二次复发患者。
1.2 方法
1.2.1 MRI检查 检查仪器选用西门子3.0T磁共振,患者平躺于扫描床,取仰卧位,选用腹部8道相控阵体部线圈,扫描参数:SE序列T1WI参数,TR 550ms,TE 10ms,FOV 36cm,层厚5mm,间距1mm。T2WI序列采用快速自旋回波(TSE)序列,扫描参数:TR/TE为3000ms/108ms,FOV 36cm,层厚5mm,间距1mm。DWI序列参数:b值为0.600s/mm2,扫描层数为36层,TR/TE为4225ms/67ms,层厚6mm,FOV为40cm×40cm,间距1mm(采集4次)。SPGR序列参数:TR/TE为150ms/最小值(Min-imun) 。扫描范围:左肾下极水平至耻骨联合。先进行平扫,平扫完后注入Gd-DTPA试剂进行增强扫描。
1.2.2 肿瘤标志物测定 术前对所以患者行CA125、HE4两种血清肿瘤标志物的测定。检查前叮嘱患者不能进食,进行空腹检查,抽取3mL外周静脉血,血清CA125使用罗氏试剂化学发光法测定。CA125小于35U/mL为正常人血清,测量值高于35U/mL,则判为阳性。血清HE4使用酶联免疫吸附法测定,HE4小于150pmol/L为正常人血清,测量值高于150pmol/L,则判为阳性。
1.3 观察指标观察MRI检查及血清CA125、HE4检查所得结果进行分析诊断;比较两组患者MRI特征及血清肿瘤标志物含量,分析MRI检查联合血清肿瘤标志物检测鉴别诊断这两种疾病的诊断准确率。
1.4 统计学方法采用SPSS 18.0软件分析,计量资料以(±s)描述,采用t检验;计数资料通过率或构成比表示,行χ2检验;以P<0.05为有差异。
2 结 果
2.1 BOT组和EOC组患者MRI特征比较BOT组58例患者,单侧病变50例,双侧8例;EOC组49例患者中,单侧病变44例,双侧5例,两组患者肿瘤发生部位差异无统计学意义(P>0.05)。两组患者肿瘤大小、分隔数比较,差异均无统计学意义(P>0.05)。BOT组实性部分大小、分隔厚度均小于EOC组(P<0.05),见表1。
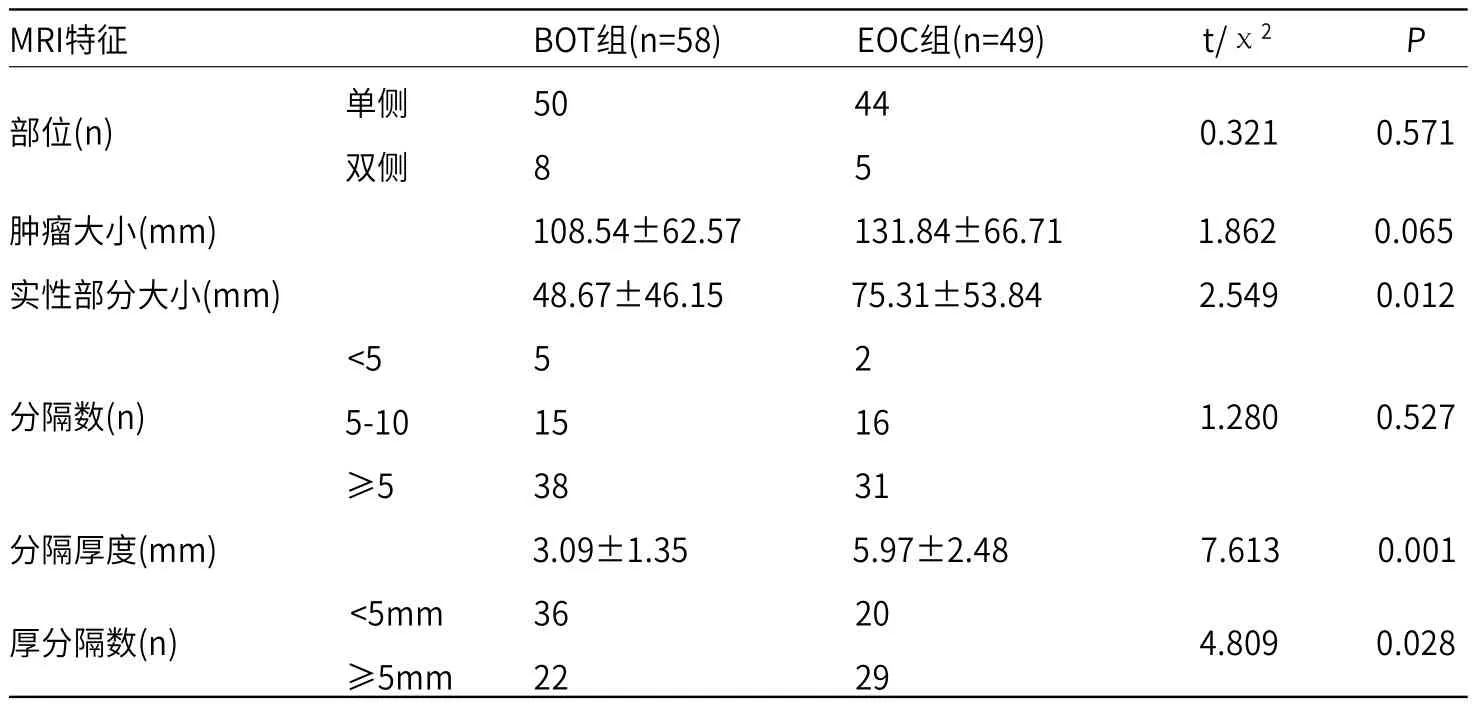
表1 BOT组和EOC组患者MRI特征比较
2.2 BOT组和EOC组患者血清肿瘤标志物含量比较BOT组患者的血清CA125含量低于EOC组,但两组比较差异无统计学意义(P>0.05);EOC组患者的血清HE4含量显著高于BOT组(P<0.05),见表2。
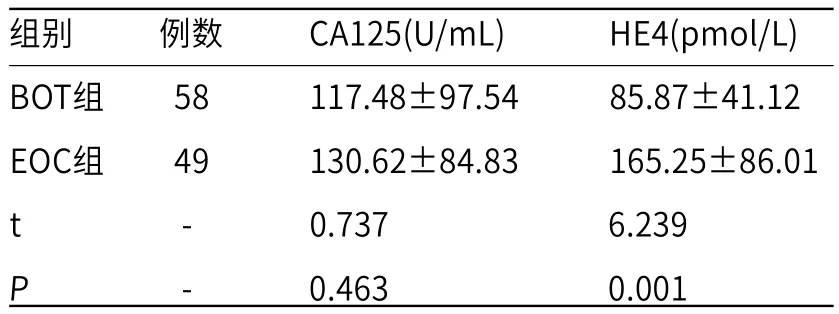
表2 BOT组和EOC组患者血清肿瘤标志物含量比较
2.3 不同检查鉴别诊断BOT和EOC的诊断准确率比较经MRI检查诊断BOT和EOC的诊断准确率为80.37%(86/107),经血清肿瘤标志检测BOT和EOC的诊断准确率为73.83%(79/107),两者比较差异无统计学意义(P>0.05);MRI检查联合血清肿瘤标志物检测BOT和EOC的诊断准确率为93.46%(100/107),明显高于单一的血清肿瘤标志物检测及MRI检查,差异有统计学意义(P<0.05),见表3。

表3 不同检查鉴别诊断BOT和EOC的诊断准确率比较[n(%)]
2.4 病例分析典型病例影像分析见图1~图4。
3 讨 论
卵巢癌发病率在女性生殖道恶性肿瘤中占第三位,但是死亡率位居第一。近20年来,发病率以每年0.1%的速度增长,女性一生中患卵巢癌的危险为1.5%。卵巢癌初期很少有症状,早期诊断较困难,就诊时70%的患者已属于晚期,很少能得到早期治疗,5年生存率徘徊在20%~30%。BOT是一种处于卵巢良性与恶性肿瘤之间的一种卵巢肿瘤,BOT中最常见的类型是黏液性肿瘤和浆液性肿瘤,国内文献报道粘液性多见占2/3,浆液性占1/3,国外文献报道粘液性和浆液性所占比例相当,浆液性甚至比粘液性多见,其他类型少见,大约占2%[7-8]。与卵巢癌相比,BOT患者多见于年轻妇女,大约有一半的BOT患者在诊断时不足40岁,其中Ⅰ期比较高,占75%,但是其治愈率较高,预后较好[9]。在临床诊断上,由于BOT的临床特点与Ⅰ期EOC非常相似,导致容易出现误诊的现象,给临床医生带来一定的困扰。所以需寻找一种可有效鉴别两者的方法,为手术方案的制定提供可靠的依据。

患者女,52岁,卵巢上皮癌ⅠC期MRI平扫示:腹盆腔内巨大不规则形囊实性T1呈等、长T1,T2呈等、长信号(图1~图2),边界清晰,范围约198mm×167mm×98mm(上下、左右、前后),囊性部分DWI序列呈等信号,实性部分位于右后囊壁,DWI序列呈高信号(图3),厚约16mm。子宫局部受压,内膜无明显增厚;增强扫描示:病灶与邻近血管分界尚清,实性部分呈不均匀持续强化(图4)。
MRI检查是临床上鉴别诊断卵巢良恶性肿瘤常用的影像学方法[10]。BOT在MRI中变现为含有数条分隔的多房囊性肿块,囊内信号不一,伴有高信号乳头结构,且肿瘤直径不低于10cm。王灵芝[11]等研究显示,Ⅰ期EOC的MRI表现与BOT极其相似,根据MRI信号特点很难鉴别两者。国外曾有报道表明,通过乳头大小、分隔厚度可有效鉴别BOT和卵巢良性肿瘤,但是无法作为鉴别Ⅰ期EOC和BOT的依据[12]。本研究中,BOT组和EOC组患者肿瘤部位、肿瘤大小、分隔数比较,差异均无统计学意义(P>0.05),与相关报道一致[12-13]。故根据肿瘤部位、肿瘤大小、分隔数无法有效鉴别Ⅰ期EOC和BOT。两组患者的分隔数比较无差异,分析其原因可能与肿瘤的大小及组织类型所占比例有关。但是本次研究发现,BOT组实性部分大小、分隔厚度均小于EOC组(P<0.05)。表明肿瘤的恶性程度与肿瘤实性成分直接、分隔厚度有一定关系。
CA125是目前认为对EOC较为敏感的肿瘤标记物,阳性率可达80%~90%,但是特异性不够强,某些良性妇科疾病或其他类型的腹腔内恶性肿瘤也可使血清CA125水平升高,因此,血清CA125用于卵巢癌的诊断,必须结合临床表现,进行综合分析,而且血清CA125对于卵巢粘液性肿瘤敏感性较差,这是需结合其他的肿瘤标记物[14]。HE4是一种新型的卵巢特异性肿瘤标注物,与CA125比较,HE4鉴别诊断Ⅰ期EOC和BOT的敏感度和特异度要高,熊雯[15]等研究证实了这一点。但是HE4鉴别诊断Ⅰ期EOC和BOT的敏感度和特异度虽高,却无法显示肿瘤的形态特征,所以需与MRI检查联合使用,有助于提高鉴别诊断Ⅰ期EOC和BOT的诊断准确率。本研究中,对Ⅰ期EOC和BOT患者均进行了MRI和肿瘤标记物检测,结果显示,两者联合鉴别诊断BOT和EOC的准确率明显高于单一的血清肿瘤标志物检测及MRI检查(P<0.05),进一步证实了上述观点。
综上所述,MRI检查可清楚显示Ⅰ期EOC和BOT的影像学特点,结合血清肿瘤标志物可有效鉴别Ⅰ期EOC和BOT,提高诊断准确率,值得广泛推广应用。

