中药单体抑制心律失常的离子通道机制研究进展
庞舜予,张雅琪,罗佳欣,唐敏利,李清伶,陈颖卿*,刘丽萍*
·综 述·
中药单体抑制心律失常的离子通道机制研究进展
庞舜予1, 2,张雅琪1, 2,罗佳欣1, 2,唐敏利1, 2,李清伶1, 2,陈颖卿1, 2*,刘丽萍1, 2*
1. 大连大学 慢性病研究中心大连市重点实验室,辽宁 大连 116622 2. 大连大学 有机天然产物功能性成分利用工程技术研究中心辽宁省重点实验室,辽宁 大连 116622
药用植物中存在许多具有显著药理活性的天然单体成分,在抑制心律失常方面具有独特的优势。近年来,诸多学者从不同的角度开展了大量中药单体成分缓解心律失常的基础研究。经过深入总结其作用机制,发现中药单体成分抑制心律失常主要集中在抑制钾离子、钠离子、钙离子通道等方面。综述了中药单体抑制心律失常的离子通道机制研究进展,旨在为调节心律失常中药单体的基础研究提供思路,同时为基于中药活性成分的创新药物研发提供理论依据。
中药单体;心律失常;离子通道机制;钾离子;钠离子;钙离子;葛根素;阿魏酸;青蒿素;甘草次酸;人参皂苷Re;白花前胡甲素;丹皮酚
据《中国心血管健康与疾病报告2020》[1]指出,我国目前心血管疾病(cardiovascular disease,CVD)患病率处于持续上升阶段,推算CVD现患病人数约为3.3亿,且CVD死亡率仍居首位,高于肿瘤及其他疾病。心律失常作为临床中典型的心血管疾病之一,是指窦房结激动异常或激动产生于窦房结以外,导致激动的传导缓慢、阻滞或经异常通道传导的一类病症。近90%的急性心脏病死亡是由心律失常引起的,其在世界范围内严重威胁人类生命健康。日前,我国心律失常患者约2000万人,每年心源性猝死事件超过50万件,恶性心律失常引起的占80%以上。此外,近期研究表明,新型冠状病毒不仅严重损伤呼吸系统引起急性呼吸窘迫症和肺纤维化,还可通过直接损伤心肌细胞、全身性炎症反应及T辅助细胞介导的炎性风暴引起心律失常,其病死率高达10.5%[2]。近几年来,抗心律失常化学药在临床应用的安全性不断被质疑,很多药物本身存在局限性及不良反应,且有致心律失常作用[3],因此,从药用植物中寻找高效低毒的中药单体成分用于心律失常的治疗受到各国学者的高度重视[4]。心脏离子通道顺序活动导致动作电位的产生,当这些离子通道的电生理特性或功能表达发生改变时,动作电位也会随之发生改变,使心脏易患严重的心律失常等病理过程。因此,心脏离子通道活动的调节,是多数抗心律失常药物最主要的作用机制。本文对中药单体抑制心律失常的离子通道机制研究进展进行综述,为中药单体基础研究及临床用药提供参考。
1 抑制钾离子通道
在抑制心律失常作用机制中,多离子通道阻滞作用往往是关键性因素,在心肌细胞内,阻滞钾离子通道是抑制心律失常的重要方式之一[5]。目前明确的与心律失常相关的钾离子通道包括缓慢激活延迟整流钾通道(delayed rectifier potassiumcur rent,IKs)、超快延迟整流钾通道(rapidly activated delayed rectifier potassium channel,IKur)、瞬时外向钾通道(transient outward potassium channel current,Ito)、内向整流钾通道(inwardly rectifying potassium channels,IK1)等,其作用各不相同[6]。钾离子通道阻滞剂可以阻止钾离子从通道孔中通过,其中IK1可以维持心肌细胞静息膜电位,恢复膜原有的极化状态。
研究发现,葛根(Willd.) Ohwi的主要成分之一葛根素可改善因缺血再灌注诱导的心律不齐,其机制可能在于提高心肌细胞的抗氧化能力和Na+, K+-ATPase活性,降低氧自由基的伤害,维持心肌细胞膜两侧电平衡[7]。还有学者提出,不同浓度葛根素均能延长心室肌细胞50%复极化动作电位时限(fifty percent repolarization of action potential duration,APD50)、90%复极化动作电位时限(ninety percent repolarization of action potential duration,APD90)和有效不应期(effective refractory period,ERP),其机制可能是通过抑制IK而实现的,IK分为IKs和IKur[8]。后有研究人员通过葛根素对豚鼠乳头肌动作电位及IK影响实验,证明了葛根素能够抑制IK从而延长心室肌细胞APD50和APD90,延长ERP可能是其抑制抗快速性心律失常的电生理机制[9]。黄连Franch.中的有效成分小檗碱具有抗心律失常作用。研究人员通过电压钳制术观察到小檗碱对IK有显著的抑制作用,并且对钠电流(INa)无影响[10]。有报道认为,小檗碱抗心律失常的机制是延长APD50、APD90,同时使ERP延长,继而使期前冲动不易引起折返激动,终止折返激动。进一步应用细胞膜片钳技术观察心肌细胞膜上的离子流时,发现小檗碱能够明显抑制IK和IK1,这是其延长心肌细胞动作电位时程(action potential duration,APD)以及抗心律失常的重要机制之一[11]。多个实验证明,青藤(Thunb.) Rehd. et Wils.的有效成分青藤碱能降低心肌兴奋性、自律性,延长APD及ERP,并可降低动作电位幅度(action potential amplitude,APA)及0相去极速率,具有良好的抗心律失常作用[12-13]。Satoh[14]使用膜片钳全细胞记录技术,记录青藤碱对豚鼠心室肌细胞膜离子通道的影响,特别是钾离子通道。研究发现青藤碱对心肌细胞IK1和IK在不同的浓度下均有阻滞作用,并能作用于心肌细胞的2、3相复极期,使APD和ERP延长,同时降低心肌细胞膜的静息电位,这可能是青藤碱抗心律失常的主要作用机制。当归和川芎2种中药都有活血化瘀的功能。实验表明,它们都能扩张冠状动脉、增加冠脉血流量、降低心肌耗氧量,同时还分别具有抗心律失常和强心的功能[15]。当归(Oliv.) Diels和川芎Hort.的主要成分为阿魏酸,其钠盐为阿魏酸钠,具有舒张血管、抗氧化和清除自由基等作用。研究发现阿魏酸钠具有抗心律失常作用[16]。研究表明阿魏酸钠主要延迟IK、IK1及Ito[17]。周彤等[17]使用阿魏酸钠通过对家兔心室肌细胞钾通道电流的影响实验发现,阿魏酸钠不仅可浓度相关性地抑制IK和IKs,且高浓度还可抑制IK1,具有同时阻断IKur和IKs通道开放作用,同时稳定静息膜电位。推测阿魏酸钠能够阻滞多种IK,延长APD是其抗心律失常作用的电生理机制之一。青蒿素为黄花蒿Linn.抗疟的主要有效成分,在应用其治疗疟疾的同时发现该药可使窦性心动过速消失[18]。研究发现,青蒿素对大鼠冠脉结扎诱发的心律失常、对大鼠氯化钙诱发的心律失常及对小鼠氯仿诱发的心律失常均有明显抑制作用。研究人员通过青蒿素对豚鼠心室肌细胞IK1的影响发现,青蒿素可明显抑制IK1,并且呈剂量相关性。青蒿素抗心律失常的主要机制为抑制IK1、IK,降低自律性,延长APD[19-20]。研究发现,人参皂苷Re具有抑制心律失常的作用,其能通过抑制IK1,在静息期促使膜电位向超极化变化,使膜兴奋性降低,降低刺激反应性[5]。另有研究证明,人参皂苷Re、Rb1都能不同程度地通过抑制Ito减少心律失常的发生,其机制可能为人参皂苷Re、Rb1减少跨室壁复极不均一性,减少尖端扭转性室性心动过速[21]。实验证明,人参皂苷Rg3对抑制心律失常有积极作用,其抑制IKur通道,但通道上的Ser631残基减缓了Rg3介导的IKur通道失活[22]。中药单体通过抑制钾离子通道抗心律失常作用见图1。

图1 中药单体通过抑制钾离子通道抗心律失常
2 抑制钠离子通道
电压门控型钠通道是心肌细胞膜上主要的离子通道,在心室肌细胞兴奋和传导过程中起着其他通道无法替代的作用[5]。电压门控钠通道家族有10种亚型(Nav1.1~Nav1.9、Nax),由11个基因(SCN1A~SCN11A)编码而成。当心脏0相上升触发初始动作电位时,钠通道迅速开放,细胞外大量Na+内流形成INa,随即迅速转变成失活状态,这种失活状态使心肌细胞无法立即触发下一个动作电位,直到通道逐渐恢复[23]。
甘草次酸是豆科植物甘草Fisch.中提取的生物碱,研究发现[24-25],甘草次酸可使大鼠心室肌细胞INa峰值明显下降,使INa的I/V曲线上移,但不改变钠通道的激活电位和峰电位。提示在不同膜电位水平,甘草次酸对INa均有抑制作用,这种抑制作用随着药物浓度的增加而增强。甘草次酸抗心律失常的可能作用机制是浓度相关性地抑制INa,从而减少心肌细胞除极时Na+内流,降低动作电位0位相最大上升速率和APA,减慢传导速度,抑制折返的逆行通路,同时抑制心肌细胞钠通道,降低细胞内Na+浓度。孟红旭等[26]通过人参皂苷Re对大鼠心室肌细胞钠、钾离子通道的影响发现,人参皂苷Re能够浓度相关性地抑制心肌细胞INa,表明人参皂苷Re抗心律失常的作用,可能与此相关。此研究首次发现人参皂苷Re抑制心肌细胞INa和内向整流的IK,可以推测人参皂苷Re抗心律失常的机制是通过INa和IK1,从而阻断钙离子超载的发生,保护心肌细胞缺氧[26]。研究表明,人参皂苷Rb1也能抑制心律失常,其主要机制为阻滞INa,降低APA和最大速率(max),从而达到抗心律失常作用[27]。苦豆子L.是一种多年生半灌木植物,属于豆科槐属,苦豆子性苦寒,具有清热解毒、祛风燥湿、消炎止痢、止痛等作用[28]。苦豆子的主要活性成分之一金雀花碱是一种喹诺里西啶类生物碱化合物,在近年来的研究中,金雀花碱在由乌头碱诱导的心律失常模型中显示出很高的抗心律失常活性,表明其具有一定的抗心律失常作用[29]。沙毛毛等[30]通过全细胞膜片钳记录和观察大鼠心室肌细胞在金雀花碱的作用下产生的变化发现,金雀花碱能浓度相关性地抑制INa,加快通道失活,延长通道恢复时间。根据实验结果推断金雀花碱可能通过阻滞INa,抑制迟后除极的0相除极过程,提高动作电位的阈值(action potential threshold,APT),从而降低心肌组织的异常自律性,达到抑制心律失常作用。中药单体通过抑制钠离子通道抗心律失常作用见图2。

图2 中药单体通过抑制钠离子通道抗心律失常
3 抑制钙离子通道
心肌细胞中最重要的钙离子通道的有L型和T型2种,二者同属于电压依赖型钙离子通道。L型钙离子通道分布于包括心室肌在内的所有心肌细胞中,并且是构成心室肌细胞动作电位平台期的基础,它对动作电位平台期的形成、细胞内钙离子的增多和肌肉收缩期起重要的作用,决定平台期的长短和APD;T型钙离子通道主要分布于传导和起搏细胞中,一般认为它在舒张期去极化和心脏起搏活动中发挥重要作用[31]。当L型钙通道增加,会使心肌细胞动作电位持续时间延长,从而造成异常的钙电流,影响心肌细胞的动作电位,继而引发心律失常[32]。除此之外钙离子超载还会影响房室结,导致心肌纤维化,造成传导异常。
研究发现,白花前胡Dunn的主要成分白花前胡甲素对增加冠脉流量具有积极作用[33]。通过白花前胡甲素对豚鼠心肌细胞电生理特性的影响研究发现,其抗心律失常机制与阻止钙离子内流相关,同时也和促进钾离子外流有关[34]。相关研究进一步证明了白花前胡甲素抗心律失常的作用机制可能是抑制钙离子内流且促进钾离子外流的结果[11]。三七总皂苷对抗心律失常有显著作用,是我国传统中药三七(Burk.) F. H. Chen的活性物质,具有化瘀止血、活血止痛等功能。有学者通过对大鼠心脏灌流,在心肌细胞灌流液中加入三七总皂苷后,使用膜片钳记录方法观察三七总皂苷对大鼠心肌细胞L-型钙电流(ICa-L)的影响,发现三七总皂苷可以剂量相关性地抑制ICa-L[11]。L型钙离子通道是心脏窦房结细胞0期除极钙内流的通道,也是心室肌细胞二期平台期的通道。由此可知三七总皂苷抑制钙电流,并且改善因钙超载而引发的心肌细胞凋亡,可以将其作为一种全新的心肌细胞钙通道阻滞剂,从而抑制心律失常[31,35]。小檗胺是存在于小檗属L.植物根块中提取的一种双苄基异喹啉类生物碱,有学者发现小檗胺对抑制心肌缺氧缺血、抑制心律失常都有一定作用[36]。研究证明,小檗胺可延长ERP,提高心肌舒张期兴奋阈值(diastolic excitation threshold,DET),使自律性降低,通过延长心肌ERP,从而达到抗心律失常的作用[37]。小檗胺抑制心律失常而没有减弱心肌收缩力的不良反应是其最大特点,其作用机制很可能是抑制钙离子、钠离子通道,阻断组胺受体及扩张冠状动脉。后来有学者在培养的家兔主动脉平滑肌的实验上进一步证实[38],小檗胺可以抑制心肌细胞的外钙内流,但是并不影响心肌细胞的内钙释放,证明小檗胺具有阻断电压依赖性钙离子通道和受体依赖型钙离子通道的作用。丹皮酚是牡丹根的主要活性成分[39]。有学者用丹皮酚对正常培养乳鼠心肌细胞的抗氧化作用发现,丹皮酚能够抑制乳鼠心肌细胞对钙离子的摄取,还能减慢心肌细胞的波动频率,作用机制类似于慢通道阻断剂,由此猜测丹皮酚抗心律失常作用可能与拮抗再灌注引起的细胞内钙超载有关[40]。研究证明,丹皮酚抗心律失常的机制可能是阻断豚鼠心肌细胞的钙通道,减少其钙离子内流,同时降低心肌兴奋性和0期除级幅度,缩短心室肌APD[41-42]。人参皂苷Re的抗心律失常作用也与钙有关。Cav1.2是心肌中L型钙离子通道的主要亚型,其与钙离子稳态密切相关[43]。人参皂苷Re抗心律失常的机制为抑制乌头碱引起的mRNA表达增加,降低细胞内钙离子浓度,减轻乌头碱引起的心肌毒性作用[44]。中药单体通过抑制钙离子通道抗心律失常作用见图3。
4 抑制钙/钙调素依赖性蛋白激酶II(calcium/ calmodulin-dependent protein kinase II,CaMKII)
CaMKII参与调节许多生物学过程,如钙离子稳态、膜兴奋性、细胞周期进程、蛋白质分泌、细胞骨架组织等。研究显示,心律失常的发生与交感神经兴奋密切相关,而交感神经兴奋能够通过CaMKII调节心肌细胞钙稳态,其可能为治疗心律失常的一种新方法[45-46]。
莲子心是睡莲科植物莲Gaertn.的成熟种子中间的绿色胚根,为《中国药典》2020年版收录的草药,其主要成分为异喹啉生物碱类,包括莲心碱、异莲心碱、甲基莲心碱等。研究发现莲子心对乌头碱引起的大鼠室性心律失常、哇巴因引起的豚鼠室性心律失常以及大鼠冠状动脉闭塞再灌注引起的心律失常都有较好的抑制作用[47]。研究表明莲心碱、异莲心碱和甲基莲心碱具有潜在的抗心律失常作用,因为细胞内钙超载可激活CaMKII,所以抑制CaMKII通路可能是减少钙超载引起的心肌功能障碍和心律失常的一个治疗靶点[48]。综上,莲子心抑制心律失常的完整分子机制是其使细胞内钙离子水平和钙调蛋白(calmodulin,CaM)表达减少,并通过与钙调蛋白结合抑制CaMKII的磷酸化,从而抑制细胞内Ca2+-CaM/CaMKII通路[49]。秋水仙L.是百合科秋水仙属植物,多年生草本球根花卉,其主要成分为秋水仙碱。研究证明秋水仙碱通过干扰胶原的积累减少间质性心肌纤维化,并逆转衰竭心脏的收缩功能紊乱[50]。研究发现,经秋水仙碱处理的小鼠心肌细胞APD更长,细胞内Ca2+瞬变和肌浆网Ca2+含量分别减少10%、47%[51]。秋水仙碱降低了ICa-L、反向模式钠钙交换电流、Ito和持续外向钾电流(sustained outward potassium current,IKsus),还可以下调Serca2a、肌浆网受磷蛋白(phospholamban,PLB)及其磷酸化水平的PLB-Thr17表达,所有这些变化都会导致SR-Ca2+含量和钙离子瞬变的降低,CaMKII是心肌细胞兴奋-收缩耦合的关键调节因子,所以秋水仙碱抗心律失常的机制推测为降低心肌细胞CaMKII的表达,减少钙离子内流及钙离子超载,从而减少心律失常的发生。人参皂苷Rg2对急性心源性休克有保护作用,具有抗休克、抗心衰、抗凝血、抗血栓作用。研究证明,预处理人参皂苷Rg2对氯化钙所致心律失常模型大鼠具有较强的抗心律失常作用,人参皂苷Rg2减少大鼠心律失常持续时间、显著降低大鼠死亡率和恶性心律失常发生率。其机制可能是通过抑制钙/钙调素依赖蛋白激酶2D(calcium/ calmodulin dependent protein kinase II-δ,CaMKII-δ)磷酸化从而抑制ICa-L,达到抗心律失常作用。同时证明,人参皂苷Rg2口服毒性较小,是一种具有开发前途的抗心律失常备选药物[52]。中药单体通过抑制CaMKII抗心律失常作用见图3。

图3 中药单体通过抑制钙离子通道和CaMKII抗心律失常
5 抑制超极化激活的阳离子通道
超极化激活的环核苷酸门控阳离子通道(hyperpolarization-activated cyclic nucleotide-gated cation channel,HCN),包括4种亚型(HCN1、HCN2、HCN3、HCN4)[53],其中HCN4是心脏中表达的主要亚型[54]。研究发现,银杏叶提取物能以浓度相关的方式不可逆地抑制HCN2和HCN4通道电流,并且对HCN4电流更敏感。此外,银杏叶提取物对HCN2和HCN4电流振幅的抑制伴随着活化和失活动力学的降低,这可能有助于心律失常的治疗[55]。
6 结语及展望
在我国中药已有上千年的应用历史,中药单体抑制心律失常作用显著(表1)。本文对近年来国内外许多专家学者对中药单体抑制心律失常作用进行了大量而深入的研究和探讨,总结后发现:(1)临床上用于心律失常的中药治疗大部分是复方中药,如参松养心胶囊、复脉颗粒、生脉注射液等[5],目前为止,中药单体抑制心律失常临床应用只有人参皂苷Rg3。多数中药单体抑制心律失常的研究都停留在动物实验和细胞实验阶段,研究较局限,产业化研究少,且人和实验动物之间存在着严格的种属差异,在人体上是否能得到实验动物上的实验结果,有待进一步深入探究,想在临床上运用,还需认真研究和谨慎实践。(2)中药单体抗心律失常的机制研究主要集中在调节或抑制多离子通道,包括钾离子通道、钙离子通道、钠离子通道,这与临床上目前使用的钠通道阻滞剂(奎尼丁、普鲁卡因胺、美西律)、钙离子通道阻滞剂(维拉帕米)、延长APD药物(胺碘酮)作用机制相似;氯离子通道主要包括囊性纤维变性跨膜电导调节体(cystic fibrosis transmembrane conductance regulator,CFTR)氯通道、钙激活氯通道、容积调节性氯通道及电压依赖性氯通道[56]。研究发现,CFTR是重要的氯离子通道,且在心肌缺血、心律失常等心肌疾病中发挥重要作用[57]。氯离子电流参与动作电位,其抗心律失常的机制为阻断可延长的APD,这可能成为新一代抗心律失常药物的突破口[58],但未见关于中药单体对氯离子通道作用的相关报道;β受体阻滞剂的中药单体研究未见报道。(3)中药单体在防治心律失常方面存在巨大潜力和广阔市场,但因其靶点多、盲点多、作用机制相对复杂,给研究带来一定困难,我国相关部门应统筹规划科研力量及目标,对具有抑制心律失常潜力的中药单体逐个击破。(4)人参有效成分抑制心律失常作用研究最多,机制也最为全面,是最有可能开发的具有我国自主知识产权的候选药物。
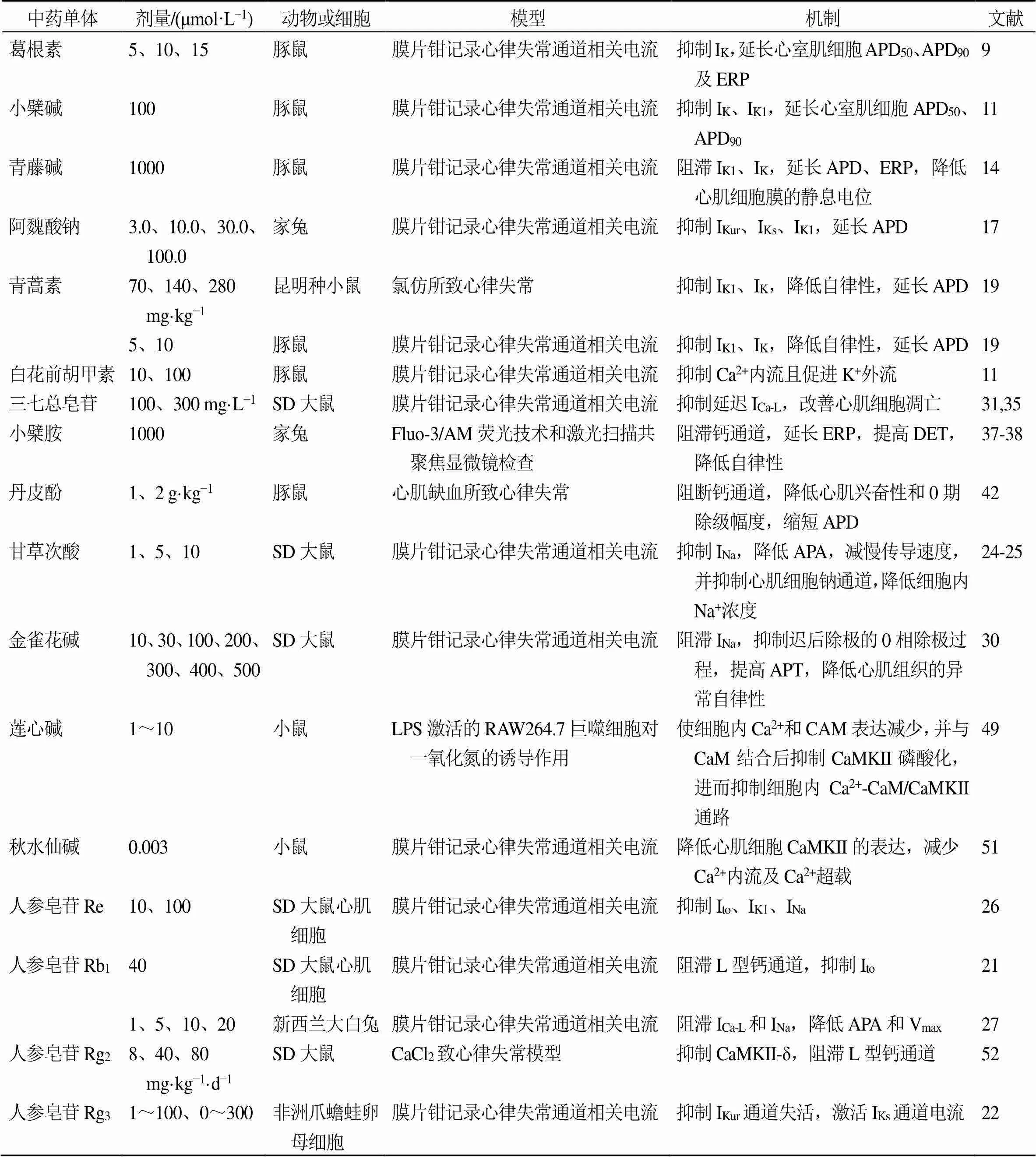
表1 中药单体的抗心律失常作用
综上所述,在抗心律失常方面中药单体低毒高效,优势非常明显,临床运用前景巨大,有望进一步发展。在新型冠状病毒肆虐之际,中药对COVID-19及其引起的心律失常能发挥一定治疗作用,对心血管系统有积极影响。如用于治疗和预防COVID-19的中药甘草,其有效成分甘草酸抗病毒的同时具有抑制心律失常作用,由于其对钾离子通道的强烈抑制,对心肌保护具有积极作用[59]。不能忽视的是,很多中药单体待研究,且机制及靶点复杂。随着我国制药水平不断提升及现代科技的运用,相信中医药治疗心律失常将走向国际,面向世界展示“中国智慧”提出的“中国方案”。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国心血管健康与疾病报告编写组. 《中国心血管健康与疾病报告2020》概述 [J]. 中国心血管病研究, 2021, 19(7): 582-590.
[2] Dhakal B P, Sweitzer N K, Indik J H,. SARS-CoV-2 infection and cardiovascular disease: COVID-19 heart [J]., 2020, 29(7): 973-987.
[3] Correa A, Rochlani Y, Aronow W S. Current pharmacotherapeutic strategies for cardiac arrhythmias in heart failure [J]., 2020, 21(3): 339-352.
[4] Sun Y Y, Liu Y, Chen K J. Roles and mechanisms of ginsenoside in cardiovascular diseases: Progress and perspectives [J]., 2016, 59(3): 292-298.
[5] 曹瑀莹, 李劭恒, 袁硕, 等. 人参抗心律失常作用机制的研究进展 [J]. 中草药, 2021, 52(10): 3157-3166.
[6] Ehrlich J R, Biliczki P, Hohnloser S H,. Atrial-selective approaches for the treatment of atrial fibrillation [J]., 2008, 51(8): 787-792.
[7] 刘功来, 杨威, 王云霞, 等. 葛根素对大鼠心肌缺血再灌注诱导心律失常的影响及作用机制 [J]. 基因组学与应用生物学, 2020, 39(7): 3350-3354.
[8] 伟唯, 江培. 葛根素药理作用研究进展 [J]. 黑龙江医药, 2014, 27(1): 51-55.
[9] 陈悦, 黄霞, 卫琮玲. 葛根素对豚鼠乳头肌动作电位及延迟整流钾电流的影响 [J]. 中国药学杂志, 2006, 41(10): 747-749.
[10] 刘永娟, 王素梅. 黄连素治疗缺血性心脏病心力衰竭的疗效观察 [J]. 中西医结合心脑血管病杂志, 2012, 10(5): 519-520.
[11] 李蕾, 孙美利, 张舒媛, 等. 抗心律失常中药活性成分研究进展 [J]. 世界中医药, 2014, 9(9): 1241-1242.
[12] Zhao X X, Peng C, Zhang H,.: A review of chemistry, pharmacology, pharmacokinetics, and clinical use [J]., 2012, 50(8): 1053-1061.
[13] Nishida S, Satoh H. Cardiovascular pharmacology of sinomenine: The mechanical and electropharmacological actions [J]., 2007, 2: 97-104.
[14] Satoh H. Electropharmacological actions of the constituents ofetand Mokuboi-to in Guinea pig heart [J]., 2005, 33(6): 967-979.
[15] Gao X, Liu K, Liu J P,. Effects of sodium ferulate on the ultrarapid delayed rectifier K+current in human atrial myocytes [J]., 2008, 22(1): 1-4.
[16] 周彤, 曾秋棠. 阿魏酸钠与胺碘酮对家兔心室肌细胞L型钙通道电流的影响 [J]. 中国心脏起搏与心电生理杂志, 2008, 22(6): 534-538.
[17] 周彤, 毛晓波, 毛奕, 等. 阿魏酸钠对家兔心室肌细胞钾通道电流的影响 [J]. 临床心血管病杂志, 2009, 25(8): 588-592.
[18] Gu Y W, Wang X, Wu G,. Artemisinin suppresses sympathetic hyperinnervation following myocardial infarction via anti-inflammatory effects [J]., 2012, 43(6): 737-743.
[19] 李宝馨, 杨宝峰, 李玉荣, 等. 青蒿素抗心律失常作用及机制 [J]. 中国药理学通报, 1999(5): 449-452.
[20] Qiao G F, Li S, Yang B F,. Inhibitory effects of artemisinin on voltage-gated ion channels in intact nodose ganglion neurones of adult rats [J]., 2007, 100(4): 217-224.
[21] 裴娟慧, 张银辉, 陈敬洲, 等. 人参皂苷Rb1对大鼠心室肌细胞L型钙电流和瞬时外向钾电流的调控作用 [J]. 中国分子心脏病学杂志, 2011, 11(4): 230-234.
[22] Choi S H, Shin T J, Hwang S H,. Ginsenoside Rg3decelerates hERG K+channel deactivation through Ser631 residue interaction [J]., 2011, 663(1/2/3): 59-67.
[23] Chen-Izu Y, Shaw R M, Pitt G S,. Na+channel function, regulation, structure, trafficking and sequestration [J]., 2015, 593(6): 1347-1360.
[24] 蒋淼, 刘德明, 陈薇, 等. 甘草次酸对乌头碱致大鼠心律失常的拮抗作用 [J]. 中药药理与临床, 2021, 37(4): 132-137.
[25] 杨继媛, 吴红金, 吴德琳. 甘草次酸对大鼠心室肌细胞钠离子通道电流的影响 [J]. 中国中西医结合杂志, 2012, 32(7): 944-947.
[26] 孟红旭, 姚明江, 刘建勋. 人参皂苷Re对大鼠心室肌细胞钠、钾离子通道的影响 [J]. 世界中医药, 2013, 8(10): 1147-1149.
[27] Liu Z P, Song L, Zhang P P,. Ginsenoside Rb1exerts antiarrhythmic effects by inhibiting INaand ICaLin rabbit ventricular myocytes [J]., 2019, 9(1): 20425.
[28] 郝伟亮, 孟根达来, 解红霞. 苦豆子的化学成分及药理作用研究进展 [J]. 中国药房, 2016, 27(13): 1848-1850.
[29] Tsypysheva I P, Koval’skaya A V, Khalilova I U,. New 12--β-hydroxyethylcytisine derivatives with potential antiarrhythmic activity [J]., 2014, 50(2): 333-336.
[30] 沙毛毛, 匡怡, 任静娜, 等. 金雀花碱对大鼠心室肌细胞钠通道的影响 [J]. 中国中西医结合杂志, 2019, 39(8): 978-982.
[31] 李冀, 隋姝婷, 王晓楠, 等. 中药对心肌细胞离子通道作用的研究与展望 [J]. 中医药信息, 2016, 33(4): 118-121.
[32] Qu Z L, Xie L H, Olcese R,. Early afterdepolarizations in cardiac myocytes: Beyond reduced repolarization reserve [J]., 2013, 99(1): 6-15.
[33] 刘小叶, 王国贤. 白花前胡丙素的心血管药理作用研究进展 [J]. 辽宁医学院学报, 2008, 29(6): 555-556.
[34] 代建宇, 王永霞. 中药单体抗心律失常研究现状和思考 [J]. 中国中药杂志, 2014, 39(8): 1544-1546.
[35] 蔡琳, 彭鹏. 三七药理作用的研究进展 [J]. 山东化工, 2021, 50(3): 70-71.
[36] 肖培根, 肖伟, 许利嘉, 等. 黄连及含小檗碱类生物碱的中草药 [J]. 中国现代中药, 2016, 18(11): 1381-1385.
[37] Dan Y, Liu Y Z, Peng Y,. New collection of crude drugs in2010 II. SanKezhen (spp.) [J]., 2011, 3(4): 268-284.
[38] Zhao Y L, Li X Y, Li B Y,. Effect of berbamine on calcium dynamics in cultured vascular smooth muscle cells [J]., 2000, 9 (3): 158-161.
[39] 梁肃敏, 崔肖华, 姚平安, 等. 丹皮酚对异丙肾上腺素致小鼠心肌肥厚的影响 [J]. 中成药, 2018, 40(2): 290-293.
[40] 王腾, 唐其柱, 江洪, 等. 丹皮酚对豚鼠心肌细胞动作电位及钙通道电流的影响 [J]. 武汉大学学报: 医学版, 2001(4): 331-333.
[41] Zhang G Q, Hao X M, Zhou P A,. Effect of paeonol on L-type calcium channel in rat ventricular myocytes [J]., 2003, 25(4): 281-285.
[42] 侯刚健, 苏琳. 丹皮酚对豚鼠急性心肌缺血所致心律失常的影响 [J]. 华北煤炭医学院学报, 2009, 11(2): 160-161.
[43] Zhang X Y, Ai X J, Nakayama H,. Persistent increases in Ca2+influx through Cav1.2 shortens action potential and causes Ca2+overload-induced afterdepolarizations and arrhythmias [J]., 2016, 111(1): 4.
[44] 刘岩, 赵世萍, 董晞, 等. 甘草苷及人参皂苷对乌头碱导致心肌细胞离子通道mRNA表达变化的影响 [J]. 中国中医基础医学杂志, 2008, 14(5): 359-361.
[45] Zhou M M, Liu Y, Xiong L,. Cardiac sympathetic afferent denervation protects against ventricular arrhythmias by modulating cardiac sympathetic nerve activity during acute myocardial infarction [J]., 2019, 25: 1984-1993.
[46] Beckendorf J, van den Hoogenhof M M G, Backs J. Physiological and unappreciated roles of CaMKII in the heart [J]., 2018, 113(4): 29.
[47] 王嘉陵, 农艺, 江明性. 莲心碱抗实验性心律失常作用的研究 [J]. 同济医科大学学报, 1992, 21(5): 317-319.
[48] Ma J H, Luo A T, Wu L,. Calmodulin kinase II and protein kinase C mediate the effect of increased intracellular calcium to augment late sodium current in rabbit ventricular myocytes [J]., 2012, 302(8): C1141-C1151.
[49] Meng X L, Chen M L, Chen C L,. Bisbenzylisoquinoline alkaloids of Lotus (Gaertn.) seed embryo inhibit lipopolysaccharide-induced macrophage activation via suppression of Ca2+-CaM/CaMKII pathway [J]., 2019, 30(1): 878-896.
[50] Fernandes F, Ramires F J, Ianni B M,. Effect of colchicine on myocardial injury induced byin experimental Chagas disease [J]., 2012, 18(8): 654-659.
[51] Lu Y Y, Chen Y C, Kao Y H,. Colchicine modulates calcium homeostasis and electrical property of HL-1 cells [J]., 2016, 20(6): 1182-1190.
[52] Gou D X, Pei X J, Wang J,. Antiarrhythmic effects of ginsenoside Rg2on calcium chloride-induced arrhythmias without oral toxicity [J]., 2020, 44(5): 717-724.
[53] 王红蕊, 崔冰, 周建业, 等. 心律失常中HCN4突变与功能改变和表型的相关研究 [J]. 中国分子心脏病学杂志, 2019, 19(4): 3015-3019.
[54] Chandler N J, Greener I D, Tellez J O,. Molecular architecture of the human sinus node: Insights into the function of the cardiac pacemaker [J]., 2009, 119(12): 1562-1575.
[55] Chen H, Chen Y J, Yang J,. Effect ofextract on pacemaker channels encoded by HCN gene [J]., 2021, 46(3): 255-261.
[56] 郭欢, 周光春, 王竞涛, 等. 心肌细胞钠、氯离子通道与室性心律失常的关系研究进展 [J]. 检验医学与临床, 2016, 13(5): 696-698.
[57] 朱耀斌, 张雅娉, 李志强, 等. 囊性纤维化跨膜传导调节因子氯离子通道在心脏疾病中作用研究进展 [J]. 中华实用诊断与治疗杂志, 2019, 33(12): 1242-1245.
[58] 杨磊, 王晓明. 容积敏感性外向整流氯离子通道的调节机制及药理学探讨 [J]. 中国药业, 2014, 23(3): 1-3.
[59] Akalın E, Ekici M, Alan Z,. Traditional Chinese medicine practices used in COVID-19 (SARS-CoV-2/Coronavirus-19) treatment in clinic and their effects on the cardiovascular system [J]., 2020, 48(4): 410-424.
Research progress on ion channel mechanism of traditional Chinese medicine monomers inhibiting arrhythmia
PANG Shun-yu1, 2, ZHANG Ya-qi1, 2, LUO Jia-xin1, 2, TANG Min-li1, 2, LI Qing-ling1, 2, CHEN Ying-qing1, 2, LIU Li-ping1, 2
1. Dalian Key Laboratory of Chronic Disease Research Center, Dalian University, Dalian 116622, China 2. Liaoning Key Laboratory of Engineering Technology Research Center for the Utilization of Functional Components of Organic Natural Products, Dalian University, Dalian 116622, China
There are many natural monomers with significant pharmacological activities in medicinal plants, which have unique advantages in inhibiting arrhythmia. In recent years, many scholars have carried out a large number of basic studies on antiarrhythmic effects of traditional Chinese medicine monomers from different angles. After deeply summarizing its mechanism, it was found that the inhibition of arrhythmia by traditional Chinese medicine monomers mainly focuses on inhibition of potassium ion, sodium ion, calcium ion channel. Research progress on ion channel mechanism of traditional Chinese medicine monomers inhibiting arrhythmia is reviewed in this paper, in order to provide ideas for basic research of traditional Chinese medicine monomers for regulating arrhythmia, and provide a theoretical basis for research and development of innovative drugs based on active components of traditional Chinese medicine.
traditional Chinese medicine monomer; arrhythmia; ion channel mechanism; potassium ion; sodium ion; calcium ion; puerarin; ferulic acid; artemisinin; glycyrrhetinic acid; ginsenoside Re; praeruptorin A; paeonol
R282.710.5
A
0253 - 2670(2022)15 - 4853 - 09
10.7501/j.issn.0253-2670.2022.15.029
2022-03-23
国家自然科学基金面上项目(82000074);辽宁省教育厅科学研究经费项目(jyt-dldxjc202005);大连市青年科技之星基金项目(2020RQ080);大学生创新创业训练计划项目(S202111258034)
庞舜予(2000—),男,在读本科。E-mail: 947665825@qq.com
通信作者:刘丽萍(1974—),女,副教授,硕士生导师,从事心血管疾病靶向治疗及药物筛选研究。Tel: (0411)87402103 E-mail: liuliping@dlu.edu.cn
陈颖卿(1986—),男,硕士生导师,讲师,从事纤维化疾病机制及其药物筛选研究。Tel: (0411)87403861 E-mail: chenyq1211@163.com
[责任编辑 崔艳丽]