冬凌草甲素通过内质网应激诱导胰腺癌细胞凋亡的研究
刘殿雷,龙景培,卜贺启,林胜璋
冬凌草甲素通过内质网应激诱导胰腺癌细胞凋亡的研究
刘殿雷1,龙景培1,卜贺启2,林胜璋3*
1. 浙江大学医学院附属妇产科医院 外科,浙江 杭州 310002 2. 浙江省立同德医院肛肠科,浙江 杭州 310011 3. 浙大城市学院临床医学系,浙江 杭州 310012
探讨冬凌草甲素通过内质网应激诱导胰腺癌细胞凋亡的机制。选取胰腺癌SW1990和Panc-1细胞株作为研究对象。采用细胞计数试剂-8(cell counting kit-8,CCK-8)和流式细胞术分别检测细胞增殖和凋亡情况,蛋白印迹法检测内质网应激相关因子葡萄糖调节蛋白78(glucose regulated protein 78 kD,GRP78)、环磷酸腺苷反应元件结合转录因子同源蛋白(C/EBP-homologous protein,CHOP)、裂解的天冬氨酸特异性半胱氨酸蛋白水解酶-12(cleaved cystein aspartate specific proteinase-12,cleaved Caspase-12)、活化的(active)Caspase-3、cleaved Caspase-3、cleaved多腺苷二磷酸多聚酶[poly (ADP-ribose) polymerase,PARP] 的蛋白表达水平,实时荧光定量RCR检测、、的mRNA表达水平。冬凌草甲素浓度和时间相关性抑制SW1990和Panc-1细胞增殖,冬凌草甲素可诱导SW1990和Panc-1细胞凋亡,可增加SW1990细胞中cleaved Caspase-3和cleaved PARP的蛋白表达水平(<0.05);进一步研究发现冬凌草甲素能上调、、mRNA及GRP78、CHOP、cleaved Caspase-12的蛋白表达水平,与对照组相比差异均有统计学意义(<0.05)。且在内质网应激抑制剂4-PBA的作用下,冬凌草甲素处理后细胞凋亡率和GRP78、CHOP、cleaved Caspase-12、active Caspase-3蛋白表达水平均被逆转,差异有统计学意义(<0.05)。冬凌草素对SW1990和Panc-1细胞的促凋亡作用依赖于内质网应激的激活,冬凌草甲素可通过激活内质网应激介导胰腺癌细胞凋亡,为冬凌草甲素治疗胰腺癌中的抗肿瘤活性研究提供了新的思路。
冬凌草甲素;胰腺癌;内质网应激;凋亡;葡萄糖调节蛋白78;环磷酸腺苷反应元件结合转录因子同源蛋白;天冬氨酸特异性半胱氨酸蛋白水解酶-12
胰腺癌被认为是消化道最常见恶性肿瘤之一,预后非常差,根据美国癌症协会的最新估计死亡数据,胰腺癌排在肺癌和结肠直肠癌之后,位列第3[1]。胰腺癌被确诊时通常已是晚期,患者错过了接受手术的机会。目前,化疗仍是治疗晚期胰腺癌的主要方法之一,而化疗药物长期使用通常又会产生耐药性和副作用。尽管进行了大量的实验,但胰腺癌的治疗进展甚微。5年生存率仍然低于10%[2]。这些问题凸显了开发新型抗癌药物的迫切要求。
冬凌草甲素是从冬凌草中分离得到的一种具有生物活性的二萜类化合物。已被证实具有抗癌等多种药理作用[3]。在国内冬凌草甲素因其低毒性已被用于多种癌症的治疗。且越来越多的证据表明冬凌草甲素对胰腺癌、肺癌、结直肠癌等不同类型的肿瘤细胞具有显著的抑制活性[4]。在胰腺癌细胞中,研究发现冬凌草甲素主要通过诱导细胞凋亡和抑制细胞转移来实现抗癌活性[5-7]。目前有报道称内质网应激与细胞凋亡密切相关,一些抗肿瘤药物利用内质网应激诱导胰腺癌细胞凋亡[8],这可能为胰腺癌的治疗干预提供新的思路。
本研究探讨冬凌草甲素通过内质网应激途径抗胰腺癌的作用机制,为冬凌草甲素开发为有前景的抗癌药物提供理论基础和实验依据。
1 材料与仪器
1.1 细胞
胰腺癌SW1990和Panc-1细胞株购自上海ATCC细胞库。
1.2 药品和试剂
冬凌草甲素(质量分数99%,批号2020052103)购自上海酶联生物科技公司,溶解于0.5%二甲亚砜(dimethyl sulfoxide,DMSO)中,浓度为10 mmol/L,根据实验的需要,原液用工作浓度的培养基进行稀释。含有青霉素/链霉素的RPMI-1640培养基(批号8121112)、10%胎牛血清(fetal bovine serum,FBS,批号2158138P)、0.25%胰蛋白酶(批号1234567)和DMSO(批号3131642)均购自Gibco公司;CCK-8试剂盒(批号KN658)购自日本同化公司;Annexin V-FITC/PI凋亡检测试剂盒(批号20200502)、BCA蛋白检测试剂盒(批号20200712)均购自北京索莱宝有限公司。小鼠抗磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase,GAPDH,批号210120)、葡萄糖调节蛋白78(glucose regulated protein 78 kD,GRP78,批号200912)、环磷酸腺苷反应元件结合转录因子同源蛋白(C/EBP-homologous protein,CHOP,批号200910)、裂解的多腺苷二磷酸多聚酶[cleaved poly (ADP-ribose) polymerase,cleaved PARP,批号200324]、裂解的天冬氨酸特异性半胱氨酸蛋白水解酶-12(cleaved cystein aspartate specific proteinase-12,cleaved Caspase-12,批号201116)和活化的(active)Caspase-3(批号210319)均购买自美国Sigma公司;4-苯基丁酸(4-phenylbutyric acid,4-PBA,批号 B71530)购自上海源叶科技有限公司;辣根过氧化物酶偶连二抗(horseradish peroxidase,HRP,批号176808)购自北京中西华大科技有限公司。
1.3 仪器
SCO10-2型C02细胞培养箱(美国SHELLAB公司);ST16R型离心机、ABI quantstudio5型实时荧光定量PCR仪(美国Thermo Scientific公司);FACSAria II型流式细胞仪(美国BD Biosciences公司);SpectraMax i3x型多功能酶标仪(美国Molecular Devices公司);PowerPac HC电泳仪(美国BIO-RAD公司)。
2 方法
2.1 细胞培养
细胞复苏后培养于含有10%胎牛血清的RPMI-1640培养液中,并置于37 ℃、5% CO2和95% O2的湿化环境中无菌培养。培养3 d后胰蛋白酶进行消化传代,待细胞铺满细胞瓶底部时进行实验。
2.2 CCK-8法检测细胞活力
取对数生长期的SW1990和Panc-1细胞接种至96孔培养板(5×103/孔)进行培养,待细胞贴壁后,更换含有不同终浓度(5、10、20、40、80 μmol/L)冬凌草甲素的新鲜培养液分别培养24、48、72 h。每个浓度组设6个复孔,同时设空白组(加入等量的培养液)和对照组(加入等量含0.1% DMSO的培养液)。给药结束前1 h加入10 μL CCK-8工作液,37 ℃孵育1 h。采用自动酶标仪测定450 nm波长处各孔的吸光度()。计算细胞增殖抑制率。
细胞增殖抑制率=1-(实验-空白)/(对照-空白)
2.3 Annexin V-FITC/PI检测细胞凋亡
将配制好的SW1990和Panc-1细胞悬液接种到6孔培养板中(5×105/孔)过夜培养,然后加入不同浓度(10、20、40 μmol/L)冬凌草甲素处理细胞后培养48 h,同时设对照组(加入等量含0.1% DMSO的培养液);收集细胞,1500×离心5 min,弃上清,PBS重悬细胞。取5×105个细胞悬液,1500×离心5 min,弃上清,加入500 μL结合缓冲液悬浮细胞。然后加入5 μL Annexin V-FITC和10 μL PI,轻轻混匀,在常温避光下培养30 min。采用流式细胞仪进行分析。
2.4 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)检测细胞GRP78、CHOP、Caspase-12 mRNA表达
不同浓度(10、20、40 μmol/L)冬凌草甲素处理SW1990和Panc-1细胞48 h后,同时设对照组(加入等量含0.1% DMSO的培养液);收集细胞,每组加入1 mL TRIzol试剂,然后再加入200 μL氯仿,室温孵育15 min。4 ℃、12 000×离心10 min。取上清至另一无RNA管中,加入等量的异丙醇。将样品轻轻倒置后,在−20 ℃冷冻30 min,12 000×离心10 min。随后,用75%乙醇预冷洗涤2次,加入适量的焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)无菌无酶水,将总RNA溶解至500 ng/μL,进行反转录RT-qPCR。采用2−∆∆Ct法计算基因表达情况。引物序列见表1。

表1 引物序列和产物长度
2.5 蛋白印迹法检测细胞GRP78、CHOP、cleaved Caspase-12、cleaved Caspase-3、cleaved PARP蛋白表达
将SW1990和Panc-1细胞接种于6孔培养板,分别用实验所需不同浓度(10、20、40 μmol/L)的冬凌草甲素处理,同时设对照组(加入等量含0.1% DMSO的培养液);然后置于无菌培养箱中培养48 h。收集处理后的细胞,然后用冰PBS洗涤细胞2次,并在冰RIPA缓冲液中轻轻裂解、匀浆30 min。然后4 ℃、12 000×离心15 min。采用BCA法检测上清液中蛋白的浓度。处理后的样品用12% SDS-PAGE分离。不同目的片段通过电泳转移至PVDF膜上,室温下5%脱脂牛奶阻断TBST中的非特异性结合位点2 h,膜洗涤后与适当浓度的一抗4 ℃下在封闭缓冲液中孵育过夜。TBST洗涤3次(每次5 min),室温下用辣根过氧化物酶偶联二抗孵育1 h。再用TBST冲洗膜后,采用ECL化学发光检测系统检测膜上的条带,Image J软件进行密度测定。
2.6 内质网抑制剂4-PBA对冬凌草甲素诱导SW1990细胞凋亡和调控active Caspase-3、GRP78、CHOP、cleaved Caspase-12蛋白表达的影响
将SW1990细胞接种于6孔培养板,分别用35 μmol/L的冬凌草甲素、35 μmol/L的冬凌草甲素+1 mmol/L 4-PBA、1 mmol/L 4-PBA处理细胞,对照组加入等量0.1% DMSO的培养液处理,置于恒温无菌培养箱培养48 h,按照“2.3”项方法检测细胞凋亡情况,按“2.5”项方法检测蛋白表达量。
2.7 数据统计分析
3 结果
3.1 冬凌草甲素对SW1990和Panc-1细胞活力的影响
不同浓度的冬凌草甲素分别处理细胞24、48、72 h,CCK-8法评估细胞活力情况。如图1所示,结果表明冬凌草甲素能显著降低SW1990和Panc-1细胞活力,且呈时间和剂量相关性。另外,SW1990细胞对冬凌草甲素较为敏感。
3.2 冬凌草甲素对SW1990和Panc-1细胞凋亡的影响
为了确定冬凌草甲素是否具有促胰腺癌细胞凋亡的作用,Annexin-V和PI双染色后用流式细胞仪检测。如图2-A、B所示,与对照组相比,不同浓度冬凌草甲素(10、20、40 μmol/L)处理后的SW1990和Panc-1细胞凋亡率显著增加(<0.05),且呈浓度相关性,其中SW1990细胞的凋亡较为显著。为进一步探讨冬凌草素诱导细胞凋亡的机制,采用蛋白印迹检测了SW1990细胞中cleaved Caspase-3和cleaved PARP的表达。结果(图3)表明,冬凌草甲素可增加SW1990细胞中Caspase-3和PARP的分裂亚基水平(<0.05),且呈剂量相关性。
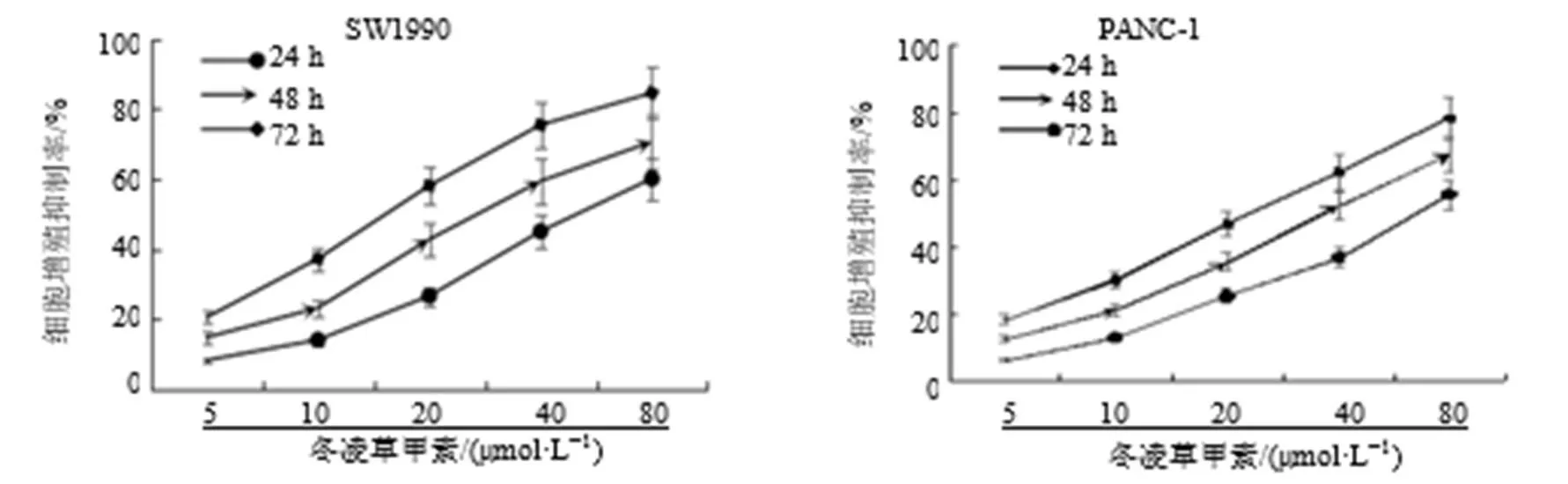
图1 冬凌草甲素对SW1990和Panc-1细胞增殖的影响()

与对照组比较:*P<0.05
3.3 冬凌草甲素对SW1990和Panc-1细胞GRP78、CHOP、Caspase-12 mRNA表达的影响
内质网应激是化疗药物诱导癌细胞凋亡的常见途径,能激活细胞凋亡通路,导致细胞凋亡[9]。为了明确冬凌草甲素是否激活了胰腺癌细胞中的内质网应激,本研究首先分析了在冬凌草甲素作用下细胞中内质网应激关键标志物、和基因表达情况。结果(图4)显示,冬凌草甲素能增加SW1990和Panc-1细胞、和mRNA表达水平(<0.05),且随着冬凌草甲素浓度的增加,效果越显著。
3.4 冬凌草甲素对SW1990和Panc-1细胞GRP78、CHOP、cleaved Caspase-12蛋白表达的影响
研究表明GRP78、CHOP、Caspase-12等在内质网应激发生过程中起着关键的调控作用[10]。为了确认冬凌草甲素能激活胰腺癌细胞中的内质网应激,本研究又分析了在冬凌草甲素作用下细胞中GRP78、CHOP、cleaved Caspase-12蛋白的表达情况。蛋白印迹结果(图5)显示,与对照组相比,冬凌草甲素不同浓度组GRP78、CHOP、cleaved Caspase-12蛋白的表达量明显升高(<0.05),且呈剂量相关性。

与对照组比较:*P<0.05

与对照组比较:*P<0.05

与对照组比较:*P<0.05
3.5 内质网抑制剂4-PBA对冬凌草甲素处理的SW1990细胞凋亡率和active Caspase-3、GRP78、CHOP、cleaved Caspase-12蛋白表达的影响
为了进一步明确冬凌草甲素诱导的细胞凋亡是否通过内质网应激相关的凋亡通路。本研究采用内质网应激抑制剂4-PBA进行实验。流式细胞分析(图6-A、B)及蛋白印迹分析(图6-C)结果显示,与冬凌草甲素单独处理相比,冬凌草甲素+4-PBA组SW1990细胞的凋亡率显著减少(<0.05),active Caspase-3、GRP78、CHOP、cleaved Caspase-12蛋白表达量也相应降低(<0.05)。
4 讨论
与传统的化疗药物相比,天然产物可以发挥强大的抗肿瘤作用而不会产生许多不良反应。因此,一些天然来源的活性化合物的抗肿瘤活性得到了研究,而冬凌草甲素作为冬凌草的主要成分,是一种具有生物活性的天然萜类化合物,在中药中起到了广泛的作用。冬凌草甲素以多靶点的抗肿瘤活性而闻名,抗肿瘤作用机制主要包括阻滞细胞周期、诱导细胞凋亡和自噬、抑制肿瘤侵袭和转移、抑制血管生成等[11]。研究已证实其对20多种人类肿瘤细胞株的增殖具有显著的抑制作用,如常见肺癌、食管癌、胰腺癌、肝癌、乳腺癌、卵巢癌、骨髓瘤、大肠癌、前列腺癌等,这与其特定的分子结构有关[12]。其D环上的α-亚甲基环戊酮(烯酮)是抗肿瘤活性的基本结构,可被环分裂或亚甲基饱和破坏;6-羟基和15-羰基之间的氢键增加了C的亲电性,进一步提高了肿瘤细胞对亲电酶的亲和力;14-羟基的酯化可增强抗癌活性。尽管冬凌草甲素的药理作用广泛,但由于其疏水性,其应用受到限制[12]。
研究已证实冬凌草甲素可通过不同的信号通路诱导胰腺癌细胞的凋亡,然而,内质网应激是否参与了冬凌草甲素诱导胰腺癌细胞的凋亡尚不清楚。本研究旨在探索冬凌草甲素对胰腺癌SW1990和Panc-1细胞的抑制作用,并探讨内质网应激与细胞凋亡的关系。结果显示,冬凌草甲素可诱导胰腺癌SW1990和Panc-1细胞凋亡,抑制细胞增殖。进一步研究发现冬凌草甲素可通过增加内质网应激相关蛋白GRP78、CHOP和cleaved Caspase-12的表达激活内质网应激。

与冬凌草甲素组比较:*P<0.05
内质网是调节应激反应最重要的细胞器之一,是细胞中参与蛋白质合成、折叠、转运和胞内钙储存的主要位点[13]。生理和病理刺激可引起钙稳态扰动,改变蛋白质折叠,增加内质网中错误折叠蛋白质的数量,导致内质网应激[14]。当内质网被触发,应激信号通过内质网膜传递到细胞核,进而产生一系列维持细胞动态平衡的信号通路分子,称为未折叠蛋白反应(unfolded protein response,UPR),其对细胞具有双重作用,促进体内平衡或刺激细胞凋亡[15]。内质网应激途径被认为是不同于线粒体途径和受体途径的一种新的凋亡途径,可被3个信号通路激活,即蛋白激酶R样内质网激酶(proteinkinase R like ER kinase,PERK)通路、内质网应激蛋白(inositol-requiring enzyme 1,IRE1)通路和活化转录因子6(activating transcription factor 6,ATF6)通路[16]。在正常状态下,它们与GRP78相互作用形成复合物在生理条件下处于不活跃状态,当内质网应激发生时,GRP78与PERK、IRE1和ATF6分离,PERK和IRE1通过自身磷酸化被激活,UPR被启动并调控下游转录因子,从而激活内质网应激诱导的细胞凋亡[17-18]。CHOP被认为是内质网应激下游最重要的促凋亡转录因子,可被内质网中的3个传感器激活,其在正常细胞中主要在转录水平上调控,当内质网应激诱导细胞凋亡时,CHOP表达及其在细胞核内的积累增加,然后通过控制其下游蛋白的表达来调节细胞的死亡[19-21]。Caspase-12是一种内质网原位半胱天冬酶,也是内质网应激诱导凋亡的关键调节因子,在内质网应激过程中特异性地被剪切和激活,而不是通过线粒体介导的凋亡信号;当过量的内质网应激被触发时,Caspase-12从内质网激活到细胞质,然后激活Caspase-3,最终触发内质网应激介导的细胞凋亡[22]。因此,GRP78、CHOP和Caspase-12通常被用作响应内质网应激水平的生物标志物。研究已证实内质网应激在胰腺癌细胞的促凋亡中起了重要作用[8]。本研究与之前的报道一致,冬凌草甲素显著增加了GRP78、CHOP和cleaved Caspase-12表达水平。而内质网应激特异性抑制剂4-PBA预处理后,细胞凋亡率及相关蛋白GRP78、CHOP、cleaved Caspase-12的表达水平均相应降低。提示冬凌草甲素可诱导胰腺癌细胞的内质网应激发生,进而激发细胞凋亡,抑制细胞的生长。
综上所述,本研究发现冬凌草甲素可通过激活内质网应激诱导胰腺癌细胞凋亡。研究结果为胰腺癌的预防提供了新的治疗方法,内质网应激可能成为预防和治疗癌症的潜在治疗靶点。
利益冲突 所有作者均声明不存在利益冲突
[1] Siegel R L, Miller K D, Jemal A. Cancer statistics, 2020 [J]., 2020, 70(1): 7-30.
[2] Mizrahi J D, Surana R, Valle J W,. Pancreatic cancer [J]., 2020, 395(10242): 2008-2020.
[3] Xu J M, Wold E A, Ding Y,. Therapeutic potential of oridonin and its analogs: From anticancer and antiinflammation to neuroprotection [J]., 2018, 23(2): E474.
[4] Luo H, Vong C T, Chen H B,. Naturally occurring anti-cancer compounds: Shining from Chinese herbal medicine [J]., 2019, 14: 48.
[5] Lou S M, Xu J, Wang B L,. Downregulation of lncRNA AFAP1-AS1 by oridonin inhibits the epithelial-to-mesenchymal transition and proliferation of pancreatic cancer cells [J]., 2019, 51(8): 814-825.
[6] Wang B L, Shen C, Li Y,. Oridonin overcomes the gemcitabine resistant PANC-1/Gem cells by regulating GST pi and LRP/1 ERK/JNK signalling [J]., 2019, 12: 5751-5765.
[7] Liu Q Q, Chen K, Ye Q,. Oridonin inhibits pancreatic cancer cell migration and epithelial-mesenchymal transition by suppressing Wnt/β-catenin signaling pathway [J]., 2016, 16: 57.
[8] Yang L G, Zhou X S, Sun J R,. Reactive oxygen species mediate anlotinib-induced apoptosis via activation of endoplasmicstress in pancreatic cancer [J]., 2020, 11(9): 766.
[9] Li J J, Zhang Y, Liu K C,. Xiaoaiping induces developmental toxicity in zebrafish embryos through activation of ER stress, apoptosis and the Wnt pathway [J]., 2018, 9: 1250.
[10] Avril T, Vauléon E, Chevet E. Endoplasmic reticulum stress signaling and chemotherapy resistance in solid cancers [J]., 2017, 6(8): e373.
[11] He H B, Jiang H, Chen Y,. Oridonin is a covalent NLRP3 inhibitor with strong anti-inflammasome activity [J]., 2018, 9(1): 2550.
[12] Zhang Y Y, Wang S H, Dai M M,. Solubility and bioavailability enhancement of oridonin: A review [J]., 2020, 25(2): 332.
[13] Wang M, Kaufman R J. Protein misfolding in the endoplasmic reticulum as a conduit to human disease [J]., 2016, 529(7586): 326-335.
[14] Wu J S, Li W M, Chen Y N,. Endoplasmic reticulum stress is activated in acute pancreatitis [J]., 2016, 17(5): 295-303.
[15] Hetz C, Papa F R. The unfolded protein response and cell fate control [J]., 2018, 69(2): 169-181.
[16] Li Y X, Li G Q, Suo L Y,. Recent advances in studies of molecular hydrogen in the treatment of pancreatitis [J]., 2021, 264: 118641.
[17] Qi Z H, Chen L X. Endoplasmic reticulum stress and autophagy [J]., 2019, 1206: 167-177.
[18] Wang C J, Fan X J. Exercise protects against diabetic cardiomyopathy by the inhibition of the endoplasmic reticulum stress pathway in rats [J]., 2019, 234(2): 1682-1688.
[19] Corazzari M, Gagliardi M, Fimia G M,. Endoplasmic reticulum stress, unfolded protein response, and cancer cell fate [J]., 2017, 7: 78.
[20] Labi V, Erlacher M. How cell death shapes cancer [J]., 2015, 6: e1675.
[21] Li Y M, Guo Y S, Tang J,. New insights into the roles of CHOP-induced apoptosis in ER stress [J]., 2015, 47(2): 146-147.
[22] Zhang R, Hao J, Wu Q,. Dehydrocostus lactone inhibits cell proliferation and induces apoptosis by PI3K/Akt/Bad and ERS signalling pathway in human laryngeal carcinoma [J]., 2020, 24(11): 6028-6042.
Study on apoptosis of pancreatic cancer cells induced by oridonin through endoplasmic reticulum stress
LIU Dian-lei1, LONG Jing-pei1, BU He-qi2, LIN Sheng-zhang3
1. Department of Surgery, Women’s Hospital School of Medicine Zhejiang Univercity, Hangzhou 310002, China 2. Department of Coloproctology Surgery, Tongde Hospital of Zhejiang Province, Hangzhou 310011, China 3. Department of Clinical Medicine, Zhejiang University City College, Hangzhou 310012, China
To investigate the mechanism of oridonin inducing apoptosis of pancreatic cancer cells through endoplasmic reticulum stress.Pancreatic cancer SW1990 and Panc-1 cell line were selected as the research object. Cell proliferation and apoptosis were detected by cell counting kit-8 (CCK-8) and flow cytometry respectively. The protein expression levels of endoplasmic reticulum stress-related factors glucose regulated protein 78 kD (GRP78), C/EBP-homologous protein (CHOP), cleaved cystein aspartate specific proteinase-12 (Caspase-12), active Caspase-3, cleaved Caspase-3, and cleaved poly (ADP-ribose) polymerase (PARP) were analyzed by Western blotting. The mRNA expression levels of,andwere detected by RT-qPCR.The proliferation of SW1990 and PANG-1 cells was inhibited by oridonin concentration and time correlation. The apoptosis of SW1990 and Panc-1 cells was induced and protein expression levels of cleaved caspase-3 and cleaved PARP in SW1990 cells increased by oridonin (< 0.05). Further studies showed that oridonin up-regulated mRNA expression levels of,and, as well as protein expression levels of GRP78, CHOP and cleaved Caspase-12, compared with the control group, the difference was statistically significant (< 0.05). And under the action of endoplasmic reticulum stress inhibitor 4-PBA, apoptosis rate and protein expression levels of GRP78, CHOP, cleaved Caspase-12 and active Caspase-3 were all reversed after treatment with oridonin, the difference was statistically significant (< 0.05).The pro-apoptotic effects of oridonin on SW1990 and Panc-1 cells are dependent on the activation of endoplasmic reticulum stress. Oridonin can mediate the apoptosis of pancreatic cancer cells by activating endoplasmic reticulum stress, which provides a new idea for the anti-tumor activity of oridonin in pancreatic cancer.
oridonin; pancreatic cancer; endoplasmic reticulum stress; apoptosis; glucose regulated protein 78 kD (GRP78); C/EBP-homologous protein (CHOP); cystein aspartate specific proteinase-12 (Caspase-12)
R285
A
0253 - 2670(2022)15 - 4773 - 08
10.7501/j.issn.0253-2670.2022.15.021
2022-02-09
浙江省基础公益研究计划项目(LGD19H160006);浙江省医药卫生科技计划项目(2018KY614)
刘殿雷,男,硕士研究生,主治医师,研究方向为中药单体抗肿瘤的分子机制。E-mail: ldl0304@163.com
通信作者:林胜璋,男,博士研究生,主任医师,研究方向为中药单体抗肿瘤的分子机制。E-mail: wzf2lsz@163.com
[责任编辑 潘明佳]