基于代谢组学的速效救心丸抗心肌缺血作用机制研究
贾志鑫,潘明霞,刘力榕,朱美霞,方 聪,于智颖,刘 洁,李月婷2, ,肖红斌*
基于代谢组学的速效救心丸抗心肌缺血作用机制研究
贾志鑫1, 2,潘明霞3,刘力榕3,朱美霞3,方 聪3,于智颖3,刘 洁1, 2,李月婷2, 3,肖红斌1, 2*
1. 北京中医药大学,北京中医药研究院,北京 100029 2. 北京中医药大学 中药分析与转化研究中心,北京 100029 3. 北京中医药大学中药学院,北京 100029
研究速效救心丸对心肌缺血大鼠的保护作用及对血浆代谢物的影响,初步探讨其干预心肌缺血的代谢途径和可能机制。采用垂体后叶素建立大鼠心肌缺血模型,通过病理组织切片和肌酸激酶(creatine kinase,CK)、丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、羟丁酸脱氢酶(hydroxybutyrate dehydrogenase,HBDH)、乳酸脱氢酶(lactate dehydrogenase,LDH)和超氧化物歧化酶(superoxide dismutase,SOD)生化指标评估速效救心丸对心肌缺血大鼠的保护作用;采用超高效液相色谱-四级杆飞行时间质谱联用(UHPLC-QTOF/MS)技术对血浆进行代谢组学研究,筛选潜在生物标志物并富集代谢通路。速效救心丸可明显改善心肌缺血大鼠心脏组织病理变化;显著降低血浆CK、AST、HBDH、LDH活性(<0.05、0.01),升高SOD活性(<0.05、0.01)。代谢组学分析共筛选到39个潜在生物标志物,涉及丙氨酸、天冬氨酸和谷氨酸代谢、三羧酸循环、谷氨酰胺和谷氨酸代谢等7条通路。速效救心丸能够有效改善模型大鼠的心肌缺血损伤,可能通过影响能量代谢及鞘脂代谢等相关通路发挥作用。
速效救心丸;心肌缺血;代谢组学;潜在生物标志物;能量代谢;鞘脂代谢;丙氨酸、天冬氨酸和谷氨酸代谢;三羧酸循环
心肌缺血是冠状动脉粥样硬化性心脏病(冠心病)的主要表现[1]。我国居民由冠心病引起的死亡占疾病死亡构成的40%以上,严重危害生命安全[2];急性或持续心肌缺血可引起急性心肌梗死,并发心律失常、休克或心力衰竭,危害人类健康[3]。因此,抗心肌缺血药物的作用机制研究是备受关注的关键科学问题。
速效救心丸是由川芎和冰片等制成的滴丸型中成药,川芎辛、温,归肝经,冰片辛、苦,微寒,归心脾肺经。2味药合用可充分发挥辛香走窜之力,起到行气活血、祛瘀止痛、活血化瘀、开窍醒神的功效[4]。速效救心丸临床常用于改善冠心病患者心肌缺血状态、缓解心绞痛等症状,其起效快、疗效显著且无明显不良反应[5-7]。研究表明,速效救心丸治疗冠心病心绞痛的疗效优于复方丹参滴丸(同等强度活动心绞痛发作频率减少,心电图ST-T段显著改善,2种药相比有显著性差异),且成本较低[8];针对急性冠状动脉综合征患者改善血液流变学异常的作用强于消心痛(如全血黏度、血浆黏度、血小板黏附率等指标均有显著性差异),且无明显不良反应[9]。目前,关于速效救心丸的研究主要集中在化学成分、体内成分含量测定等方面,其作用机制研究涉及扩张血管、抗血小板聚集、抗动脉粥样硬化、改善再灌注损伤和促进血管新生等[10-12]。由此可见,速效救心丸发挥心肌细胞保护作用的作用机制仍待进一步探索,有关其对体内代谢物轮廓的调节作用尚未见文献报道。
代谢组学把机体作为一个完整的系统来研究,具有整体性、系统性的特点,其研究思路与中医药的整体观和辨证论治特点吻合,为中药复杂系统研究和新药研发提供了有力手段[13]。随着对复杂机体认识的逐步深入,代谢组学研究逐步从潜在标志物的发现转移到代谢机制的研究,通过代谢通路的富集探讨可能的作用通路,为作用机制研究提供科学的数据支撑。本研究采用垂体后叶素(pituitrin,Pit)制备大鼠心肌缺血模型,通过组织病理学及生化指标评价造模情况及速效救心丸药效,并基于超高效液相色谱-四级杆飞行时间质谱联用(UHPLC-QTOF/MS)技术对血浆样本进行代谢组学研究,筛选潜在生物标志物、富集代谢通路,分析速效救心丸对生物标志物的调控作用及可能机制,以期为速效救心丸抗心肌缺血作用机制的阐明提供科学的数据支撑。
1 材料
1.1 动物
清洁级雄性SD大鼠,体质量(200±5)g,6周龄,购自维通利华(北京)实验动物技术有限公司,合格证号SCXK(京)-2016-0011。动物实验按照饲养和使用指南进行,并经北京中医药大学实验动物伦理委员会批准(批准号BUCM-4-2021083102-3044)。实验期间动物昼夜节律正常,并保证其自由进食饮水。
1.2 药品与试剂
速效救心丸(40 mg/粒,批号619350)购自天津中新药业集团股份有限公司;Pit(批号20210811)购自中大兽药有限责任公司;羧甲基纤维素钠(批号S14016)、水合氯醛(批号S24149)购自上海源叶生物科技有限公司;LC-MS级乙腈、HPLC级甲醇购自美国Thermo Fisher Scientific公司。
1.3 仪器
Agilent iFunnel 6550 Q-TOF LC/MS四极杆飞行时间质谱仪,配有四元梯度泵、柱温箱、自动进样器等(美国Agilent公司);AU480型全自动生化分析仪(美国贝克曼库尔特公司);AT201型十万分之一电子天平(瑞士Mettler Toledo公司);Milli-Q超纯水制备仪(德国Millipore公司);KQ-500E型超声波清洗器(昆山市超声仪器有限公司);冷冻离心机(美国Sigma公司);BX53型显微镜(日本Olympus公司)。
2 方法
2.1 药物的配制
速效救心丸研磨后过100目筛,用0.5%羧甲基纤维素钠配制成质量浓度分别为7.56、15.1 mg/mL的混悬液用于大鼠ig给药;配制质量浓度为0.1 g/mL的水合氯醛用于大鼠ip麻醉。
2.2 动物分组与给药
SD大鼠适应性饲养1周后进行实验。将SD大鼠随机分为4组,分别为对照组、模型组和速效救心丸低、高剂量(75.6、151.0 mg/kg,分别相当于临床1、2倍剂量)组,每组8只。各给药组ig相应药物,1次/d,连续7 d。第7天给药后0.5 h,模型组和各给药组ip Pit造模(10 mL/kg)。
2.3 样本收集
造模后3 h进行血浆及心脏样本的收集。大鼠ip水合氯醛麻醉(3.5 mL/kg)后,腹主动脉取血,置于肝素钠润过的离心管中,3500 r/min离心15 min,取上清即得血浆。用生理盐水灌流心脏后取心脏,用多聚甲醛固定用于组织病理学分析。
2.4 生化指标检测及组织病理学
利用全自动生化分析仪测定大鼠血浆中的肌酸激酶(creatine kinase,CK)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、羟丁酸脱氢酶(hydroxybutyrate dehydrogenase,HBDH)、乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)及丙氨酸转氨酶(alanine aminotransferase,ALT)活性。
采用苏木素-伊红(hematoxylin-eosin staining,HE)染色法对靶器官心脏进行染色,观察造模前后及药物对大鼠心脏的影响。取多聚甲醛固定的心脏,经过脱水、包埋、切片、染色后,将其置于光学显微镜下观察,并对主要部位进行拍照。
2.5 代谢组学分析
2.5.1 样品前处理 分别取各组血浆样品200 μL解冻,加入600 μL冷乙腈,涡旋30 s沉淀蛋白,4 ℃、12 000 r/min离心10 min,取上清液真空浓缩。加入100 μL 10%乙腈溶液,超声溶解,4 ℃、12 000 r/min离心15 min,取上清液进样分析。
分别取对照组、模型组和给药组血浆样品各20 μL均匀混合,得到混合血浆样品,记为质控样品。质控样品前处理方法与血浆样品前处理方法相同。每进样分析10个样品后分析1次质控样品,用于评估液质联用系统序列样本分析的稳定性。
2.5.2 UHPLC-QTOF/MS分析
(1)色谱条件:Waters Acquity UPLC HSS T3色谱柱(100 mm×2.1 mm,1.8 μm);流动相为0.1%甲酸水溶液(A)-乙腈(B),梯度洗脱:0~5 min,5%~45% B;5~8 min,45%~80% B;8~10 min,80%~95% B;10~18 min,95% B;18~20 min,95%~5% B;20~22 min,5% B;进样量为正离子模式10 μL,负离子模式5 μL;柱温为35 ℃;体积流量为0.3 mL/min。
(2)质谱条件:正离子模式:干燥气温度为225 ℃;干燥气体积流量为15 L/min;喷雾气压力为241.325 kPa;鞘气温度为350 ℃,鞘气体积流量为11 L/min;喷嘴电压为1500 V;毛细管出口电压为380 V;毛细管电压为4000 V;质谱扫描范围50~1200。负离子模式:干燥气温度为225 ℃;干燥气体积流量为15 L/min;喷雾气压力为241.325 kPa;鞘气温度为350 ℃,鞘气体积流量为11 L/min;喷嘴电压为1500 V;毛细管出口电压为380 V;毛细管电压为3500 V;质谱扫描范围50~1400。
2.5.3 数据处理与统计 将采集到的UHPLC-QTOF/MS数据导入Profinder,对谱图进行峰的发现、对齐、滤过及归一化等操作,导出CEF文件及CSV文件。利用安捷伦Mass Profiler Professional(MPP)软件对导出的CEF文件数据进行批处理,比较模型组与对照组,速效救心丸中、高剂量组与模型组之间的差异。通过单因素方差分析进行多组之间的比较,并以<0.05、fold change>2为筛选条件得到差异代谢物。与此同时,利用SIMCA-P 14.0软件对导出的CSV文件数据进行多元统计分析,包括无监督模式的主成分分析(principal component analysis,PCA)和正交-偏最小二乘法-判别分析(orthogonal- partial least squares- discriminant analysis,OPLS-DA),获取变量重要性投影值(variable importance for projectio,VIP)值,进一步筛选VIP>1且|(corr)|≥0.58的差异代谢物为潜在生物标志物[14-16]。
利用MPP软件中的ID Browser对潜在生物标志物进行化合物鉴别,根据高分辨质谱数据、二级质谱数据结合数据库如Metlin(http://metlin.scripps.edu)、HMDB(http://www. hmdb.ca)等进行化合物鉴定,匹配得到潜在生物标志物名称、京都基因与基因组百科全书(Kyoto encyclopedia of genes and genomes,KEGG)通路ID等信息。运用MetaboAnalyst 5.0(https://www. metaboanalyst.ca/)平台对筛选得到的潜在生物标志物进行富集,获取速效救心丸调控心肌缺血的可能代谢通路。
采用IBM SPSS Statistics 26对生化指标测定结果进行统计分析,以表示含量及偏差,并采用独立样本检验进行组间比较。
3 结果
3.1 速效救心丸对心肌缺血模型大鼠生化指标的影响
如图1所示,与对照组相比,模型组大鼠血浆中CK、LDH、AST和HBDH活性均显著升高(<0.05、0.01),SOD活性显著降低(<0.05);各给药组血浆中CK、LDH、AST和HBDH活性均显著降低(<0.05、0.01),SOD活性显著升高(<0.05、0.01)。
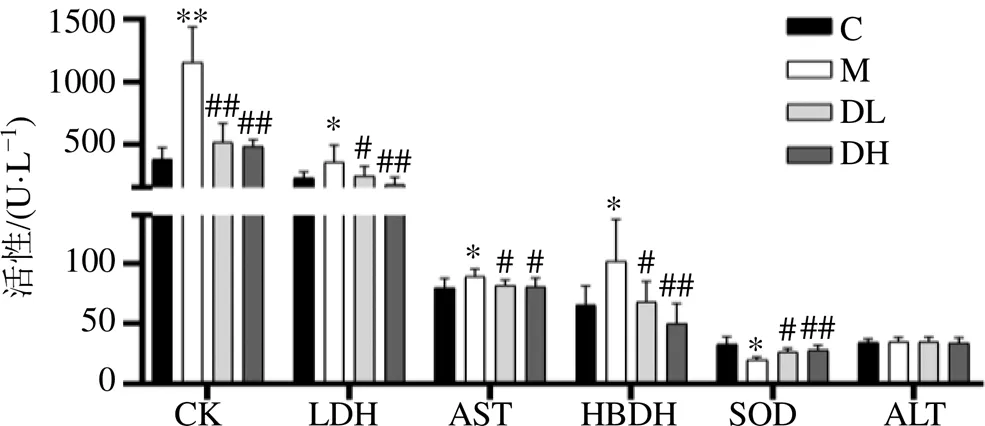
C-对照组 M-模型组 DL-速效救心丸低剂量组 DH-速效救心丸高剂量组,下图同 与对照组比较:*P<0.05 **P<0.01;与模型组比较:#P<0.05 ##P<0.01
3.2 速效救心丸对心肌缺血大鼠心脏组织病理的影响
如图2所示,对照组大鼠心脏心肌细胞结构清晰,组织形态规则,心肌纤维排列正常,未见炎症浸润或坏死;模型组大鼠心脏出现大量的炎症浸润,胞质疏松淡染,局部心肌纤维排列不规则,可见心肌细胞死亡;各给药组上述病理变化明显改善,且以速效救心丸高剂量组作用最佳。组织病理学及生化指标结果表明SD大鼠心肌缺血模型制备成功,速效救心丸具有显著的心脏保护作用,且高剂量组的改善效果较低剂量组更为明显。

图2 速效救心丸对心肌缺血大鼠心脏组织病理变化的影响 (HE, ×100)
3.3 多元统计分析
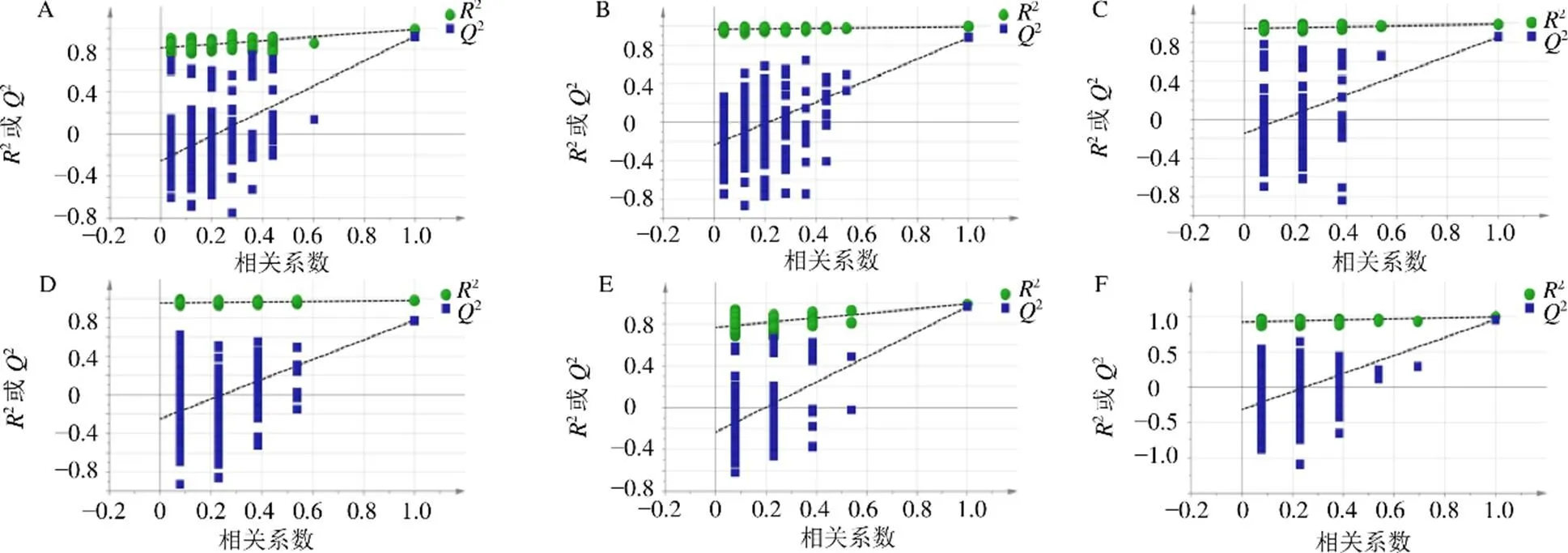
经过Profinder对谱图进行处理后得到6198个离子。将所有离子数据导出CSV文件并导入SIMCA-P软件,采用无监督模式的PCA对各组进行代谢轮廓的整体分析,反映数据的原始状态。结果表明,正、负离子模式下模型组与对照组能够明显分开,速效救心丸低、高剂量组均能与模型组显著分开(图3-A、B)。即造模对大鼠内源性代谢物产生了扰动,而速效救心丸能够缓解这种改变。进一步采用OPLS-DA对2组之间进行有监督的分析比较,发现正、负离子模式下,模型组与对照组、速效救心丸中剂量组与模型组、速效救心丸高剂量组与模型组之间均能很好地分离(图3-C~H)。OPLS-DA模型通过2、2和2进行可靠性判断并分析是否存在过拟合。正离子模式下,模型组与对照组、速效救心丸低剂量组与模型组、速效救心丸高剂量组与模型组的上述指标分别为2=0.272,2=0.986,2=0.922;2=0.369,2=0.989,2=0.856;2=0.408,2=0.991,2=0.966。负离子模式下,上述指标分别为2=0.441,2=0.994,2=0.879;2=0.304,2=0.982,2=0.775;2=0.399,2=0.998,2=0.963。采用置换检验进行OPLS-DA模型验证,经200次置换检验得到的结果见图4,所有模拟值均低于最右侧真实值,且2的回归线截距均小于0.05。以上结果表明模型具有良好的拟合度和预测能力,且不存在过拟合现象。
3.4 分析方法稳定性检测
采用无监督模式的PCA对质控样品进行分析,发现所有质控样本都在2倍标准偏差范围内(图5)。表明该方法具有很好的稳定性和重复性,本次实验所获取的数据稳定可靠。
3.5 潜在生物标志物筛选
为获得与速效救心丸抗心肌缺血作用机制相关的生物标志物,根据“2.5.3”项下方法进行潜在生物标志物的筛选(<0.05、fold change>2、VIP>1且|(corr)|≥0.58),并利用多种软件及数据库进行代谢物的匹配,结合高分辨数据、二级质谱数据及文献信息综合确认潜在生物标志物。共筛选得到39个潜在生物标志物(表1)。对典型的血浆潜在生物标志物进行分析并绘制不同组别的相对峰面积比较图(图6)。与对照组相比,模型大鼠血浆中谷氨酸、苹果酸、柠檬酸、神经酰胺(d18∶1/12∶0)、鞘氨醇、葡萄糖胺-6-磷酸、植物鞘氨醇、氧化谷胱甘肽含量升高,而速效救心丸能够降低这些代谢物的含量;α-酮戊二酸、草酰乙酸、富马酸、1-磷酸鞘氨醇升高,而速效救心丸能够回调这些代谢物。

A、B-正、负离子模式下的PCA得分图 C、D-正、负离子模式下,模型组与对照组OPLS-DA得分图 E、F-正、负离子模式下,速效救心丸低剂量组与模型组OPLS-DA得分图 G、H-正、负离子模式下,速效救心丸高剂量组与模型组OPLS-DA得分图
A、B-正、负离子模式下,模型组与对照组OPLS-DA置换验证结果 C、D-正、负离子模式下,速效救心丸低剂量组与模型组OPLS-DA置换验证结果 E、F-正、负离子模式下,速效救心丸高剂量组与模型组OPLS-DA置换验证结果

图5 正 (A)、负离子模式 (B) 下质控样本PCA得分图
对潜在生物标志物进行热图分析(图7),水平轴代表各组样本,垂直轴代表潜在生物标志物,颜色深浅代表相对峰面积的高低(红棕色表示高,蓝色表示低)。从热图中可看出血浆中潜在生物标志物的含量区分明显,直观地表现了这些潜在生物标志物具有较好的判别能力。

表1 与速效救心丸抗心肌缺血相关的潜在生物标志物
3.6 代谢通路分析
将筛选得到的39个潜在生物标志物导入MetaboAnalyst平台进行代谢通路富集,以代谢通路影响值impact value>0.1和代谢通路显著性水平<0.05为标准进行筛选,共得到7条与速效救心丸抗心肌缺血作用机制密切相关的代谢通路(图8),分别为丙氨酸、天冬氨酸和谷氨酸代谢、三羧酸循环、谷氨酰胺和谷氨酸代谢、鞘脂代谢、精氨酸生物合成、组氨酸代谢、生物素代谢。显著性排名前3的代谢通路涉及能量代谢相关的三羧酸循环以及氨基酸代谢(谷氨酸、谷氨酰胺、丙氨酸、天冬氨酸)等,排名第4的为鞘脂代谢相关通路,提示速效救心丸抗心肌缺血可能与能量代谢调控和鞘脂代谢调控有关。

图6 速效救心丸干预心肌缺血大鼠血浆代谢物的典型差异表达

图7 不同组别潜在生物标志物的热图分析
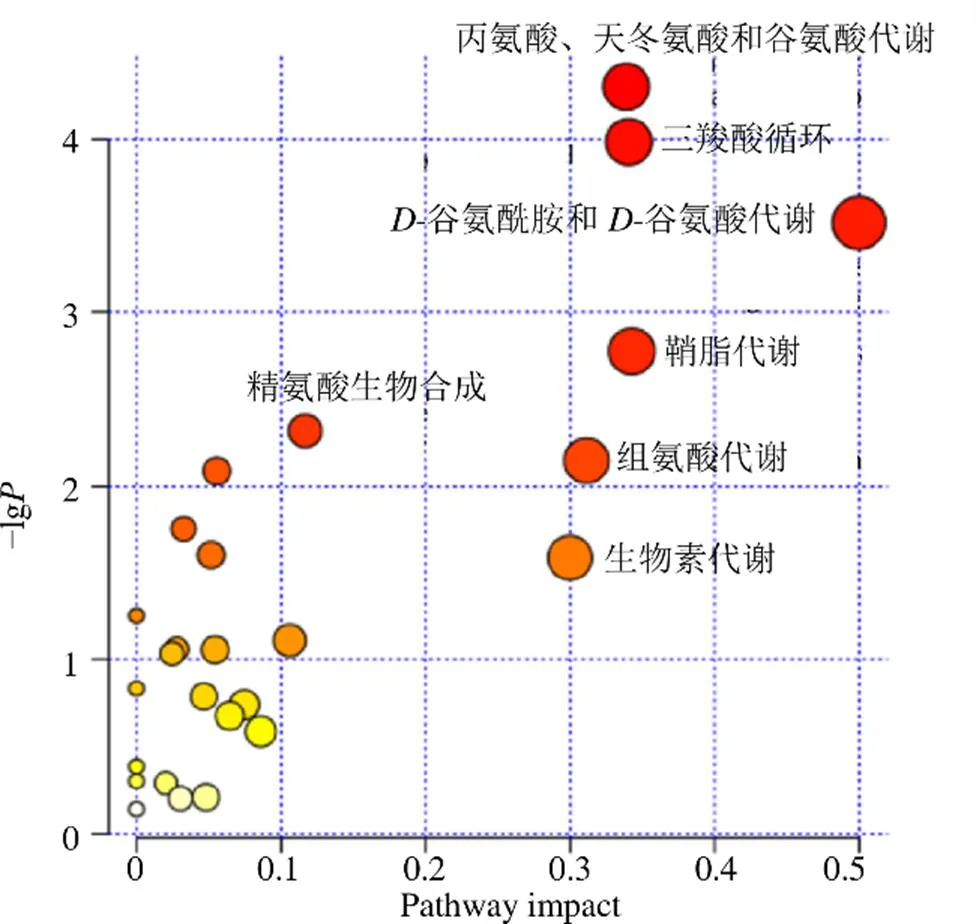
图8 潜在生物标志物代谢通路的富集
4 讨论
本研究以心肌缺血模型大鼠为研究对象,探讨速效救心丸抗心肌缺血的作用机制。通过组织病理学、生化指标分析等对造模情况及速效救心丸药效进行评价,同时利用UHPLC-QTOF/MS技术对大鼠血浆进行代谢组学分析,筛选潜在生物标志物,富集代谢通路,探究其作用机制。本研究共鉴定出39种与心肌缺血密切相关的潜在生物标志物,速效救心丸能够显著回调这些潜在生物标志物。代谢通路分析表明,速效救心丸主要通过调节涉及能量代谢相关的三羧酸循环和氨基酸代谢(如谷氨酸、谷氨酰胺、丙氨酸、天冬氨酸)以及鞘脂代谢等途径发挥作用(图9)。
Pit可诱发冠状动脉痉挛进而引起心肌缺血,所制备的大鼠急性心肌缺血模型与临床中变异性心绞痛的发病过程相似,被广泛应用于抗心肌缺血药物的筛选[17-18]。心肌缺血的发生导致心肌细胞受损,引起细胞膜通透性改变,造成多种酶体、蛋白质及其分解产物大量释放进入血液,其中CK、LDH、AST、HBDH是衡量心肌受损的重要标志物[19-21]。本研究中模型组大鼠上述标志物活性显著升高,反映了造模对大鼠心脏造成了损伤;而给予速效救心丸后上述标志物活性显著下降,表明速效救心丸对心肌缺血大鼠具有心脏保护作用。SOD是活性氧清除剂,能将体内超氧阴离子转化为过氧化氢,再经过其他酶作用转化为水,能够反映机体承受氧化应激的程度[22-23]。本研究中造模后大鼠血浆中SOD活性降低,表明模型组大鼠发生了氧化应激损伤;给药后SOD活性显著升高,表明速效救心丸可有效减轻氧化应激。
心脏是为循环系统提供动力的器官,心脏的持续工作需要足够的能量来实现,而心肌缺血最直接的影响是能量代谢受损[24-25]。三羧酸循环是能量代谢的关键环节,在此过程中,葡萄糖通过糖酵解生成丙酮酸并进一步转化为草酰乙酸进入循环,该循环产生的活性氢最终经过氧化磷酸化产生大量三磷酸腺苷(adenosine triphosphate,ATP),是有氧呼吸最主要的供能方式[26-27]。造模后,三羧酸循环中涉及到的关键代谢物α-酮戊二酸、富马酸、草酰乙酸含量显著降低,柠檬酸、苹果酸含量显著升高,表明心肌缺血模型破坏了三羧酸循环的稳态,干扰了能量供应。速效救心丸显著回调了上述潜在生物标志物,表明速效救心丸可能通过干预上述化合物维持三羧酸循环的稳态,进而保证活性氢的产生,维持心肌缺血情况下的能量供应。
心肌缺血直接导致机体血流量下降,葡萄糖供应不足[28]。因此,调动可以利用的碳源对能量代谢的维持至关重要[29]。除葡萄糖外,氨基酸途径是能量代谢重要的碳源供应[30]。谷氨酸是氨基酸能量代谢途径的一种底物,可经由谷氨酰胺在谷氨酰胺酶的作用下生成,并能通过生成α-酮戊二酸进入三羧酸循环,独立于葡萄糖为三羧酸循环供能[31]。在丙氨酸、天冬氨酸和谷氨酸代谢通路中,草酰乙酸、柠檬酸、α-酮戊二酸、谷氨酸和谷氨酰胺-6-磷酸的含量均发生了明显改变,且速效救心丸能够回调这种改变。表明速效救心丸可能通过调动能量代谢的碳源供应来弥补葡萄糖缺失造成的能量供应不足,进而维持能量代谢,发挥心脏保护作用。
由以上可知,速效救心丸对能量代谢的调控涉及三羧酸循环、氨基酸代谢等多个途径,可能是其有效成分进入体内后,通过作用于潜在生物标志物的关键酶在多条代谢通路发挥其调控作用,进而实现其对心肌缺血大鼠心脏的保护效果,与中药多靶点、多途径的作用特色相吻合[32]。
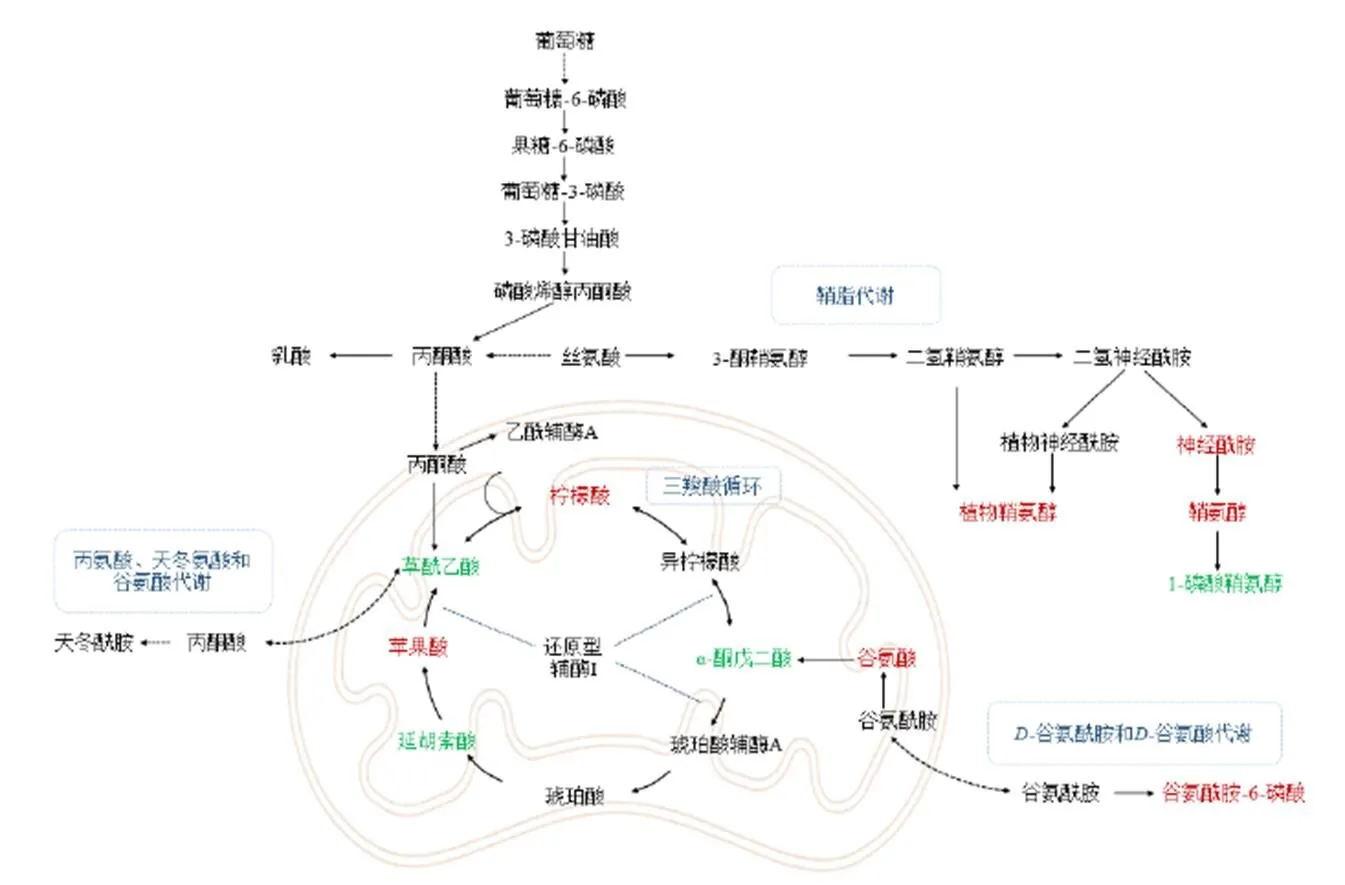
绿色代表潜在生物标志物模型组较对照组下调,给予速效救心丸后上升;红色代表潜在生物标志物模型组较对照组上调,给予速效救心丸后下降
鞘脂类化合物广泛存在于各种生物体中,是细胞膜的主要成分,也是细胞中多种信号传导的重要因子,参与细胞增殖、分化、基因表达和凋亡等过程[33]。也有研究表明,细胞内神经酰胺的堆积是诱发细胞凋亡、引起器官功能障碍的重要因素[34]。研究发现,鞘氨醇能够通过降低细胞收缩力诱导心肌细胞凋亡;植物鞘氨醇能够通过激活半胱氨酸天冬氨酸蛋白酶-3(cystein-asparate protease-3,Caspase-3)、释放细胞色素诱导细胞凋亡[35]。1-磷酸鞘氨醇的信号传导介导了血管生成、血管通透性和血管张力等重要的血管功能[36-37],其受体在维持内皮细胞屏障功能和血管张力等方面发挥重要作用[38]。造模后血浆中鞘氨醇、植物鞘氨醇和神经酰胺(d18∶1/12∶0)含量显著上升,反映出大鼠心肌缺血造模后的损伤;造模后大鼠血浆中1-磷酸鞘氨醇含量显著降低,可能会导致血浆和免疫细胞渗漏到组织中,引发炎症反应;还可能引发血小板聚集,间质间隙纤维蛋白沉积,间接造成血管损伤[39]。速效救心丸能够显著降低鞘氨醇、植物鞘氨醇和神经酰胺(d18∶1/12∶0)这3个鞘脂类化合物含量,并能够显著提高1-磷酸鞘氨醇含量,提示速效救心丸可能通过调节鞘脂代谢来发挥抗心肌缺血的作用。
综上所述,本研究筛选得到了39个与心肌缺血及速效救心丸治疗作用相关的潜在生物标志物,富集到7条代谢通路。分析表明,速效救心丸发挥抗心肌缺血的作用机制可能是通过调节能量代谢相关通路及鞘脂代谢通路来实现的。本研究从代谢组学的角度为速效救心丸防治心肌缺血的作用机制研究提供了科学数据,同时也可为速效救心丸的临床合理应用提供参考。
利益冲突 所有作者均声明不存在利益冲突
[1] McDougal A D, Dewey C F Jr. Modeling oxygen requirements in ischemic cardiomyocytes [J]., 2017, 292(28): 11760-11776.
[2] 马丽媛, 吴亚哲, 王文, 等. 《中国心血管病报告2017》要点解读 [J]. 中国心血管杂志, 2018, 23(1): 3-6.
[3] Thygesen K, Alpert J S, White H D,. Universal definition of myocardial infarction [J]., 2007, 50(22): 2173-2195.
[4] 李镤. 速效救心丸及其新对药: 川芎、冰片 [J]. 北京中医, 2006, 25(9): 575-576.
[5] Duan X, Zhou L, Wu T,. Chinese herbal medicine Suxiao Jiuxin Wan for angina pectoris [J]., 2008(1): CD004473.
[6] 谢大昌, 沈建平. 速效救心丸治疗冠心病心绞痛的临床研究进展 [J]. 中医学报, 2013, 28(6): 891-893.
[7] 刘钰. 速效救心丸联合盐酸地尔硫卓片治疗不稳定型心绞痛的疗效观察[J]. 现代药物与临床, 2017, 32(2): 205-208.
[8] 向会, 郭良君, 张丽丽. 速效救心丸与复方丹参滴丸治疗冠心病心绞痛的成本-效果研究 [J]. 临床合理用药杂志, 2016, 9(36): 11-12, 15.
[9] 申建权, 刘盛冬, 雷长国. 速效救心丸治疗急性冠脉综合征疗效及安全性分析 [J]. 中国实验方剂学杂志, 2011, 17(11): 265-266.
[10] Lu Z Q, Zhang Y J, Zhuang P W,. Protective effect of Suxiao Jiuxin Pill, a traditional Chinese medicine, against acute myocardial ischemia in dogs [J]., 2015, 15: 373.
[11] 陈亚妮, 高俊杰, 朱文叶, 等. 速效救心丸干预心肌缺血/再灌注大鼠线粒体通透性转换孔及心肌细胞凋亡 [J]. 中成药, 2015, 37(3): 469-473.
[12] 陈琳, 张艳, 陈勇. 速效救心丸对心肌缺血大鼠心肌损伤相关蛋白表达的影响[J]. 中草药, 2021, 52(5): 1369-1375.
[13] Wang M, Lamers R J, Korthout H A,. Metabolomics in the context of systems biology: Bridging traditional Chinese medicine and molecular pharmacology [J]., 2005, 19(3): 173-182.
[14] Dunn W B, Ellis D I. Metabolomics: Current analytical platforms and methodologies [J]., 2005, 24(4): 285-294.
[15] Cui L, Lu H T, Lee Y H. Challenges and emergent solutions for LC-MS/MS based untargeted metabolomics in diseases [J]., 2018, 37(6): 772-792.
[16] 马光朝, 章从恩, 马致洁, 等. 基于LC/IT-TOF-MS技术的雷公藤甲素干预溃疡性结肠炎的代谢组学研究 [J]. 中草药, 2020, 51(13): 3493-3500.
[17] 李雪亮, 陈兰英, 官紫祎, 等. 降香新黄酮latifolin对大鼠急性心肌缺血影响及介导Nrf2信号通路机制研究 [J]. 中国中药杂志, 2017, 42(20): 3974-3982.
[18] 谢玲玲, 李仁杰. 山丹颗粒对垂体后叶素致大鼠急性心肌缺血的影响 [J]. 中西医结合心脑血管病杂志, 2020, 18(6): 894-898.
[19] 李瑛, 邵鑫, 李春燕, 等. 基于代谢组学的苦碟子注射液抗心肌缺血作用机制研究 [J]. 中草药, 2021, 52(3): 789-798.
[20] 向红霞, 王鹏娇, 刘燕, 等. 苗岭纳豆素胶囊对大鼠心肌缺血再灌注损伤的保护作用[J]. 中成药, 2018, 40(5): 1025-1030.
[21] 谢静, 贾庆忠. 心悸宁对大鼠急性心肌缺血损伤的保护作用 [J]. 中国实验方剂学杂志, 2013, 19(1): 255-260.
[22] 李慧芳, 庞克坚, 李乐, 等. 天山花楸叶黄酮提取物抗心肌缺血再灌注损伤作用机制研究 [J]. 中草药, 2020, 51(20): 5243-5253.
[23] 宋旺弟, 袁长胜, 崔婷婷, 等. 玫瑰花挥发油对小鼠急性心肌缺血损伤的保护作用研究 [J]. 中草药, 2017, 48(22): 4701-4706.
[24] Wang Z, Zhang F, Liu W,. Impaired tricarboxylic acid cycle flux and mitochondrial aerobic respiration during isoproterenol induced myocardial ischemia is rescued by bilobalide [J]., 2021, 11(6): 764-775.
[25] Guo J H, Yong Y H, Aa J Y,. Compound Danshen Dripping Pills modulate the perturbed energy metabolism in a rat model of acute myocardial ischemia [J]., 2016, 6: 37919.
[26] Liang L F, Sun F, Wang H B,. Metabolomics, metabolic flux analysis and cancer pharmacology [J]., 2021, 224: 107827.
[27] LaManna J C. Hypoxia in the central nervous system [J]., 2007, 43: 139-151.
[28] Wang G, McCain M L, Yang L H,. Modeling the mitochondrial cardiomyopathy of Barth syndrome with induced pluripotent stem cell and heart-on-chip technologies [J]., 2014, 20(6): 616-623.
[29] Chang J C, Hu W F, Lee W S,. Intermittent hypoxia induces autophagy to protect cardiomyocytes from endoplasmic reticulum stress and apoptosis [J]., 2019, 10: 995.
[30] Le A, Lane A N, Hamaker M,. Glucose-independent glutamine metabolism via TCA cycling for proliferation and survival in B cells [J]., 2012, 15(1): 110-121.
[31] Hosios A M, Hecht V C, Danai L V,. Amino acids rather than glucose account for the majority of cell mass in proliferating mammalian cells [J]., 2016, 36(5): 540-549.
[32] Wang X J, Sun H, Zhang A H,. Potential role of metabolomics apporoaches in the area of traditional Chinese medicine: As pillars of the bridge between Chinese and Western medicine [J]., 2011, 55(5): 859-868.
[33] Merrill A H Jr, Stokes T H, Momin,. Sphingolipidomics: A valuable tool for understanding the roles of sphingolipids in biology and disease [J]., 2009, 50: S97-S102.
[34] Collenburg L, Beyersdorf N, Wiese T,. The activity of the neutral sphingomyelinase is important in T cell recruitment and directional migration [J]., 2017, 8: 1007.
[35] Sun L, Liu J X, Sun M Q,. Comprehensive metabonomic analysis of heart tissue from isoproterenol-induced myocardial infarction rat based on reversed-phase and hydrophilic interaction chromatography coupled to mass spectrometry [J]., 2017, 40(10): 2198-2206.
[36] Jung B, Obinata H, Galvani S,. Flow-regulated endothelial S1P receptor-1 signaling sustains vascular development [J]., 2012, 23(3): 600-610.
[37] Cantalupo A, Gargiulo A, Dautaj E,. S1PR1 (sphingosine-1-phosphate receptor 1) signaling regulates blood flow and pressure [J]., 2017, 70(2): 426-434.
[38] McGinley M P, Cohen J A. Sphingosine 1-phosphate receptor modulators in multiple sclerosis and other conditions [J]., 2021, 398(10306): 1184-1194.
[39] Gaengel K, Genové G, Armulik A,. Endothelial-mural cell signaling in vascular development and angiogenesis [J]., 2009, 29(5): 630-638.
Mechanism of Suxiao Jiuxin Pills against myocardial ischemia based on metabolomics
JIA Zhi-xin1, 2, PAN Ming-xia3, LIU Li-rong3, ZHU Mei-xia3, FANG Cong3, YU Zhi-ying3, LIU Jie1, 2, LI Yue-ting2, 3, XIAO Hong-bin1, 2
1. Beijing Research Institute of Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China 2. Research Center for Chinese Medical Analysis and Transformation, Beijing University of Chinese Medicine, Beijing 100029, China 3. School of Chinese Materia Medical, Beijing University of Chinese Medicine, Beijing 100029, China
To study the effect of Suxiao Jiuxin Pills (速效救心丸, SJP) on metabolites in plasma of rats with myocardial ischemia, and preliminarily explore the metabolic pathway and possible mechanism of its intervention on myocardial ischemia.Myocardial ischemia rats model was established by pituitrin and the protective effect of SJP on heart was determined by pathological tissue sections and creatine kinase (CK), alanine aminotransferase (ALT), aspartate aminotransferase (AST), hydroxybutyrate dehydrogenase (HBDH), lactate dehydrogenase (LDH) and superoxide dismutase (SOD) biochemical tests. Metabolomics studies of plasma samples was conducted by UHPLC-QTOF/MS to screen potential biomarkers and enrich metabolic pathways.SJP significantly improved the pathological changes of heart in rats with myocardial ischemia; Significantly decreased the activities of CK, AST, HBDH and LDH in plasma (0.05, 0.01), and increased SOD activity (0.05, 0.01). A total of 39 potential biomarkers were screened, mainly involving 7 metabolic pathways including alanine, aspartic acid and glutamate metabolism, tricarboxylic acid cycle, glutamine and glutamate metabolism.SJP can effectively improve myocardial ischemia injury in model rats, and may play a role in related pathways such as energy metabolism and sphingolipid metabolism.
Suxiao Jiuxin Pills; myocardial ischemia; metabolomics; potential biomarkers; energy metabolism; sphingolipid metabolism; alanine, aspartic acid and glutamate metabolism; tricarboxylic acid cycle
R285.5
A
0253 - 2670(2022)15 - 4719 - 11
10.7501/j.issn.0253-2670.2022.15.015
2022-04-13
北京市自然科学基金资助项目(7214284)
贾志鑫,博士,助理研究员,研究方向为药物分析、代谢组学、中药药效物质研究。Tel: (010)53911875 E-mail: jessiejzx@163.com
通信作者:肖红斌,博士,教授,研究方向为药物分析、中药新药研发。Tel: (010)53911883 E-mail: hbxiao69@163.com
[责任编辑 李亚楠]