蚯蚓对不同pH值土壤中铬赋存及细菌群落的影响特征
王浩羽,韦杰,孙进宇,宋言,顾强,宓文海,居静,赵海涛*,封克
(1.扬州大学环境科学与工程学院,江苏 扬州 225127;2.江苏省扬州农业环境安全技术服务中心,江苏 扬州 225127;3.农业农村部耕地质量监测与评价重点实验室,江苏 扬州 225127)
土壤铬(Cr)污染对农业的破坏和对动植物的不利影响日益加剧,Cr中毒会抑制植物生长,引起动物器官功能障碍,导致人类哮喘、皮炎,甚至癌症等疾病。因此,土壤中Cr的迁移和转化始终被广泛关注。
蚯蚓被誉为陆地生态系统的“工程师”,其可以通过摄食和被动扩散作用富集土壤重金属,对评估土壤污染物毒性具有重要的生态毒理学意义。重金属污染的土壤会对蚯蚓产生氧化胁迫,导致其出现应激反应,并且蚯蚓会通过改变自身功能酶活性和环境微生物群落结构来响应环境毒性。蚯蚓的取食活动有助于增强土壤微生物的活性和数量,并改变微生物种群结构特征。接种蚯蚓对不同酸碱性土壤中土壤微生物菌群结构影响较大,可将与金属迁移转化相关的菌群转变为优势菌群。微生物能够将重金属离子吸附在其细胞壁表面,同时还可以通过氧化-还原作用、甲基化作用和脱烃作用,将重金属离子转化为其他化合物形式。土壤重金属分为酸可提取态、可还原态、可氧化态以及残渣态4种,酸可提取态重金属生物有效性较高,可还原态和可氧化态重金属生物有效性较低,残渣态重金属为潜在不流动部分。土壤pH值显著影响重金属赋存形态,特别是可交换态的赋存特征。蚯蚓能够改变土壤中重金属的赋存环境与赋存特征,继而改变重金属的生物有效性。研究表明,蚯蚓的活动能够改变土壤pH值,提高土壤中腐殖质和有机酸含量,从而引起金属元素移动性发生改变。也有研究发现蚯蚓可以分泌并释放出—COOH和—CO等化学基团激活重金属,同时排出多种凝胶物质,活化土壤重金属离子。
综上可知,土壤微生物区系特征和土壤pH值显著影响土壤重金属赋存形态,蚯蚓活动显著改变了土壤微生物区系特征和土壤pH值,继而能够改变土壤中重金属赋存特征。然而鲜见蚯蚓活动对土壤Cr赋存形态影响的研究。因此本研究以不同酸碱度、不同Cr含量的土壤为对象,研究蚯蚓对土壤Cr赋存和土壤细菌群落的影响,为利用蚯蚓移除土壤Cr提供理论依据。
1 材料与方法
1.1 试验材料
供试蚯蚓为赤子爱胜蚓(),3月龄,具有明显生育环,大小基本一致,平均体质量为512 mg·条;试验用重铬酸钾(KCrO)为优级纯。试验用酸性土壤取自福建省三明市,中性土壤取自江苏省扬州农业环境安全技术服务中心沙头试验基地,碱性土壤取自江苏省盐城市大丰区,土壤基本性质见表1。

表1 供试土壤基本性质Table 1 Basic properties of test soil
1.2 试验设计
试验设土壤Cr浓度(C1:15 mg·kg、C2:50 mg·kg),接种蚯蚓(E0:不接种蚯蚓,E1:接种赤子爱胜蚓),土壤酸碱性(S:酸性,Z:中性,J:碱性)3种变量,共12个处理,每个处理3次重复。首先,供试土壤风干后过2 mm筛,向土壤中定量加入30 g·L重铬酸钾溶液,搅拌混匀,将土壤中Cr浓度调为15 mg·kg(低Cr含量)和50 mg·kg(高Cr含量),敞口避光静置45 d。其次,将静置后的土壤放入圆柱形塑料桶中(口径16 cm、底径13 cm、高17.5 cm),每个塑料桶装土1.0 kg,加入纯净水控制土壤含水量为饱和持水量的60%,静置7 d,加入40条经清肠处理的赤子爱胜蚓,以不添加蚯蚓为对照。第三,将各处理置于室内培养,并在桶口盖上一层纱布,防止蚯蚓逃逸,通过空调控制白天室温20~26℃,夜晚室温16~20℃,通过称取质量的方法每天补充纯净水,保持土壤含水量为饱和持水量的60%。蚯蚓处理30 d后,采集土壤、蚯蚓等样品,测定各指标。试验过程中无蚯蚓逃逸和死亡。
1.3 测定项目与方法
土壤pH值采用5∶1水土比浸提法测定。土壤总Cr测定采用王小琳等提出的方法。Cr去除率=(接种蚯蚓前土壤总Cr含量-接种蚯蚓后土壤总Cr含量)/接种蚯蚓前土壤总Cr含量×100%。酸可提取态Cr、可还原态Cr、可氧化态Cr以及残渣态Cr的测定采用张永利等提出的方法。各形态Cr含量占比=各形态Cr含量/总Cr含量×100%。
蚯蚓生物量测定:蚯蚓样品收集后放入吸满纯净水的定性滤纸上清肠12 h,然后,用吸水纸吸干蚯蚓体表水分,称质量。蚯蚓抑制率=(接种蚯蚓前蚯蚓生物量-接种蚯蚓后蚯蚓生物量)/接种蚯蚓前蚯蚓生物量×100%。蚯蚓体Cr富集量:清肠后的蚯蚓用吸水纸吸干蚯蚓体表水分,于-30℃下冷冻,然后放入烘箱65℃烘48 h,磨碎后采用王水-高氯酸消煮-原子吸收光谱法测定Cr含量。在测定土壤和蚯蚓体内重金属含量时加入标准土GBW07978(GSS-36),并保持加标回收率在95%以上。
土壤细菌群落多样性委托上海美吉生物制药科技有限公司采用基于Illumina MiSeq测序平台的高通量测序技术测定。利用双末端测序(Paired-End)的方法,构建小片段文库进行双末端测序。细菌的PCR体系包括:扩增时采用两管平行的方式,扩增体系为50 µL体系,包括Mix(Pfu·Easy)25 µL,上游引物27F-FAM 1 µL,下游引物907R 1 µL,ddHO 22 µL,以及DNA模板1 µL。PCR的反应程序:94℃变性3 min;94℃30 s,58℃30 s,70℃1 min,循环30次;72℃延伸10 min。
1.4 统计分析
采用Excel软件进行数据统计,SPSS 23.0软件对数据进行统计分析,数据正态分布检验和转换采用夏皮洛-威尔克检验法(Shapiro-Wilk法),数据分析采用单因素方差分析(One way ANOVA)模型检验,各处理间的差异显著性使用新复极差法(Duncan分析),采用Origin 8.5和Excel软件绘图,细菌群落测序数据依托Majorbio平台分析。
2 结果与分析
2.1 土壤pH值
不同酸碱性的Cr污染土壤在接种蚯蚓后,土壤pH值均发生了变化。由图1可知,酸性土壤接种蚯蚓后,土壤pH值提高了4.19%(C1)和4.01%(C2),且从改善效果来看,低Cr含量处理优于高Cr含量处理;中性和碱性土壤接种蚯蚓后,ZC1、ZC2、JC1和JC2的土壤pH值分别相应降低了5.21%、4.38%、3.98%和3.11%,且接种蚯蚓后,低Cr含量土壤pH值变化量大于高Cr含量土壤;中性土处理优于碱性土处理。综上,接种蚯蚓后,土壤pH值均向中性转变,虽无显著差异,但总体上低Cr含量土壤的pH值变化量大于高Cr含量处理。
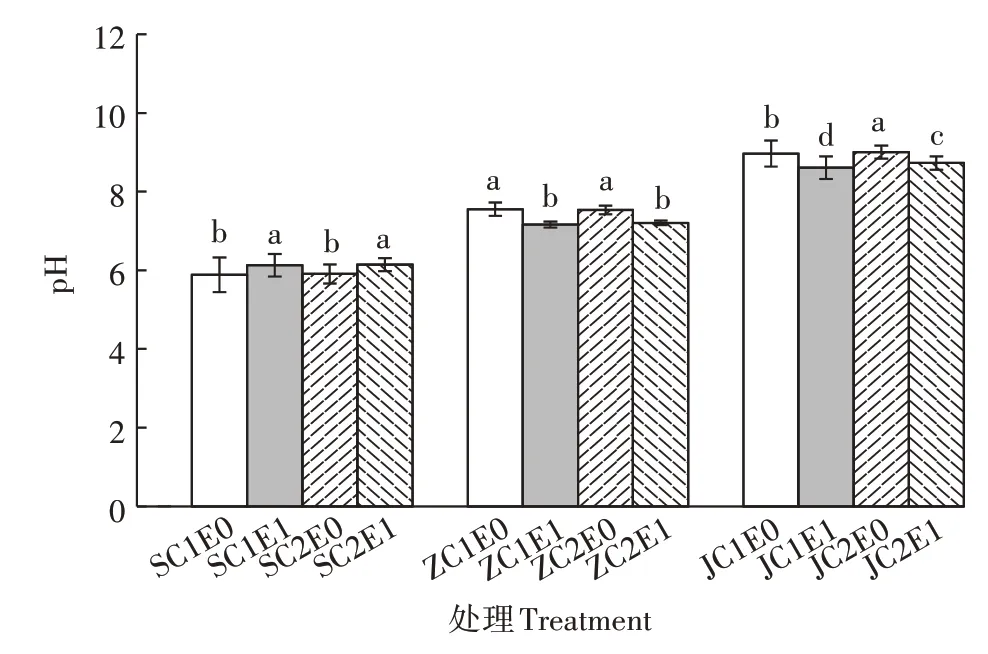
图1 土壤中pH值的变化情况Figure 1 Changes of pH value in soil
2.2 土壤中Cr的赋存特征
2.2.1 土壤中Cr的去除率
已知在未接种蚯蚓,即静置状态下,土壤中Cr的去除率近似为0。由图2可知,不同酸碱性的Cr污染土壤在接种蚯蚓后,土壤Cr去除率显著提高了34.66~62.74个百分点。中性土处理优于碱性土和酸性土处理,在低Cr含量土壤中,ZC1E1(62.74%)显著高于JC1E1(54.94%)和SC1E1(60.69%),SC1E1显著高于JC1E1,在高Cr含量土壤中,ZC2E1(37.51%)显著高于JC2E1(35.40%)和SC2E1(34.66%)。在任一酸碱度土壤中,蚯蚓对低Cr含量土壤中的Cr去除率均优于高Cr含量土壤。总体来说,接种蚯蚓能够显著提高Cr的去除率,并且对中性低Cr含量土壤的Cd去除率最好。
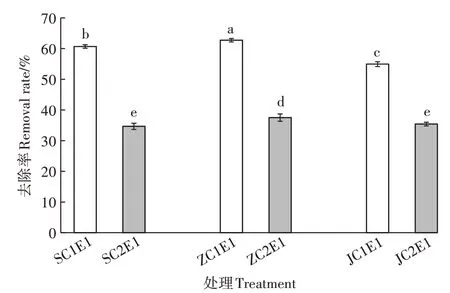
图2 土壤中Cr的去除率Figure 2 The removal rate of Cr in the soil
2.2.2 土壤中Cr的各形态特征
不同酸碱性的Cr污染土壤在接种蚯蚓后,土壤Cr的赋存形态发生了显著变化。由图3可知,酸性土壤接种蚯蚓后,土壤中的酸可提取态Cr和可还原态Cr在低Cr含量土壤(C1)中分别提高了27.58个和26.70个百分点,在高Cr含量土壤(C2)中分别提高了21.99个和23.86个百分点;可氧化态Cr和残渣态Cr在C1处理中分别降低了10.03个和44.24个百分点,在C2处理中分别降低了20.47个和25.39个百分点。中性土壤接种蚯蚓后,土壤中的酸可提取态Cr和可还原态Cr在C1处理中分别提高了26.65个和11.37个百分点,在C2处理中分别提高了23.58个和23.90个百分点;可氧化态Cr和残渣态Cr在C1处理中分别降低了3.59个和34.42个百分点,在C2处理中分别降低了19.85个和27.64个百分点。碱性土壤接种蚯蚓后,土壤中的酸可提取态Cr和可还原态Cr在C1处理中分别提高了23.56个和21.53个百分点,在C2处理中分别提高了22.37个和23.41个百分点;可氧化态Cr和残渣态Cr在C1处理中分别降低了19.49个和25.60个百分点,在C2处理中分别降低了17.83个和27.94个百分点。综上,接种蚯蚓能够有效提高土壤中Cr的生物有效性,土壤中稳定态Cr(残渣态、可氧化态)的含量显著降低,活性态Cr(酸可提取态、可还原态)的含量显著增加。蚯蚓对酸性低Cr含量土壤中的Cr的活化作用最强。
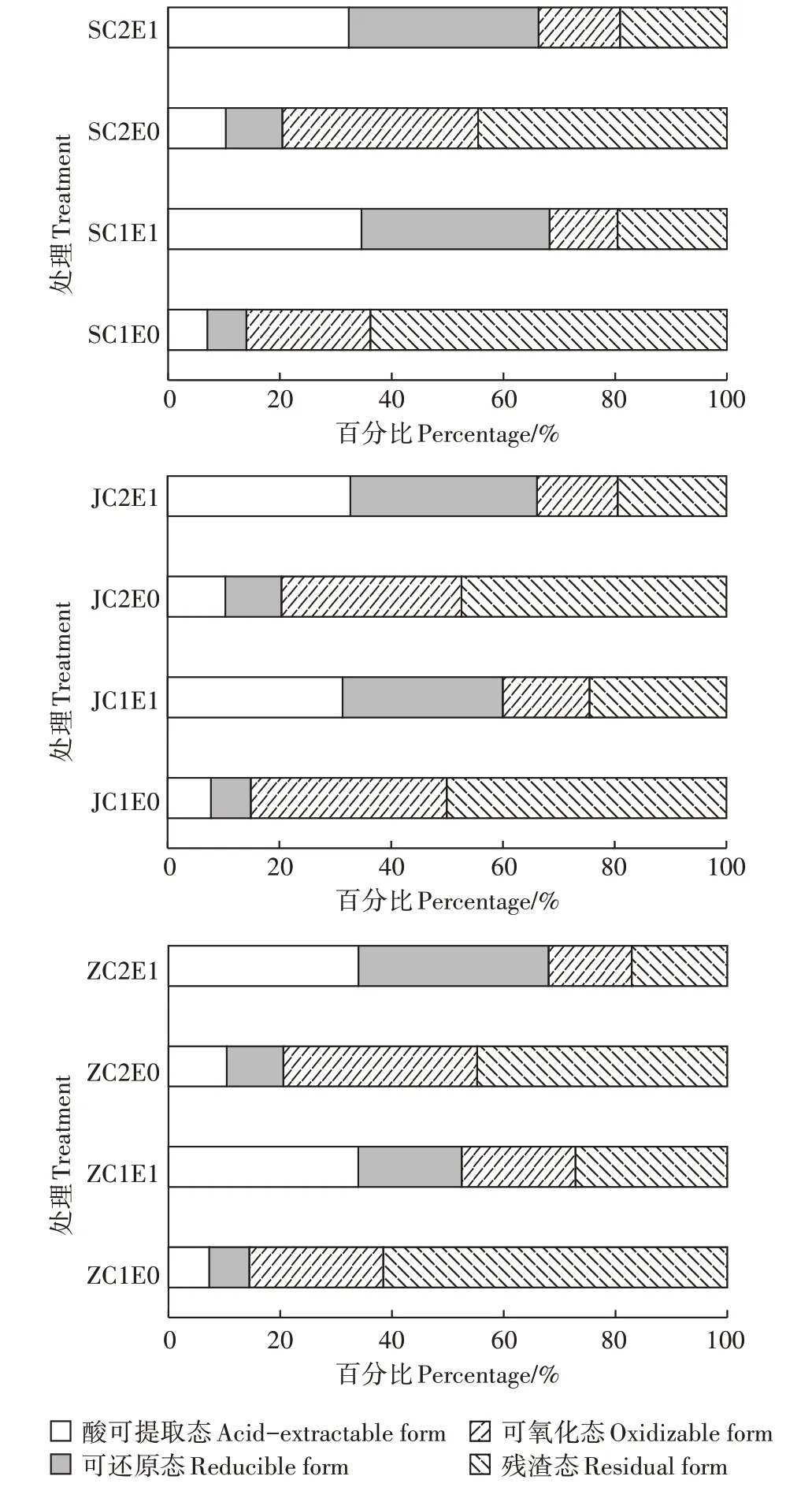
图3 土壤中Cr的各形态占比变化情况Figure 3 Changes of various forms and proportions of Cr in soil
2.3 蚯蚓生物量抑制率与Cr富集量
由表2可知,蚯蚓吞食不同酸碱性的Cr污染土壤后蚯蚓生物量的抑制率为9.25%~26.58%,高Cr含量土壤中蚯蚓生物量的抑制率显著高于低Cr含量土壤,碱性土、酸性土和中性土处理对蚯蚓生物量的抑制率依次降低。本试验条件下,蚯蚓能够富集0.44~1.08 mg·g的土壤Cr,高Cr含量土壤中蚯蚓体Cr富集量显著高于低Cr含量土壤,酸性土处理中蚯蚓体Cr富集量高于中性土和碱性土处理,但差异不显著。综上,高Cr含量土壤中蚯蚓生物量的抑制率和蚯蚓体Cr富集量均显著高于低Cr含量土壤,碱性土处理中蚯蚓生物量的抑制率最高,酸性土处理中蚯蚓体Cr富集量最高。

表2 蚯蚓生物量抑制率与Cr富集量Table 2 Inhibition rate of earthworm body and Cr enrichment
2.4 土壤细菌群落变化情况
不同酸碱性的Cr污染土壤接种蚯蚓后,土壤细菌群落多样性和丰度发生显著变化。由表3可知,接种蚯蚓后,酸性土和中性土处理中土壤细菌群落的Shannon多样性指数显著降低,碱性土处理中土壤细菌群落的Shannon多样性指数在低Cr含量下显著降低,高Cr含量下变化不显著。接种蚯蚓后,SC1E1和JC2E1处理中土壤细菌群落的Chao指数和ACE指数均显著提高,中性土处理中土壤细菌群落的Chao指数和ACE指数变化不显著,碱性土处理中土壤细菌群落的Chao指数和ACE指数均显著高于酸性土和中性土处理。总体来说,接种蚯蚓提高了土壤Chao指数和ACE指数,即提高了细菌群落的丰度,降低了土壤Shannon多样性指数,即降低了细菌群落的多样性。

表3 土壤细菌群落多样性和丰度分析(OTU水平)Table 3 Analysis of diversity and abundance of soil bacterial community(OTU level)
进一步分析(图4)可知,接种蚯蚓后,在门水平上3种酸碱度土壤的细菌群落结构物种丰度均发生了改变。变形菌门(Proteobacteria)、放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidota)为优势菌群。酸性土接种蚯蚓后(图4A),土壤中变形菌门丰度提高了17个百分点(C1);放线菌门丰度降低了22个百分点(C1)和13个百分点(C2);绿弯菌门丰度提高了7个百分点(C2);拟杆菌门丰度降低了2个百分点(C1)和4个百分点(C2)。中性土接种蚯蚓后(图4B),土壤中变形菌门丰度C1处理提高了6个百分点,C2处理降低了27个百分点;放线菌门丰度提高了25个百分点(C2);拟杆菌门丰度降低了2个百分点(C1)和10个百分点(C2);绿弯菌门丰度提高了7个百分点(C2)。碱性土接种蚯蚓后(图4C),土壤中变形菌门丰度降低了9个百分点(C1)和7个百分点(C2);放线菌门丰度提高了23个百分点(C1)和5个百分点(C2);拟杆菌门丰度两处理均降低了6个百分点。总之,不同酸碱性Cr污染土壤接种蚯蚓,提高了土壤细菌群落中绿弯菌门丰度,降低了拟杆菌门丰度,酸性土处理的变形菌门丰度提高,放线菌门丰度降低,而中性土和碱性土处理的变形菌门丰度降低,放线菌门丰度提高,这与酸性土处理变化趋势相反。
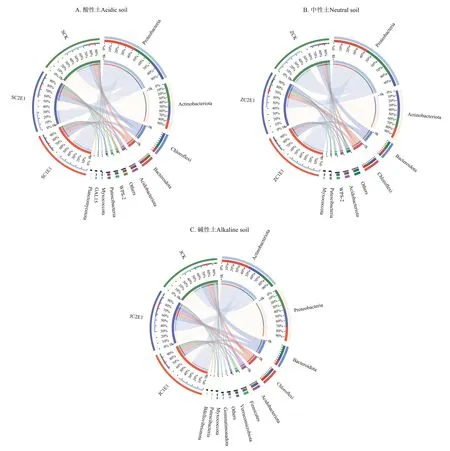
图4 不同酸碱性土壤中细菌群落(门水平)变化情况Figure 4 Changes of bacterial community(phylum level)in soils with different pH
在属水平上(图5),各处理中丰度占比较高的物种为黄杆菌属()、关节杆菌属()、气单胞菌属()、嗜糖假单胞菌属()、汉单胞菌属()、北里孢菌属()、丛毛单胞菌属()、鞘脂单胞菌属()和红球菌属()。酸性土壤接种蚯蚓后,土壤的黄杆菌属、气单胞菌属、类诺卡氏菌属()丰度降低,嗜糖假单胞菌属、丛毛单胞菌属丰度提高;中性土壤接种蚯蚓后,土壤的关节杆菌属、汉单胞菌属、北里孢菌属、丛毛单胞菌属的丰度提高,嗜糖假单胞菌属的丰度降低;碱性土壤接种蚯蚓后,土壤的黄杆菌属、气单胞菌属的丰度降低,红球菌属的丰度提高。
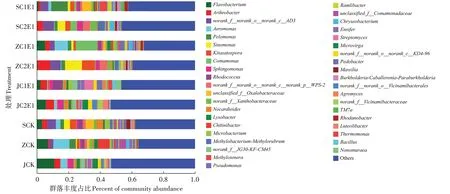
图5 不同酸碱性土壤中细菌群落(属水平)变化情况Figure 5 Changes of bacterial community(genus level)in soils with different pH
由相关性分析(图6)可知,不同酸碱性的Cr污染土壤接种蚯蚓后,酸可提取态Cr含量与溶杆菌属()、剑菌属()呈显著负相关,与假单胞杆菌属()、气单胞菌属呈极显著负相关,与关节杆菌属呈显著正相关;可还原态Cr含量与假单胞杆菌属呈显著负相关,与气单胞菌属、溶杆菌属呈极显著负相关,与鞘脂单胞菌属呈显著正相关;可氧化态Cr含量与红球菌属、微杆菌属()呈显著负相关,与鞘脂单胞菌属呈显著正相关;残渣态Cr含量与类诺卡氏菌属、微枝形杆菌属()呈显著正相关。
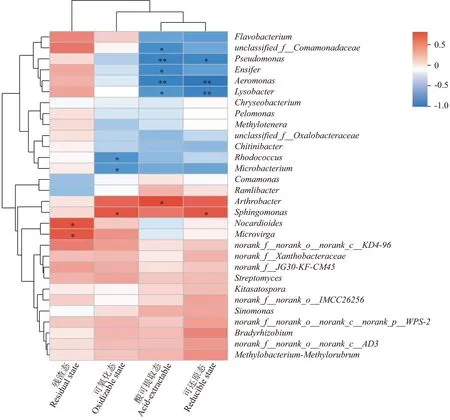
图6 土壤细菌群落与各形态Cr含量相关性分析Figure 6 Correlation analysis between soil bacterial community and Cr content of various forms
3 讨论
3.1 接种蚯蚓对土壤pH值的影响
在接种蚯蚓后土壤pH值会发生改变,前人研究发现蚯蚓对土壤pH值的影响是双向的,蚯蚓既可以分泌化学基团导致土壤酸化,又可以通过自身钙化腺将钙化合物排泄到环境中导致土壤pH值升高。而在本研究中,接种蚯蚓使土壤pH值趋向中性,这可能与蚯蚓肠道具有稳定的中性pH值密切相关,土壤经过蚯蚓肠道时,蚯蚓肠道中的酸碱平衡体系使得吞食后的土壤偏中性。土壤pH值是影响重金属吸附-解吸行为和生物有效性的关键因素,在本试验中,接种蚯蚓前后,酸性土壤中Cr的生物有效性均是最高,许多研究也证实了土壤pH值与金属有效性呈负相关的关系。本研究发现,从蚯蚓对不同酸碱性土壤pH值的改善效果来看,低Cr含量处理优于高Cr含量处理,而且接种蚯蚓对Cr的活化效果亦是如此,这表示蚯蚓对土壤pH值的改变可能与Cr的生物有效性存在一定联系。
3.2 接种蚯蚓对土壤中Cr赋存的影响
蚯蚓能够通过摄食和被动扩散作用富集土壤中的重金属,其对重金属的富集量随着污染程度的增加而上升。本研究发现,接种蚯蚓后,高Cr含量土壤中的Cr去除率约为36%,低Cr含量土壤中的Cr去除率约为58%,高Cr含量土壤中蚯蚓体Cr富集量显著高于低Cr含量处理。
蚯蚓可以提高土壤中重金属的生物有效性,增加其流动部分。本研究发现,接种蚯蚓后酸性土处理中酸可提取态Cr提高了约24个百分点,残渣态Cr降低了约35个百分点;中性土处理中酸可提取态Cr提高了约25个百分点,残渣态Cr降低了约31个百分点;碱性土处理中酸可提取态Cr提高了约22个百分点,残渣态Cr降低了约26个百分点;土壤中Cr由潜在不流动形态向生物有效性较高的形态迁移,从而提高了植物对Cr的吸收富集。前人研究发现蚯蚓过腹可以活化土壤中的重金属,并显著增加植物的富集量,蚯蚓也可以强化伴矿景天对土壤中重金属的修复效应。研究证明蚯蚓的活动可以改变土壤pH值,影响土壤有机物分解,提高土壤中的腐殖质、有机酸含量和溶解性有机碳(DOC)含量,从而增加重金属的溶解性,提高其生物有效性。有研究发现Cu在通过赤子爱胜蚓肠道后,由于有机质的分解,形成了具有高Cu络合能力的小分子有机酸,从而增加了Cu的流动性。在物理方面,蚯蚓通过挖洞吞食行为,对土壤进行了再分配,这被认为是增加重金属生物有效性的因素之一。蚯蚓活动还可以刺激土壤微生物活动,增加微生物数量并增强微生物活性,而微生物活动可以直接或间接影响土壤重金属的存在形态,如WANG等发现,蚯蚓与丛枝菌根真菌结合能够提高土壤DTPA-Cr的含量。同时有研究发现,接种蚯蚓不同时间后土壤中重金属的形态变化也不同,张冬明等研究发现,长期接种蚯蚓(60 d)比短期接种蚯蚓(30 d)对砖红壤中Pb的活化效果更好,而本试验仅选择了常规的30 d这一周期,后续试验中还需要探究更长周期的规律。
3.3 接种蚯蚓对土壤细菌群落的影响
微生物活性和群落结构变化能敏感地反映土壤质量和健康状况,是土壤环境质量评价的重要生物学指标,而细菌是微生物中主要且重要的构成。有研究指出,土壤细菌群落特征对土壤重金属赋存形态存在显著影响。接种蚯蚓导致土壤细菌群落结构、多样性和丰度发生变化,从而提高了土壤中重金属的生物有效性,增加了植物对重金属的吸收。在本研究中,接种蚯蚓后,土壤的细菌群落多样性(Shannon指数)降低,这与XIA等的研究具有较高的一致性。本研究还表明,接种蚯蚓后土壤细菌群落的丰度(Chao指数、ACE指数)显著提高,原因可能是在Cd污染土壤中蚯蚓暴露会扰乱肠道中的微生物群落平衡,并提升蚯蚓肠道中的重金属抗性细菌丰度,而蚓粪中菌群与蚯蚓肠道微生物相关性极高。另外蚯蚓肠道内容物的pH值接近中性,水分和水溶性糖的含量均高于原土壤,从而为微生物的繁殖提供了条件,这也是导致菌群丰度提高的主要原因。本研究中,接种蚯蚓后,酸性土的变形菌门丰度提高,放线菌门丰度降低,而中性土和碱性土的变形菌门和拟杆菌门丰度降低,放线菌门丰度提高,并且低含量Cr土壤菌群丰度变化比高含量Cr土壤小,这与TANG等的研究类似,而且接种蚯蚓后优势菌群为变形菌门和放线菌门,这也与前人研究相符。优势菌群变化的原因可能是蚯蚓选择性吞食菌种以及肠道液对微生物的刺激作用,而且蚯蚓通过摄取、改变和混合有机残留物和矿质土壤可以直接影响生态系统的结构和功能,这些行为改变了土壤结构及其化学和生物学性质,从而改变了土壤细菌群落的组成。
在本研究中,接种蚯蚓后,土壤中芽孢杆菌属和丛毛单胞菌属的丰度增加,这两者是耐重金属污染和具有修复重金属能力的细菌,且丛毛单胞菌属也被证实对多种污染物有很好的降解效果。研究还发现假单胞杆菌属与生物有效性较高的Cr形态呈负相关,而金属载体通常由土壤中假单胞菌等产生,所以这也可能是接种蚯蚓使土壤中Cr去除和Cr活化增加的原因。此外,接种蚯蚓后,碱性土低Cr含量处理中芽孢杆菌属的丰度高于高Cr含量处理。有研究发现,蚯蚓取食弱碱性矿区土壤和酸性矿区土壤会增加土壤中假单胞杆菌属和芽孢杆菌属的丰度,这可能是因为此菌属对Cr具有较强的抗性。接种赤子爱胜蚓和威廉环毛蚓产生的鞘氨醇杆菌属()已被证明与超富集植物东南景天可联合有效控制污染土壤中Cd含量,接种(sp.qz-1)产碱菌可以增加玉米对土壤Cr的吸收量,而植物对重金属的吸收与其生物有效性密切相关,这证明了细菌和重金属活性存在着一定的相关性,而蚯蚓就极有可能是二者间的桥梁。
4 结论
(1)不同酸碱性的Cr污染土壤在接种蚯蚓后,土壤pH值趋向中性。
(2)接种蚯蚓显著提高了土壤的Cr去除率,其中中性低Cr含量处理的效果最佳;同时能够有效提高土壤中Cr的生物有效性,且对酸性低Cr含量处理的活化效果最好。
(3)接种蚯蚓改变了土壤细菌群落的构成:变形菌门、放线菌门、绿弯菌门和拟杆菌门为优势菌群,降低了菌群的多样性,提高了菌群的丰度。土壤中酸可提取态和可还原态Cr含量与溶杆菌属、剑菌属、假单胞杆菌属、气单胞菌属呈负相关,与关节杆菌属呈正相关;土壤中残渣态和可氧化态Cr含量与红球菌属、微杆菌属呈负相关,与类诺卡氏菌属、微枝形杆菌属呈正相关。

