氧化石墨烯和多环芳烃复合暴露诱导成年斑马鱼脑组织毒性及其代谢研究
孙晶,李伟,丛瑞,胡献刚,欧阳少虎*
(1.生态环境部海河流域北海海域生态环境监督管理局生态环境监测与科学研究中心,天津 300061;2.南开大学环境科学与工程学院,环境污染过程与基准教育部重点实验室,天津市城市生态环境修复与污染防治重点实验室,天津 300071)
近年来,碳基纳米材料(Carbon-based nanomaterials,CNs)在农业生产链条各环节上的应用越来越广泛,尤其是在纳米农业化学品方面。氧化石墨烯(Graphene oxide,GO)作为一类重要的CNs,因其优越的理化性质而得到了广泛的研究和使用,也因此其排放到环境中的风险越来越大。多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是一类由两个或两个以上苯环按照线性、角状或者簇状方式相连组成的中性或非极性挥发性有机化合物,是重要的环境和食品污染物。我国地表水体中PAHs的含量差异很大。例如,长江部分区域表层水中PAHs的含量为1 630 ng·L,部分地区水体中的PAHs含量达到了7 596.56 ng·L。CNs(包括GO)进入环境后可以吸附多种有机污染物(如PAHs和农药等),二者联合毒性可能是协同的、拮抗的或是抑制的。因此,CNs与环境中有机污染物对水生生物的联合暴露毒性作用和相关机制亟待进一步探究和评估。
鱼类在人类的生产生活中占有重要地位,而斑马鱼是一种经典的环境毒理学模式生物,同时也是研究纳米材料和PAHs的水生态毒性的常用模型生物。多环芳烃受体(AhR)是斑马鱼应对PAHs影响的受体之一,可用于PAHs对斑马鱼的毒性评估;细胞色素P4501A1(CYP1A1)酶的含量是衡量芳烃和类芳烃对生物影响的重要指标,其含量和表达与AhR的活性密切相关。为考察GO与PAHs对水生生物的联合毒性效应,本研究选取环境中常见的16种PAHs为代表,将环境预测浓度的GO与环境当量浓度PAHs同时暴露于成年斑马鱼21 d,对暴露后斑马鱼脑组织的AhR活性、CYP1A1酶水平结合代谢组学进行研究,从内源代谢物层面深入阐述GO和PAHs复合暴露对成年斑马鱼脑组织毒性的影响,为全面评估GO在环境中的潜在毒理效应提供技术方法和理论参考数据。
1 材料与方法
1.1 GO与PAHs的购置与配制

由已有研究可知,0.01 mg·L和0.1 mg·L的GO浓度更接近其环境浓度,故本研究中,斑马鱼成鱼暴露的GO浓度选取0.01 mg·L和0.1 mg·L;参考近年来我国地表水体中各种不同PAHs的平均浓度,同时考虑到进行低浓度亚急性毒性效应测试(21 d),因此选择了较低的斑马鱼成鱼的暴露PAHs(16种优控PAHs混标)浓度,即每种PAHs的浓度均为5µg·L。GO和PAHs母液的具体配制过程如下:称取50.00 mg GO加入到1 L浓度为60 mg·L的天然海盐水中,冰浴超声30 min,得到分散性较好的50 mg·LGO母液;PAHs在水中溶解度低,因此使用二甲基亚砜(DMSO)作为助溶剂,且为了使各暴露组中DMSO的最终浓度小于0.01%(质量比),配制5 mg·LPAHs混标溶液母液(即16种优控PAHs中每种PAHs的浓度均为5 mg·L),用移液器准确量取0.1 mL含有16种优控PAHs的混标溶液(浓度为2 000 mg·L)溶于39.9 mL DMSO中。在进行21 d斑马鱼成鱼毒性暴露实验时,将上述配制得到的GO和PAHs母液用60 mg·L的天然海盐水稀释得到所需浓度。
1.2 斑马鱼饲养与毒性暴露
1.2.1 斑马鱼的饲养
本研究暴露生物为6~8月龄AB型野生斑马鱼成鱼,饲养于配备循环水泵的30 L水箱中,饲养水为60 mg·L天然海盐水,水温为(28±1)℃,光照程序为10 h黑暗/14 h光照。使用商业鱼饲料(寸金,中国)进行饲养,每天投喂两次,投喂量以斑马鱼1 min内吃完为宜。
1.2.2 斑马鱼毒性暴露实验
开始暴露前,将斑马鱼置于人工气候箱(博讯,SPX-400IC,中国)进行环境适应,气候箱温度、光照程序以及喂食均与饲养环境一致。在两周的适应期结束后,36条健康且体型相近的斑马鱼被随机分成6组,分别为对照组(CK)、0.01 mg·LGO暴露组(GO01组)、0.1 mg·LGO暴露组(GO1组)、5 µg·LPAHs暴露组(PAHs组)、0.01 mg·LGO+5 µg·LPAHs复合暴露组(PAHs-GO01组)和0.1 mg·LGO+5 µg·LPAHs复合暴露组(PAHs-GO1组),每组6条斑马鱼。暴露组每组置于相应1 L烧杯中,烧杯中水深为(23±2)cm,水温为(28.0±0.5)℃,光照周期为14 h光照/10 h黑暗。在为期21 d的暴露中,斑马鱼暴露液每隔1 d更换一次。
1.2.3 斑马鱼脑组织的获取
完成21 d的暴露实验后,使用3%三卡因(Sigma,99%,美国)对斑马鱼施行安乐死。然后,迅速使用冰冷的生理盐水清洗斑马鱼,并将其置于解剖盘上进行解剖。解剖过程中,迅速取出斑马鱼脑组织,使用冰冷的生理盐水清洗干净后装入洁净灭菌的离心管中,置于冰上备用。若当时不使用组织,则将其置入液氮中3 min使其固定,固定后样品存储于-80°C冰箱备用。
1.3 GO和PAHs复合暴露对斑马鱼脑AhR活性和CYP1A1酶的影响实验
将对照组和暴露组的斑马鱼脑组织转移至1.5 mL离心管中,加入200 µL冰冷的生理盐水,使用电动组织匀浆器将组织匀浆2 min,制成斑马鱼脑组织匀浆。将斑马鱼脑组织匀浆使用冷冻离心机在4℃、4 000 r·min条件下离心5 min,吸取上清液备用。斑马鱼脑组织AhR活性和CYP1A1酶的含量使用酶联免疫法(ELISA)试剂盒(上海哈灵,中国)测定。测试过程严格按照试剂盒说明书进行,样本为斑马鱼脑组织生理盐水匀浆上清液。斑马鱼脑组织匀浆上清液蛋白质含量由BCA蛋白试剂盒(南京建成,中国)测定,测定过程严格按照试剂盒说明书进行。
1.4 斑马鱼脑组织代谢组学的分析
将暴露组和对照组的脑组织清洗完毕后迅速置入液氮中,3 min后将样品取出,置于液氮上的洁净研钵中将组织研磨成粉末后进行代谢物提取,每个浓度包含3个平行样品。代谢物提取过程:(1)在研磨好的样品中加入5 mL提前保存于-20 °C中的提取混合溶液Ⅰ(甲醇-氯仿-水,体积比2.5∶1∶1);(2)微波辅助萃取,40℃、30 min,萃取完成后离心,收集上清液,然后加入5 mL提前保存于-20℃中的提取混合溶液Ⅰ(甲醇-氯仿-水,体积比2.5∶1∶1),微波辅助萃取,40℃、15 min;(3)收集第二次上清液,并与第一次收集的上清液混合于15 mL离心管中,加入500µL灭菌后的去离子水,4 000 r·min离心5 min;(4)将离心管静置,上层溶液是甲醇/水相,下层为氯仿相。甲醇/水相冷冻干燥,氯仿相用氮气吹干;(5)样品干燥后,采用两步法进行衍生化:①加入50µL用吡啶溶解的甲氧氨基盐酸盐(20 mg·mL),密封、涡旋、短暂离心,30℃温浴90 min;②加入80µL硅烷化试剂N-甲基-N-(三甲基硅烷)-三氟乙酰胺(MSTFA),37℃温浴30 min;(6)转移已衍生化的样品至适合气相色谱质谱仪(GC-MS)分析的内衬管中。
衍生化后的斑马鱼代谢物使用GC-MS(6890A/5977A,Agilent,美国)分析。气相色谱进样参数:进样量1µL,进样口温度230℃,调整分流进样模式(1∶50),载气为氦气,流速2 mL·min,使用自动进样器进样。气相色谱参数:MDN-35毛细管色谱柱(30 m),温度程序为80℃恒温2 min,然后以15℃·min的速率升温到330℃,持续6 min,传输线(Transfer Line)温度设定为250℃。质谱参数:离子源温度设定为250℃,质量扫描范围/为70~600,采集速率为每秒扫描20次,质谱电子轰击源灯丝开启时间在色谱溶剂延迟170 s后,检测器电压为1 700~1 850 V,质谱亏损设置为0,灯丝偏置电流为70 V,仪器自动调谐。谱图解卷积参数:力可公司自带的商业软件Chroma TOF,基线消除(Baseline Offset)设置为1(0.5~1);谱图平滑(Smoothing)为5数据点(3~7),峰宽(Peak Width)3 s(3~4 s);信噪比S/N(Signal-Tonoise Ratio)为10(2~15)。
1.5 数据统计分析
所有的实验组均设置3个或3个以上生物重复,结果用平均值±标准偏差表示。所得实验数据使用SPSS 20.0统计软件进行单因素方差(ANOVA)分析,当<0.05时,认为在统计学上具有显著性差异。斑马鱼脑组织代谢物数据采用均一化处理(其中未检出的代谢物使用0代替),以减小因数量级差距带来的系统误差。使用软件MeV 4.9绘制代谢物热图,同时将筛选出的代谢物数据导入SIMCA-P11.5软件包进行多元统计分析,数据先用无监督统计模型主成分分析(Principal components analysis,PCA),得出对照组和暴露组之间代谢物的离散趋势。斑马鱼脑组织的差异代谢物:当某暴露组(GO1、PAHs和PAHs-GO1组)的一种代谢物峰面积平均值与同一对照组代谢物峰面积平均值比值>1.50时,则该代谢物为显著上调代谢物;当比值<0.67时,则该代谢物为显著下调代谢物。将上述筛选出来的差异性代谢产物输入至代谢分析网站(http://www.metaboanalyst.ca/),点击Pathway Analysis中(zebrafish)(KEGG)进行斑马鱼脑组织代谢通路变化分析。数据条形图和线图均使用Origin 8.5绘制。
2 结果与分析
2.1 斑马鱼脑组织AhR活性和CYP1A1酶含量的变化
如 图1a所 示,与CK组 相 比,GO01、PAHs和PAHs-GO01组均未引起斑马鱼脑组织AhR活性的显著变化(>0.05)。GO1组和PAHs-GO1组的AhR受体活性与CK相比显著下降(<0.05),但两暴露组之间差异并不显著。如图1b所示,斑马鱼脑组织CYP1A1酶的含量表明,除PAHs处理组,GO01、GO1、PAHs-GO01和PAHs-GO1组暴露的斑马鱼脑组织中CYP1A1含量都出现了显著性(<0.05)的下降。其中,GO1组斑马鱼脑组织中CYP1A1酶含量的下降最为显著,该结果与斑马鱼脑组织AhR活性结果趋势类似。

图1 斑马鱼脑组织AhR活性和CYP1A1酶含量分析Figure 1 Zebrafish brain AhR activity and CYP1A1 enzyme content analysis
2.2 斑马鱼脑组织代谢组学的变化
本研究共检测出32种代谢物,包含10种氨基酸(如色氨酸、脯氨酸和缬氨酸等)、16种小分子酸和脂肪酸(如苹果酸、硬脂酸和花生四烯酸等),以及6种其他小分子代谢物(如蔗糖、肌醇和胆固醇等),其相对含量可用代谢物热图(图2a)表示。代谢物热图分析结果表明,经GO1、PAHs和PAHs-GO1暴露后,斑马鱼成鱼脑组织中的代谢物含量与CK组相比有所差异。为进一步研究GO1组、PAHs组和PAHs-GO1处理对斑马鱼脑组织代谢组学的影响区别,将检测出的斑马鱼代谢物水平进行了PCA聚类分析,结果如图2b所示,图中红色箭头的长度指示暴露组与CK组之间的差异程度,与CK组之间差异的大小与箭头长度成正比。对比GO1、PAHs和PAHs-GO1暴露组PCA分析结果,可知对斑马鱼代谢物影响最大的组为PAHs组,其次为PAHs-GO1组,而GO1组对斑马鱼脑组织代谢物的影响最小。

图2 CK组、GO1组、PAHs组和PAHs-GO1组斑马鱼脑组织代谢物以及代谢物PCA分析Figure 2 Metabolites and their PCA analysis of zebrafish's brain tissues in CK,GO1,PAHs,and PAHs-GO1 groups
本研究将暴露组与CK组代谢物含量比值>1.50或<0.67分别视为显著性上调或者下调代谢产物,以此为标准,可以获得GO1组、PAHs组和PAHs-GO1组的显著差异代谢物的类别、数量以及上下调情况,结果如表1所示。由表可知,在所有处理组中具有最多显著差异代谢物的是PAHs组,共有26种,其主要组成为:9种下调氨基酸(如丝氨酸、脯氨酸、谷氨酸和缬氨酸等)、13种脂肪酸和小分子酸(如柠檬酸、苹果酸、壬酸和花生四烯酸等)和4种其他下调小分子代谢物(蔗糖、肌醇、尿素和尿嘧啶)。PAHs-GO1组中的显著差异代谢物有21种,略少于PAHs组,其中包括6种显著下调氨基酸,包括丝氨酸、脯氨酸、赖氨酸和DL-鸟氨酸等;12种脂肪酸和小分子酸,包括柠檬酸、苹果酸、丙二酸和花生酸等;3种其他下调小分子代谢物,包括蔗糖、肌酐和尿嘧啶。显著差异代谢物最少的是GO1组,主要包括4种氨基酸(丝氨酸、亮氨酸、甘氨酸和DL-鸟氨酸)、9种脂肪酸和小分子酸(如柠檬酸、苹果酸、癸二酸和十七烷酸等),以及2种其他小分子代谢物(肌醇和尿嘧啶),共15种。由以上结果可知,所有暴露组的显著差异代谢物水平排序为GO1组<PAHs-GO1组<PAHs组。3个暴露组中的显著差异代谢物既有相同也有不同,具体表现为:丝氨酸、甘氨酸、DL-鸟氨酸、乳酸、对苯二甲酸和尿嘧啶在3个暴露组中均显著下调,而花生四烯酸在3个暴露组中均显著下调;苏氨酸、L-谷氨酸、缬氨酸、4-氨基丁酸、十五烷酸、肌醇和尿素仅在PAHs组中出现了显著差异;脯氨酸、赖氨酸、丙二酸、蔗糖、壬酸和花生酸6种代谢物在GO1组中不是显著差异物,而在PAHs组和PAHs-GO1组中均相比于CK有显著变化;显著下调代谢物脯氨酸、赖氨酸、丙二酸和蔗糖在PAHs组中的差异倍数均大于这5种代谢物在PAHs-GO1组的差异倍数。
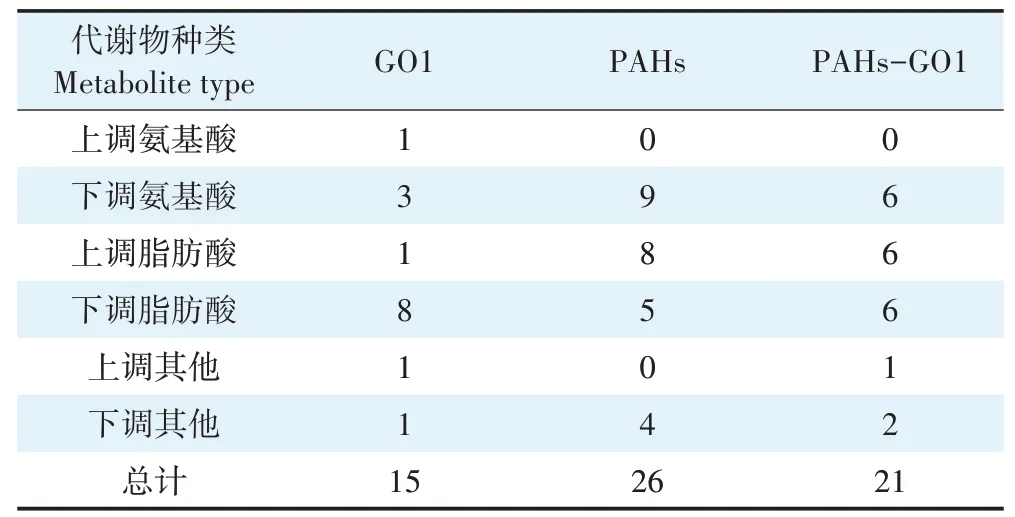
表1 GO1组、PAHs组和PAHs-GO1组显著差异代谢物数量统计Table 1 Statistical number table of metabolites with significant differences in GO1,PAHs and PAHs-GO1 groups
2.3 斑马鱼脑组织代谢通路的变化
根据本研究中的显著差异代谢物得到的GO1组、PAHs组和PAHs-GO1组的脑组织显著变化(<0.05)的代谢通路见表2。结果表明,PAHs组拥有最多的显著差异变化的代谢通路,共8个;GO1组造成了斑马鱼脑组织3个代谢通路的显著变化,PAHs-GO1组仅引起了2个代谢通路的显著变化。以上代谢通路结果与代谢物差异分析结果(表1)一致。

表2 暴露组显著变化代谢通路Table 2 The significantly changed metabolic pathways table in the exposure group
3 讨论
有报道指出,在高浓度的两种PAHs作用下斑马鱼幼鱼的急性毒性反应可通过AhR活性的变化来表现,同时P450抗氧化酶相关基因和也会受到影响。有研究表明,生物线粒体活性氧的产生与AhR相关,而活性氧又与生物的氧化损伤密切相关。本研究中,各处理组AhR活性变化趋势(图1a)与CYP1A1酶含量(图1b)一致,说明两者之间可能存在正向相关性。LI等的研究认为GO对PAHs引起的水稻根部AhR活性变化有促进作用,而本研究中GO1组与PAHs-GO1组的AhR活性与CYP1A1酶含量没有显著差异(>0.05),其原因可能为:与植物根部直接与PAHs和GO接触不同,成年斑马鱼血脑屏障会降低PAHs和GO对脑组织的影响;PAHs和GO在同一浓度下对不同物种的影响,尤其对动物和植物的影响程度可能不同。
有报道指出,PAHs可以扰乱生物的代谢通路。尽管在本研究中PAHs的暴露浓度明显小于以往研究,但依然诱发了大量的脂质和氨基酸变化,且代谢组学对PAHs的响应相较于GO更明显(PAHs组>PAHs-GO1组>GO1组,表1和表2)。尽管GO组诱发的差异变化脂肪酸数量小于PAHs组,但GO组差异代谢脂肪酸在总差异代谢物中的占比(60%)大于PAHs组(50%),说明在代谢物变化中GO对脂肪酸的影响更大。氧化酶的损伤是GO对生物的重要效应之一,其变化也与脂质的变化密切相关。GO1组中CYP1A1酶含量低于PAHs组(图1b),这与上述暴露组代谢物中脂肪酸的变化趋势一致。PAHs与石墨烯类纳米材料的相互作用可能会改变纳米材料表面的性质,如SUN等认为,PAHs与石墨烯类材料进行相互作用时,PAHs会填充还原GO之间的孔隙,而纳米材料的结构和表面官能团也是影响其毒性的重要指标。而在本研究中,PAHs-GO1组的显著差异代谢物的组成与GO组高度相似,说明在本研究浓度下,GO与PAHs对成年斑马鱼的复合暴露中,GO可能占据主导地位。但PAHs-GO1组诱发的显著差异代谢物数量已经超过了GO组,这可能是由于PAHs并没有完全被GO吸附,当PAHs浓度增大时其可能诱发的环境和生态风险仍不能忽视。
以上结果说明,在0.1 mg·L的GO与5µg·L的PAHs复合暴露时,对斑马鱼脑组织AhR活性和CYP1A1酶含量产生毒性效应的物质主要是GO。相比于单独暴露的GO组和PAHs组,GO-PAHs复合暴露中AhR活性(图1a)和CYP1A1酶含量都要高于GO组(图1b),且GO-PAHs诱发的差异代谢通路数量少于GO和PAHs组(表2),说明PAHs与GO的复合暴露效应为轻微的拮抗效应。另外,PAHs诱发的显著变化代谢物和代谢通路的数量和种类都超过了单独GO暴露组和GO-PAHs复合组,说明低浓度PAHs水平暴露依然可以诱发斑马鱼脑组织的代谢毒性。以上结果提示,不应仅根据常规指标来对联合毒性进行研究,还应结合更加灵敏的分子手段,对新型污染物与环境污染物的联合毒性进行更为全面的评估和研究。本文研究的是GO与16种优控PAHs混标对斑马鱼成鱼的毒理效应的影响,而不同种类PAHs性质差别很大,在未来研究中应该加强GO与不同单一PAHs的复合毒性效应研究,以加深对GO与不同性质PAHs联合暴露时的复合毒理差异的理解。
4 结论
(1)氧化石墨烯(GO)暴露对斑马鱼脑组织的影响重点在于氧化酶及相应过程,而与多环芳烃(PAHs)的复合暴露对斑马鱼脑组织的影响侧重于代谢物的变化。
(2)0.1 mg·LGO与5 µg·LPAHs组对斑马鱼脑组织的效应与GO组对脑组织的效应较为相似,说明该浓度的复合暴露中GO的作用占主导,但PAHs诱发的效应也不容忽视。
(3)在0.1 mg·LGO与5 µg·LPAHs对斑马鱼脑组织复合暴露时,PAHs与GO的复合暴露效应为轻微的拮抗效应。

