离子反应考点例析
程天元
(山东省泰安第一中学 271000)
1 离子大量共存
离子能否大量共存,需综合考虑以下四个方面:
(1)能否发生复分解型的离子反应(生成气体、沉淀、弱电解质);
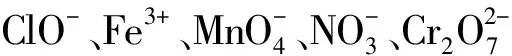
(3)能否发生络合反应(如Fe3+和SCN-);
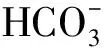
例1下列各组离子因发生氧化还原反应而不能大量共存的是( ).
C.Na+、Cu2+、Cl-、S2-
D.Fe3+、K+、SCN-、Cl-
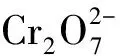
答案:A
2 离子方程式正误判断
离子方程式正误判断主要考察反应是否真正发生、物质拆分、元素守恒、电荷守恒等基本问题,还会涉及一些有关量的离子方程式书写,如NaHCO3溶液与过量的Ca(OH)2溶液的反应,NaHCO3溶液与少量的Ca(OH)2溶液的反应,解决办法可将少量的定为“1 mol”.这部分学生掌握起来略有难度,需要综合考虑.
例2下列离子方程式书写正确的是( ).
A.碳酸镁与稀硫酸反应:
B.将CO2通入过量的NaOH溶液中:
3.过氧化氢使酸性高锰酸钾溶液褪色:
D.向含1 mol FeI2溶液中通入1.5 mol Cl2所发生反应的离子方程式:

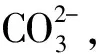
8H2O+2Mn2++5O2↑
D项考查有关量的方程式书写,I-的还原性强于Fe2+,Cl2先和I-反应,即

反应需要1mol Cl2,剩余0.5 mol Cl2正好能和1mol Fe2+反应,故I-和Fe2+按2∶1反应,离子方程式应为:

D项错误.
答案:B
3 离子检验
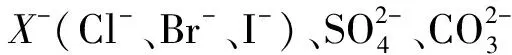
例3对于某些离子的检验及结论中一定正确的是( ).
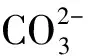

D.加入硝酸银溶液后产生白色沉淀,再加盐酸,白色沉淀不消失,一定有Cl-
答案:C.
4 离子推断
解答此类题目可走“四步法”:第一步,依据实验现象,得出一定存在的离子;第二步,根据离子共存,由一定存在的离子推出与之不共存的离子,即这些离子一定没有;第三步,电荷守恒,即根据溶液呈电中性,阳离子所带正电荷数=阴离子所带负电荷数,推测某离子存在或计算某离子浓度;第四步,进出性原则,即在实验过程中所加试剂引入什么离子,是否造成干扰.

①取50mL溶液置于大烧杯中,向溶液中加入过量的BaCl2溶液振荡,有白色沉淀生成;过滤,洗涤,干燥,后称得4.30 g固体;
②将所得白色固体配成悬浊液后加入过量稀硝酸,白色沉淀部分消失,并有气泡产生;将剩余固体过滤、洗涤、干燥后称量得到2.33 g;
③取少量①实验后上层清液滴入AgNO3溶液,有白色沉淀生成.
(1)原溶液中一定含有的离子是____;一定不含有的离子是:____;可能含有的离子是____.
(2)若经证明没有Cl-,则该溶液中K+的物质的量浓度是____.

5 溶液的导电性
解答此类题目的关键在于分析溶液中离子浓度的变化,若是图像题,应清楚“拐点即恰反应点”,明确拐点对应的离子反应方程式.
例5在两份相同的Ba(OH)2溶液中,分别滴入等物质的量浓度的H2SO4和NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图1所示.下列分析不正确的是( ).
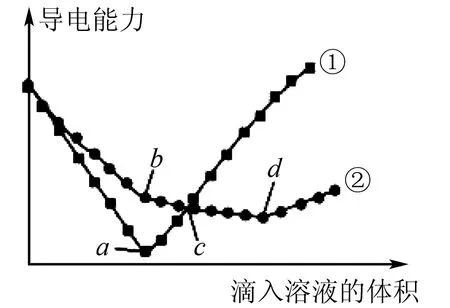
图1
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.c点,两溶液中含有相同量的OH-
D.a、d两点对应的溶液均显中性
解析两个过程中对应的化学方程式为:



拐点a对应溶液的导电能力最低,即Ba(OH)2和H2SO4恰好完全反应生成BaSO4和H2O,此时溶液中离子浓度最小,故正确;B项,拐点b对应Ba(OH)2和NaHSO4恰沉淀点,即②,所得溶液的溶质是NaOH,故正确;C项,拐点d对应Ba(OH)2和NaHSO4恰中和点,所得溶液中溶质为Na2SO4,由b到d即NaOH逐渐被中和的过程,曲线②的c点是碱性溶液,曲线①的c点是酸性溶液,两者中的OH-一定不相等,故C项错误;D项a、d两点对应的溶液分别为H2O和Na2SO4溶液,均显中性,故正确.答案:C

